大型浅水湖泊太湖藻类浊度与非藻类浊度的变异规律
2021-06-02卞世俊崔永德王海军
马 雨 李 艳 卞世俊, 崔永德 王海军
(1. 大连海洋大学, 大连 116023; 2. 中国科学院水生生物研究所淡水生态与生物技术国家重点实验室, 武汉 430072;3. 华中师范大学, 武汉 430079)
在湖泊生态系统中, 沉水植物在清水稳态维持方面具有重要的作用[1], 可通过抵御风浪、降低沉积物再悬浮和抑制浮游藻类生长等方式控制水体浊度从而提升透明度[2,3]。有研究表明, 有沉水植物分布的湖泊中, 其浊度显著低于无沉水植物的湖泊[4—6]。然而上述研究主要集中于中小型浅水湖泊(< 355 km2), 大型浅水湖泊中沉水植物对浊度的作用尚不明确。因此, 有必要研究大型浅水湖泊中水体浊度的变异规律及沉水植物对浊度的影响, 以便了解大型浅水湖泊生态系统状态维持和稳态转换的发生机制。
水体的浊度按照其形成原因可简单地分为藻类浊度(由浮游藻类颗粒形成)、非藻类颗粒浊度(由浮游藻类之外的颗粒形成)和背景浊度(水中无悬浮颗粒时的浊度)。相比中小型湖泊, 大型湖泊水域面积更广,风的吹程更长, 因此, 风力对沉积物的扰动也更强, 水体非藻类浊度也可能更高。此外, 大型湖泊由于强大风力对沉积物造成的剪切作用, 沉水植物往往难以在较大范围内生存, 其分布多局限于近岸带或湖湾区[7,8]。因此我们推测, 相比中小型浅水湖泊, 在相同营养条件下大型浅水湖泊中水体浊度更高, 沉水植物对浊度的抑制效果也相对更弱。
为验证以上假设, 本研究以典型大型浅水湖泊太湖为例, 分析有沉水植物分布(有草区)及无沉水植物分布(无草区)的湖区中藻类浊度(TurbAlg)、非藻类浊度(TurbNonAlg)及其对总浊度(TurbTot)贡献率的变异规律, 及其与水体总磷(TP)的关系, 以期阐释大型浅水湖泊中水体浊度的变异规律及沉水植物对浊度的抑制效果。
1 材料与方法
研究对象太湖地处长江中下游三角洲南部, 位于北纬30°55′40″—31°32′58″和东经119°52′32″—120°36′10″之间, 横跨江浙两省, 是中国第三大淡水湖。本研究根据一般划分习惯(水利部太湖流域管理局)将太湖划分为6个区域: 竺山湾、梅梁湾、贡湖湾、胥口湾、东太湖和湖心区(图 1)。根据野外调查情况, 结合文献报道, 将目前有沉水植物分布的贡湖湾、胥口湾和东太湖划分为有草区, 竺山湾、梅梁湾和湖心区则划分为无草区。野外调查分别于2018年8月(夏季)、11月(秋季)、2019年2月(冬季)、5月(春季)进行, 共开展4次。采样样点共45个, 其中竺山湾3个、梅梁湾4个、贡湖湾4个、胥口湾3个、东太湖19个和湖心区12个(图 1)。
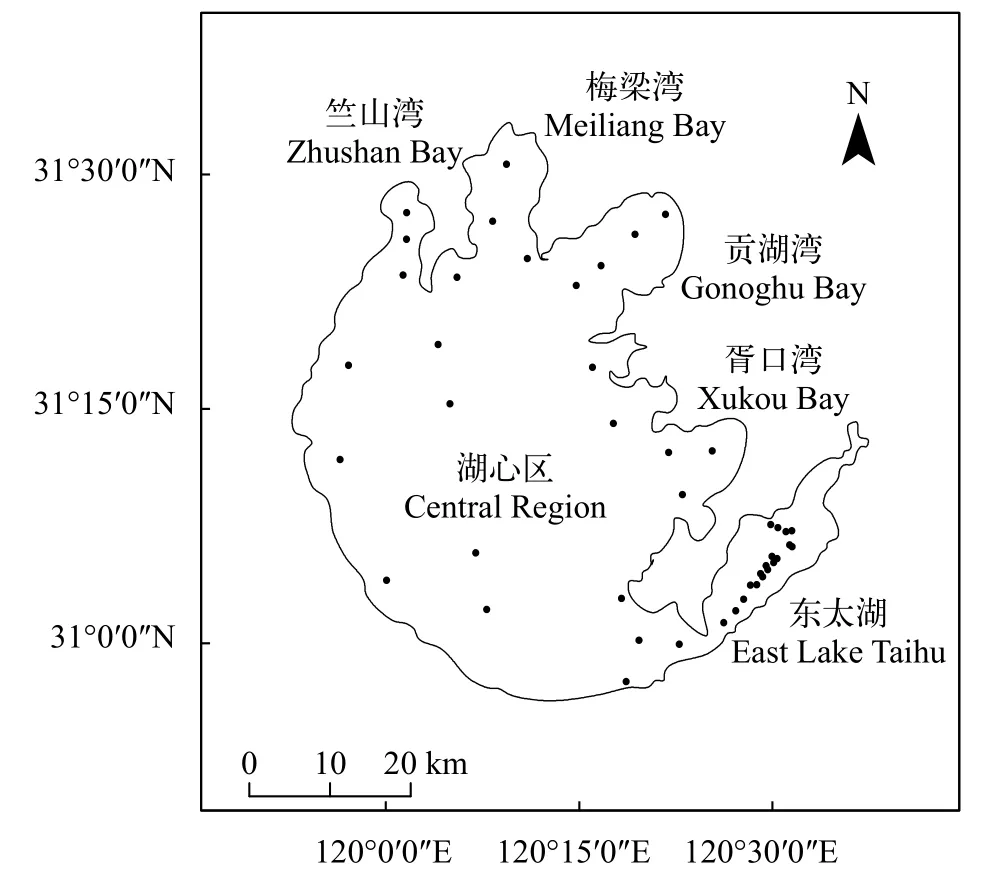
图 1 太湖采样点分布图Fig. 1 Location of the sampling sites in Taihu Lake
透明度(ZSD)采用直径为25 cm的塞氏盘测量。水样在表层(水面以下0.5 m)、中层(水下1.0 m)和底层(沉积物以上约10 cm处)分别采集后混合, 然后带回实验室进行分析测定。总磷(TP)使用钼锑抗分光光度法测定(普析, TU-1810, 北京)。浮游藻类叶绿素a(Chl.a)使用丙酮溶液萃取20—24h后, 在分光光度计(普析, TU-1810, 北京)中读取665和750 nm处的吸光度值后计算而来[9]。
为进一步分析不同组分浊度对总浊度(TurbTot)的贡献, 本文依据Portielje等[10]、Ibelings等[11]的研究, 将TurbTot划分为藻类浊度(TurbAlg)、非藻类浊(TurbNonAlg)和背景浊度(TurbBck)。TurbTot为ZSD的倒数; TurbAlg参照Portielje等[10]的公式, 采用长江中下游浅水湖泊的数据推算而来[4], 为0.011×Chl.a;TurbBck是数据集中最小的浊度值(ZSD最大时) 0.18/m(假定此时悬浮颗粒物不存在); 则TurbNonAlg计算公式为: TurbNonAlg=1/ZSD−0.011×Chl.a−0.18。
数据分析在R 3.4.0和Excel 2016中进行。TurbTot的时空分布图在ArcGIS 10.2中采用反距离加权插值法(IDW)制作。有草区和无草区浊度的差异性检验使用Mann-Whitney U检验。
2 结果
2.1 太湖浊度的时空分布
从TurbTot的时间分布来看, 夏季最高, 平均浊度达到3.64/m, 其次是春季(3.33/m)和秋季(2.61/m),冬季最低(1.96/m, 图 2)。就空间分布而言, 湖心区TurbTot较高(2.15—3.82/m)。除冬季外, 竺山湾(1.13—3.63/m)和梅梁湾浊度(0.85—5.00/m)也较高,胥口湾(1.95—3.04/m)和东太湖(北部区域为1.05—3.09/m)浊度均较低(图 2)。
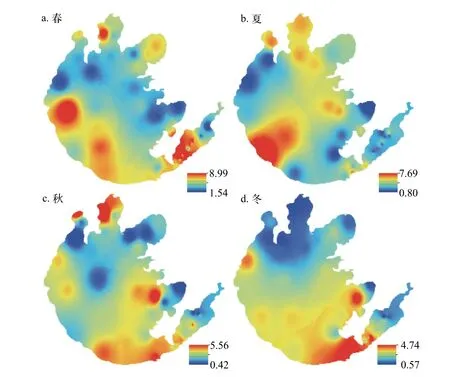
图 2 太湖水体总浊度(/m)四季空间分布情况Fig. 2 Seasonal dynamics of spatial distribution of total turbidity (TurbTot, /m) in Taihu Lake
2.2 浊度组分特征
从TurbTot来看, 有草区与无草区变化规律相似,均是夏季(有草区, 3.5/m; 无草区, 4.0/m)略高于其他季节。无草区在夏季时高于有草区, 其他季节和无草区相差不多(图 3a)。就TurbAlg而言, 有草区在夏季时最高(0.37/m), 其他季节略低; 无草区则在秋季时最高(0.71/m), 其他季节略低(图 3b); 夏季时无草区(0.27/m)略低于有草区(0.37/m), 其他季节均高于有草区或与之相差不多。TurbAlg占TurbTot百分比也呈现类似的变化规律(图 3d)。就TurbNonAlg而言, 有草区与无草区变化规律相似, 均是夏季(有草区,2.91/m; 无草区, 3.52/m)略高于其他季节(图 3c)。夏季时无草区高于有草区, 其他季节均低于有草区。TurbNonAlg占TurbTot百分比也呈现类似的变化规律(图 3e)。太湖中有草区和无草区全年均以TurbNonAlg为主, 均占TurbTot的69%以上。
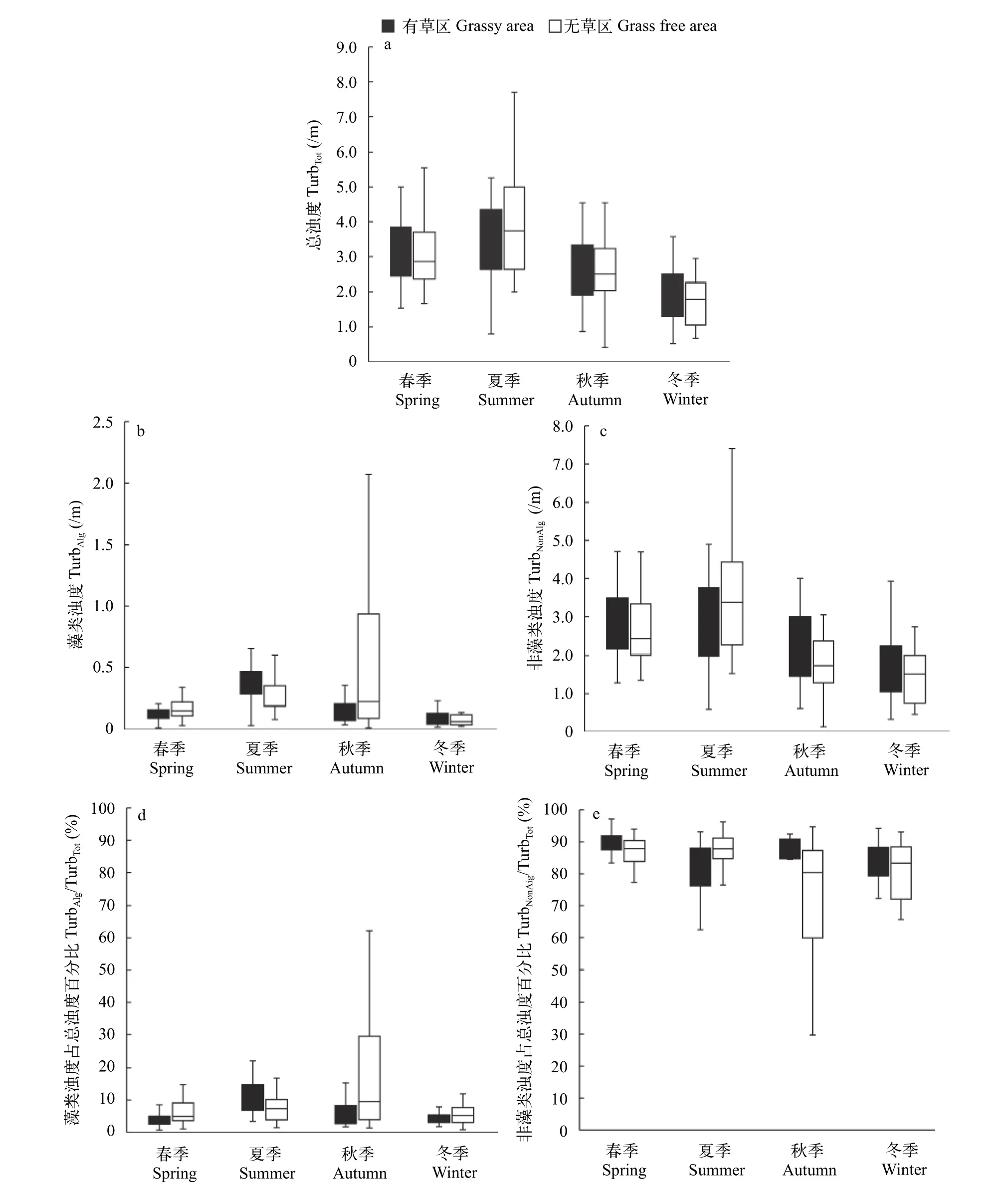
图 3 有草区和无草区总浊度(/m)、藻类浊度(/m)、非藻类浊度(/m)及其占总浊度的百分比(%)Fig. 3 Comparisons of the total turbidity (TurbTot, /m), algal turbidity (TurbAlg, /m), non-algal turbidity (TurbNonAlg, /m) and their contribution to total turbidity in percentage (TurbAlg%, TurbNonAlg%) between areas with (solid squares) and without (open squares)submersed macrophytes for the four seasons
2.3 不同浊度组分与湖水总磷的关系
总体而言, 不同季节有草区和无草区的TurbTot均随TP的上升而增加(图 4)。但是, 这些关系仅在春季、夏季和冬季的有草区达到显著水平(图4a、4b和4d), 其余的均不显著。
就TurbAlg而言, 除冬季的无草区外, 其他季节或湖区, 其均随TP的上升而增加(图 5)。从TurbAlg占TurbTot百分比来看, 有草区的在春、秋和冬季时随TP的上升而增加, 夏季时在整个TP范围内无明显变化; 无草区的在春和秋季时均随TP的上升而增加, 夏和冬季时在整个TP范围内无明显变化(图 6)。
就TurbNonAlg而言, 有草区的在春、夏和冬季时随TP的上升而增加, 秋季时在整个TP范围内无明显变化。无草区的TurbNonAlg在秋季时随TP的上升而减少, 其他季度变化不明显(图 5)。从TurbNonAlg占TurbTot百分比来看, 秋季时有草区和无草区的均随TP的上升而快速下降, 其他季节变化不明显(图 6)。
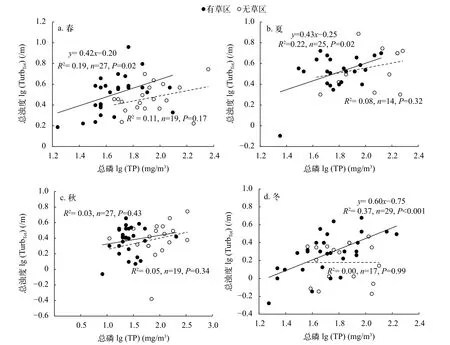
图 4 有草区和无草区的总浊度(/m)与湖水总磷(mg/m3)的关系Fig. 4 Comparisons of the relationships of total phosphorus (TP, mg/m3) with total turbidity (TurbTot, /m) between areas with (solid circles)and without (open circles) submersed macrophytes for the four seasons
3 讨论
本研究结果显示, 太湖中水体浊度的主要组分是TurbNonAlg, 其平均值和平均占比分别达到了2.45/m和83%, 均明显高于长江中下游同等营养水平的中小型湖泊(0.90/m, 71%)[4]。太湖中TurbNonAlg占比在春季时尤其高, 达到了TurbTot的89%。同样的规律在巢湖和洞庭湖中也有所发现。巢湖(2046 km2)和洞庭湖(2625 km2)也是我国的大型浅水湖泊, 湖泊均呈近“U”形, 沉水植物也零星分布在湖泊沿岸带, 如2010年巢湖沉水植物盖度约为1.54%[12]。在相同的总磷范围内, 巢湖的总浊度和非藻类浊度分别为2.36/m和1.87/m[13], 洞庭湖的总浊度和非藻类浊度分别为2.32/m和2.11/m[14], 均高于中小型湖泊。以往研究表明, 驱动湖泊生态系统稳态转换的关键因子是TP, 而本研究中无草区的TurbTot随TP变化不明显; 除秋季外, TurbNonAlg随TP变化也不明显。这表明太湖水体浊度除受TP影响外, 受其他因素的影响也较大。TurbNonAlg是指水中除浮游藻类以外的其他颗粒物(多数为沉积物再悬浮形成的颗粒物)贡献的浊度[10], 其可受风力扰动、生物扰动、水体流速及沉积物自身特征等可能影响沉积物再悬浮的各种因子的影响[1,15,16]。在大型湖泊中,风的吹程更长, 水体对沉积物的剪切力更大, 对沉积物的扰动也更强[1,17—19]。因此, 相比中小型湖泊,在大型浅水湖泊中, 生物群落及沉积物自身特征相似的情况下, 风力扰动可能导致其TurbNonAlg更高。Scheffer[1]的模型也显示在相同的风速下, 大型浅水湖泊更易受到沉积物再悬浮的影响。此外, 太湖的沉水植物大都分布于近岸带和湖湾区, 覆盖度仅占全湖面积的26.18%[20], 无法对湖心区受风力作用引起的沉积物再悬浮起到抑制作用。
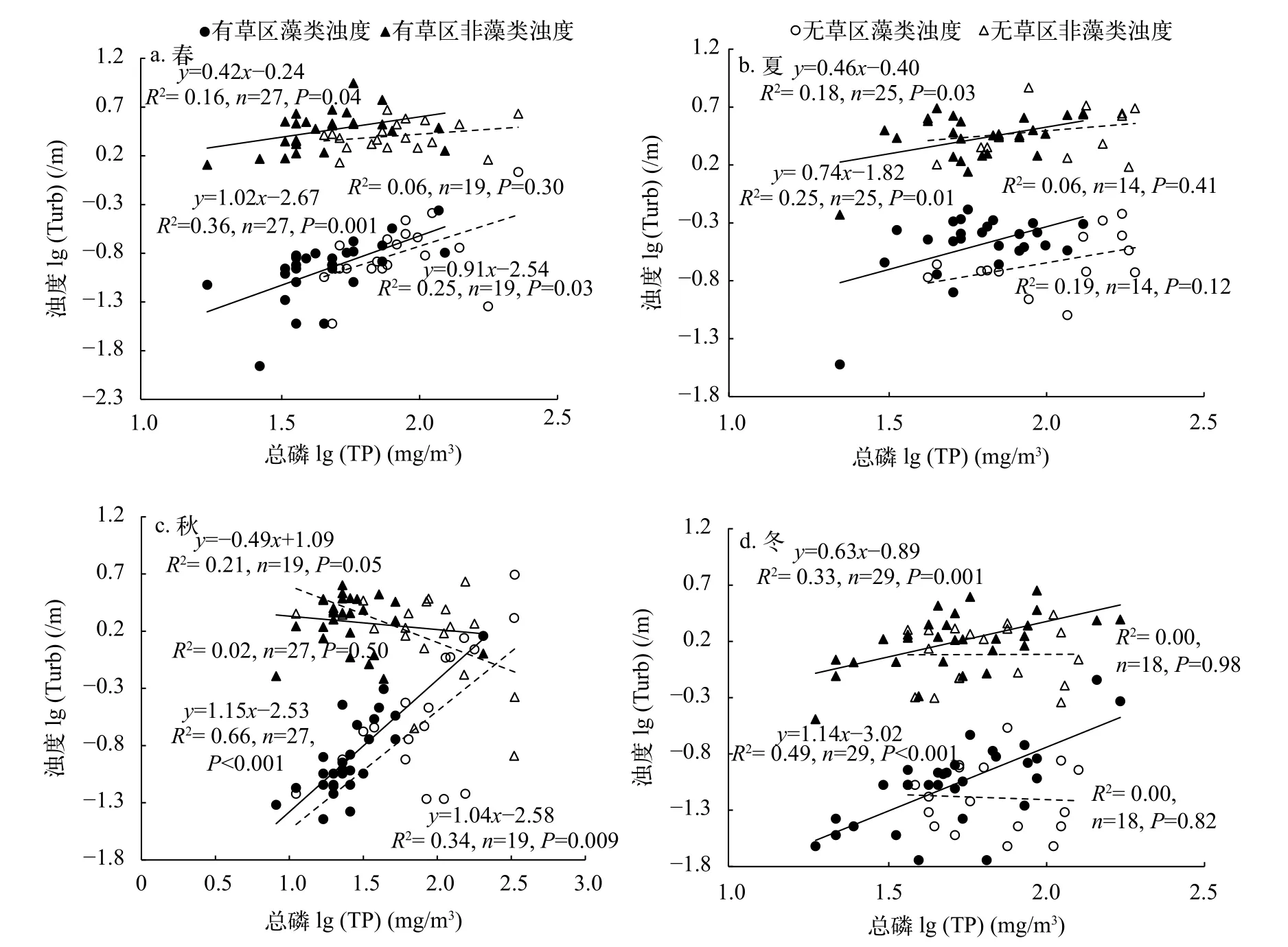
图 5 有草区和无草区藻类浊度(/m)、非藻类浊度(/m)与湖水总磷(mg/m3)的关系Fig. 5 Comparisons of the relationships of total phosphorus (TP, mg/m3) with algal turbidity (TurbAlg, /m) and non-algal turbidity(TurbNonAlg, /m) between areas with (solid circles) and without (open circles) submersed macrophytes for the four seasons
本研究结果还显示, 与中小型湖泊相比, 大型湖泊中沉水植物对浊度的抑制效果相对较弱。以往研究表明, 沉水植物对水体浊度有抑制作用, 一方面, 其可通过稳定底质、抑制沉积物再悬浮等方式直接控制TurbNonAlg[21,22]; 另一方面, 沉水植物能通过竞争光照和分泌他感物质等方式抑制浮游藻类生长[23—25], 从而控制TurbAlg。因此, 一般而言有草湖泊的TurbNonAlg及TurbAlg要低于无草湖泊的。如王海军等[4]的研究表明, 就长江中下游浅水湖泊而言, 有草湖泊的TurbNonAlg和TurbAlg分别为无草湖泊的46%和11%。然而, 在本研究中, 太湖有草区和无草区的TurbNonAlg及TurbAlg均相差不大。关于太湖TurbNonAlg的情况已在前一段介绍。就TurbAlg而言, 在相同TP范围内, 有草区和无草区相差不大(P>0.053年平均值分别为0.21/m和0.32/m), 在夏季时前者甚至略高于后者(图 5)。此外, 与亚热带区域长江中下游及温带(英国诺福克)等地40余个中小型有草湖泊相比(0.01—0.50/m)[4,26], 在相同TP范围内, 太湖有草区TurbAlg(0.21/m)高于其中大多数湖泊的(89%)。以上分析表明, 太湖中分布在近岸带或湖湾区的沉水植物未能对TurbAlg产生有效的抑制作用, 尤其是夏季时。这可能是由2个方面的原因导致, 一是太湖中沉水植物生物量较低, 二是沉水植物分布区对浮游藻类的“捕获”作用。根据Korner[27]的研究, 沉水植物生物量到达1000—10000 g/m2时才能对藻类表现出较强的化感抑制作用。当水温升高时, 沉水植物的抑藻效应会急速下降, 如当水温上升至20—30℃时, 沉水植物生物量大于8000 g/m2时才具有较明显地抑藻效应[28]。在本研究中沉水植物最多的胥口湾中, 其生物量仅为698—2809 g/m2。此外, 湖湾区域的特殊形态导致表层水体流动性相对较差, 当敞水区湖面水华受风力影响进入湖湾后, 便难以离开[29—32], 从而导致这些区域在夏季时TurbAlg更高。太湖夏季时有沉水植物分布的东太湖常有水华堆积, 一般出现在植被生长茂密, 植株接近或伸出水面的区域[33—34]。
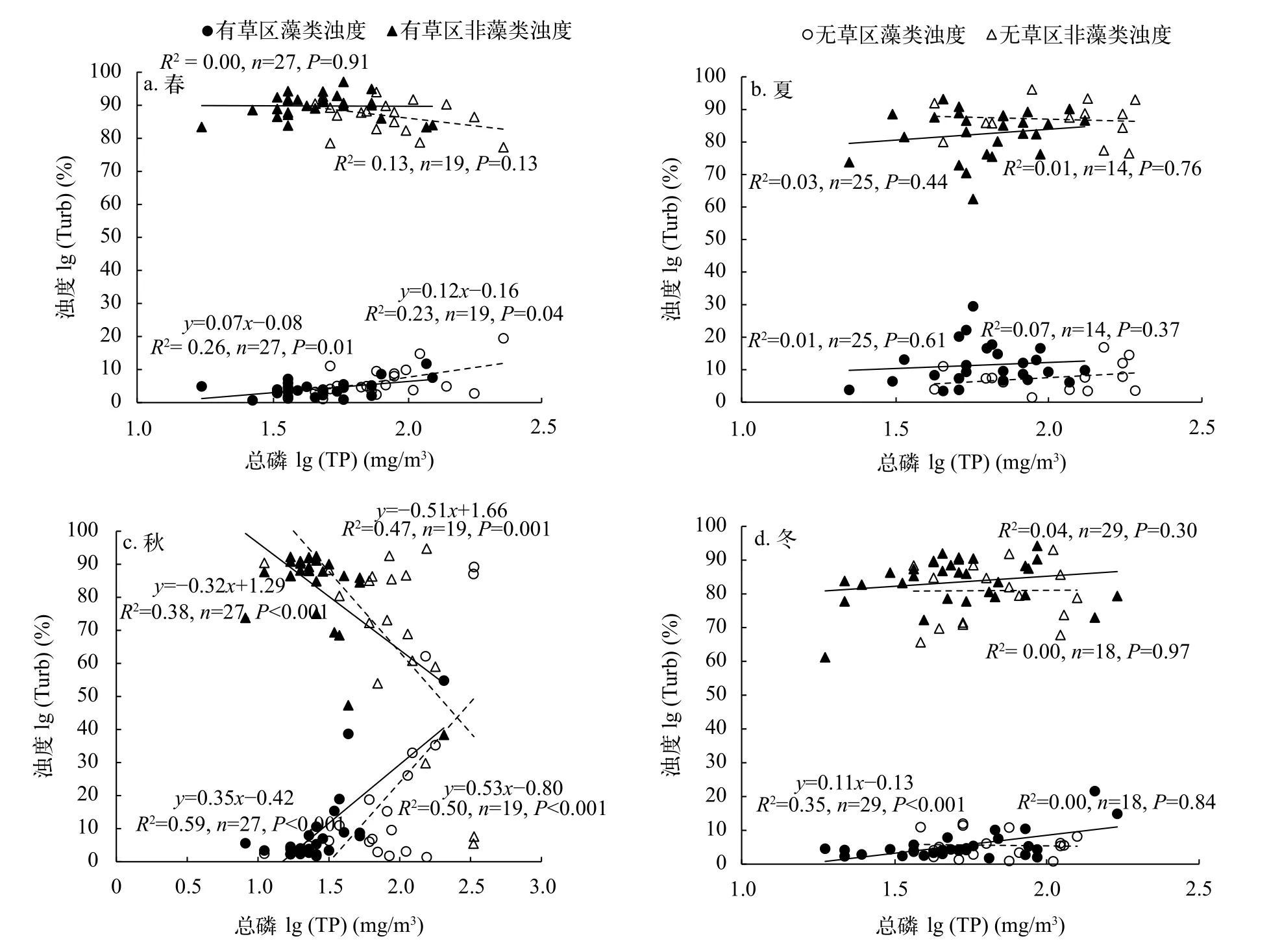
图 6 有草区和无草区藻类浊度(/m)、非藻类浊度(/m)占总浊度百分比与湖水总磷(mg/m3)的关系Fig. 6 Comparisons of the relationships of total phosphorus (TP, mg/m3) with the percentage of algal turbidity (TurbAlg, /m) and non-algal turbidity (TurbNonAlg, /m) in total turbidity between areas with (solid circles) and without (open circles) submersed macrophytes for the four seasons
