ACS患者斑块特征与冠状动脉慢血流现象的相关性
2021-06-02
(北京市垂杨柳医院心内科,北京市 100022)
冠状动脉慢血流现象(coronary slow flow phenomenon,CSFP)是指在排除冠状动脉痉挛或扩张、心脏瓣膜病、心肌病及结缔组织病等因素外,冠状动脉造影中未发现冠状动脉存在明显狭窄,但在远端发生血流灌注延迟的现象[1-2]。临床研究发现,CSFP存在于1%~7%诊断性冠状动脉造影患者中,在急性冠状动脉综合征(acute coronary syndrome,ACS)患者中CSFP更易多见,且超过80% CSFP患者会出现胸痛症状的反复发作,约20%患者会因此再次入院[3-4]。此外,CSFP与冠心病患者恶性心律失常和心源性猝死的发生显著相关[5]。近年来,CSFP越来越受到临床重视,但CSFP的发生机制仍然不清楚,且缺乏有效的预测因子[6-7]。
血管内超声(intravascularultrasound,IVUS)由于其良好的组织穿透性,可实现整个血管结构的可视化和血管结构重塑后的进一步分析。IVUS不仅清晰地显示冠状动脉病变狭窄的严重程度,还可通过其虚拟组织学功能(iMAP-IVUS)对斑块进行定量、定性分析,在一定程度上弥补了冠状动脉造影(coronaryangiography,CAG)的不足[8]。既往临床研究已证实,IVUS识别下的斑块形态及iMAP-IVUS识别的斑块成分与心血管事件的发生及预后显著相关,因此可能参与CSFP的发生[9]。本研究通过IVUS分析ACS患者非罪犯血管的管腔特点及斑块形态,评估其与CSFP发生的相关性,为揭示CSFP发生发展的可能机制提供临床依据。
1 资料和方法
1.1 对象和分组
选择本院2018年8月—2020年6月确诊为ACS并行CAG的患者,其中符合CSFP诊断者纳入CSFP组,冠状动脉血流速度正常ACS患者纳入对照组。CSFP组患者65例,其中男47例(72.3%),平均年龄(61.09±7.02)岁。同期对照组患者70例,其中男49例(70.0%),平均年龄(60.51±6.77)岁。两组年龄、性别比例基本匹配。收集两组患者的临床资料、CAG数据及IVUS相关数据,分析其与CSFP的相关性。
1.2 病例选择标准
纳入标准:①所有患者均存在ACS症状,且行冠状动脉造影显示非罪犯血管无明显器质性冠状动脉狭窄(<70%),未对非罪犯血管进行介入干预;②心肌梗死溶栓试验(thrombolysis in myocardial infarction,TIMI)血流2级以下的患者(≥3个心动周期充盈远端血管),或测量冠状动脉血流速度TIMI帧数(CTFC)>27帧(30帧/s)的患者;③患者行3支血管的血管内超声检查,并分析虚拟组织学图像,数据保存完整;④患者及家属对本研究知情并签署临床研究伦理知情同意书。
排除标准:①先天性心脏畸形及除窦性心动过速以外的心律失常;②血液系统疾病、肿瘤、自身免疫系统疾病及急慢性感染者;③冠状动脉痉挛或扩张、心脏瓣膜病、心肌病等;④血管内超声图像缺失或不可用于进一步分析。
1.3 血管造影成像分析
常规多体位投照,使用冠状动脉造影定量分析(quantitative coronary angiography,QCA)系统分析冠状动脉血管的造影情况[10]。造影剂填充导管的外径作为校准标准,从投影中测量最小管腔和定位病变部位。以斑块最狭窄部位的近远端10 mm区域,管腔面积最大、无重要血管分支的位置作为参考血管节段。参考直径定义为狭窄部位近远端10 mm处管腔直径的平均值,最小直径定义为斑块病变最严重处的管腔直径。TIMI首帧及尾帧定义:造影剂接近完全充盈冠状动脉起始部并触及血管壁定义为第一帧。造影剂到达远端分支并显影特定的解剖标志时定义为最后一帧。左前降支末帧标志为心尖“八字”样远段分叉处,左回旋支为钝缘支的最远分叉处,右冠状动脉为左心室后支的第一个分支。
1.4 血管内超声图像分析
血管内超声检查采用美国波士顿科学公司的iLab超声诊断仪与及Atlantis SR Pro冠状动脉超声成像导管,频率40 MHz,以0.50 mm/s速度自动回撤导管,同时采集影像数据。IVUS图像通过QlvusiMap Basic Viewer软件对外弹力膜横截面积(EEM-CSA)、管腔横截面积(CSA)、斑块面积、斑块负荷及重构指数进行测量,数据采集选择斑块狭窄最严重处。并根据冠状动脉血管内超声斑块的虚拟组织学分型标准,采用iMAP-IVUS将冠状动脉斑块分为4类,薄纤维帽粥样斑块(TCFA)为融合的坏死核心>10%斑块面积,且贴近管腔;厚纤维帽粥样斑块(ThCFA)为融合的坏死核心>10%斑块面积,但未贴近管腔;钙化斑块为钙化成分>10%斑块面积;病理性内膜增厚(PIT)为不符合粥样斑块或钙化斑块定义的,均归类为病理性内膜增厚。
1.5 统计学方法
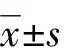
2 结 果
2.1 两组患者一般资料的比较
CSFP组脂蛋白a水平高于对照组(P<0.05;表1)。两组患者在年龄、性别、冠状动脉高危因素(吸烟、高血压、糖尿病)、实验室检查(甘油三酯、总胆固醇、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇)、ACS发病类型及既往药物治疗等方面的差异,均无统计学意义(P>0.05;表1)。
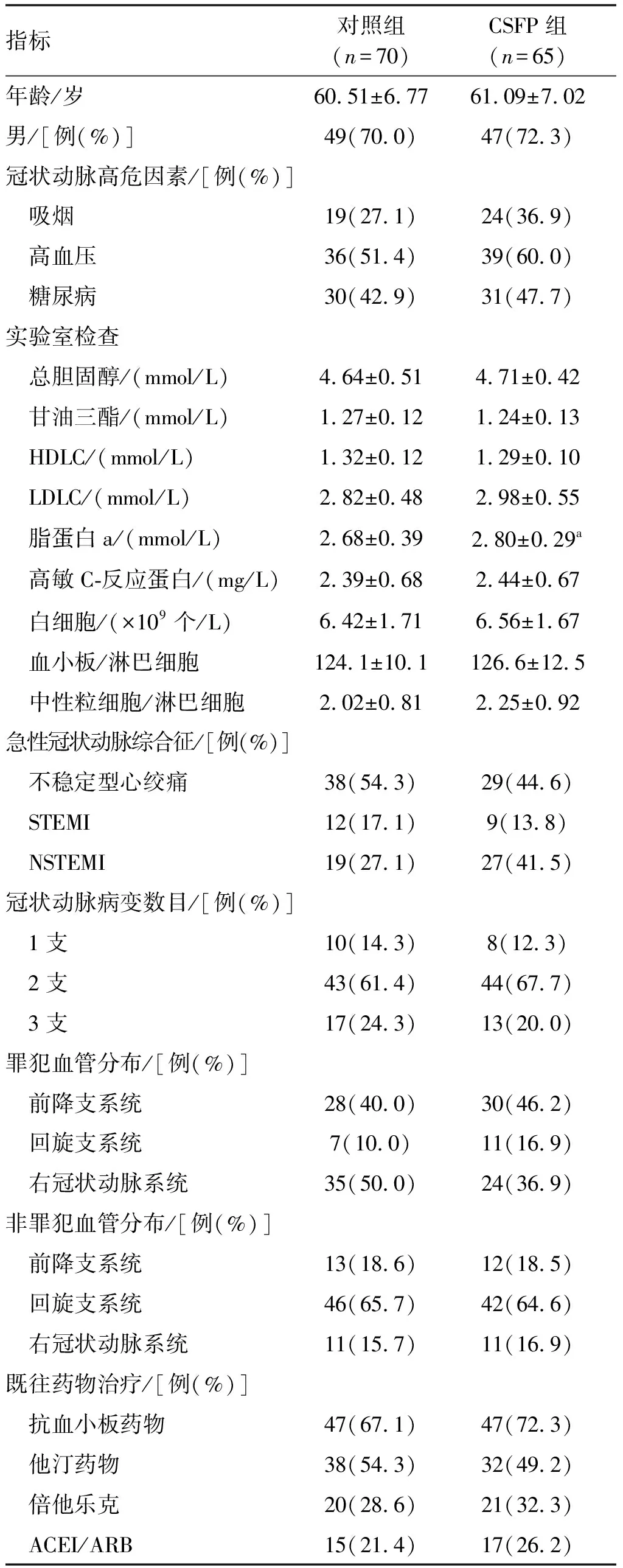
表1 两组患者一般资料的比较
2.2 两组冠状动脉影像学特征的比较
CSFP组中非罪犯血管检测到TCFA患者数量明显多于对照组(P<0.05;表2)。两组间其他冠状动脉影像数据差异均无显著性(P>0.05;表2)。
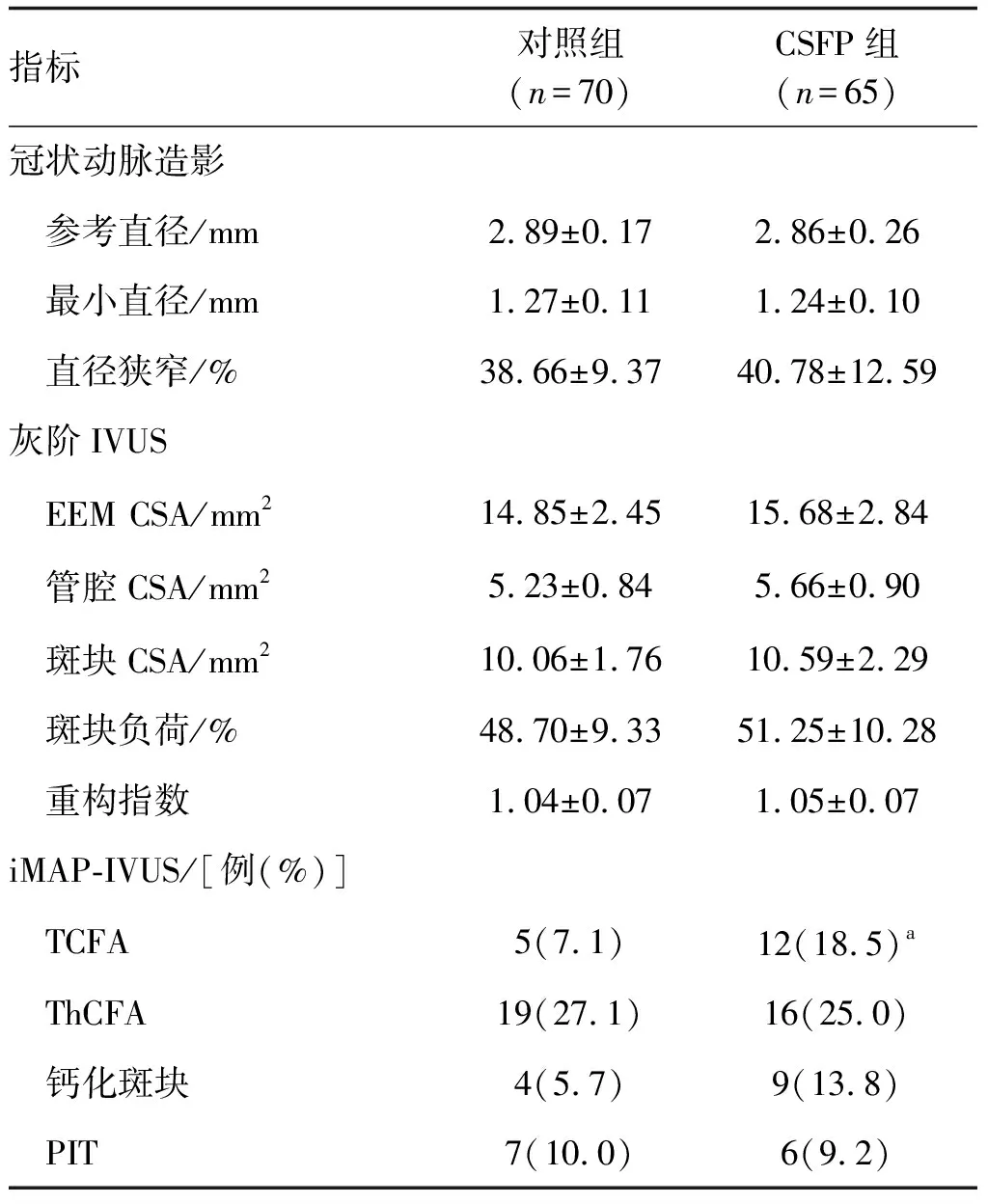
表2 两组冠状动脉影像学特征的比较
2.3 单因素及多因素Logistic回归分析
以是否发生CSFP为因变量(有=1,无=0),以年龄、性别、冠状动脉高危因素、实验室检查、ACS发病类型、用药史、冠状动脉造影数据、灰阶IVUS数据及iMAP-IVUS数据等共29个为自变量,赋值后分别进行单因素Logistic回归显示,脂蛋白a为CSFP的危险因素(P<0.05)。LDLC、造影最小管腔直径及灰阶IVUS的EEM-CSA及iMAP-IVUS识别的TCFA可能为CSFP的潜在危险因素(P<0.1)。
将可能影响CSFP发生的自变量因素(年龄、性别及吸烟)联合脂蛋白a、TCFA、LDLC、造影最小直径、EEM-CSA及TCFA纳入多因素Logistic回归模型中分析显示,脂蛋白a(OR=3.546,P<0.05;表3)及TCFA(OR=3.827,P<0.05;表3)是CSFP发生的独立危险因素。根据以上确定的独立危险因素绘制ROC曲线,曲线下面积为0.809(95%CI 0.794~0.916),以上结果表明该模型具有较高的准确度。
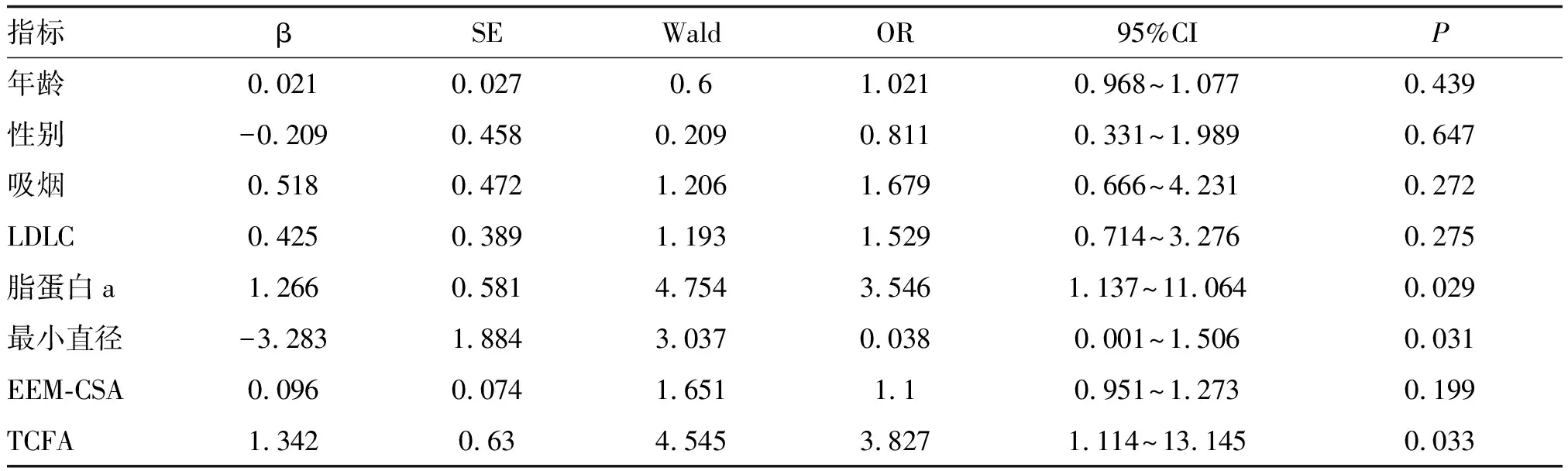
表3 CSFP危险因素的Logistic回归分析
3 讨 论
既往国内外研究证实,在所有经皮冠状动脉介入治疗中,约5%的患者在术中发生CSFP,这一现象更容易发生在ACS患者中[11-12]。尽管这一比例意见不一,但CSFP的发生与患者的不良预后显著相关,CSFP虽然被认识已经几十年,但是关于CSFP的病理生理机制仍然不清。既往研究表明,早期冠状动脉粥样硬化、微血管功能失调及障碍、血管内皮细胞功能障碍、炎性反应、基因变异、体内代谢紊乱等因素参与了CSF的发生[13-15]。
ACS的发生发展与斑块的破裂、斑块侵蚀及血栓形成密切相关[16]。IVUS等冠状动脉影像学的发展为分析冠状动脉斑块性质、研究冠状动脉病变发生发展机制提供了新的检测手段。既往研究表明,IVUS提示下的冠状动脉斑块特征与ACS的发生发展密切相关,TCFA、斑块负荷≥70%及最小管腔面积≤4 mm2等特征是非罪犯血管发生主要心血管不良事件(major adverse cardiovascular events,MACE)的独立预测因子[17]。因此本研究拟探讨IVUS识别下的斑块特征与CSFP发生发展的相关性,为探究CSFP发生的病理生理机制提供临床依据。
通过对CSFP患者行IVUS检查发现,大多数患者冠状动脉内膜中层弥漫性增厚,表明早期动脉粥样硬化在CSFP中具有一定作用[18]。本研究通过比较CSFP及冠状动脉血流速度正常的两组患者,采用多因素Logistic回归探究影响CSFP的独立危险因素,发现非罪犯血管TCFA与CSFP的发生密切相关,可作为其独立的预测因素。同时也为CSFP的临床诊断及预防提供了新的干预途径。
此外,本研究通过多因素Logistic回归发现,脂蛋白a水平也是CSFP发生的独立危险因素,更高的脂蛋白a水平往往预示着ACS患者更易发生CSFP。研究表明,更低的LDLC与CSFP的发生密切相关,然而本研究通过比较CSFP与血流速度正常组发现,LDLC在两组间无差异,与CSFP的发生发展无关[19-20]。
虽然本研究通过Logistic回归分析得出TCFA及脂蛋白a水平为CSFP的独立危险因素,但是并不能排除其他因素对CSFP发生发展的影响。尽管本研究在CSFP组与对照组选择时关注了性别和年龄比例,且通过相关性分析证实两组间数据的差异水平,但两组间的其他临床数据混杂较难控制。患者既往吸烟、降脂药物的使用种类及持续时间等混杂因素可能影响CSFP的独立危险因素的评估,因此需要更大样本量的前瞻性临床研究探讨冠状动脉斑块与CSFP的相关性。
综上所述,ACS患者脂蛋白a水平与冠状动脉非罪犯血管的TCFA是CSFP的独立危险因素。通过强化降酯等手段对冠状动脉TCFA的早期干预及降低脂蛋白a水平可能会降低CSFP的发生,为临床早期预警和识别CSFP提供新的思路与临床证据。
