儿童哮喘患者外周血Th17,Th2细胞及不同来源样本相关细胞因子表达与气道炎症诱导痰细胞学分类的相关性研究
2021-06-02许春华安美玉罗新辉
陈 芬,许春华,姚 彤,安美玉,罗新辉
(新疆维吾尔自治区儿童医院儿内科,乌鲁木齐 830001)
哮喘是一种以慢性气道炎症和气道高反应性为特征的异质性疾病,由多种细胞因子共同参与引起,是儿童最常见的慢性呼吸道疾病[1]。目前,根据哮喘气道炎症不同亚型将哮喘主要分为嗜酸性粒细胞哮喘(eosinophilic asthma,EA)和非嗜酸性粒细胞哮喘(non-eosinophilic asthma,NEA),其中NEA 半数以上为中性粒细胞性哮喘(neutrophilic asthma,NA)[2]。迄今,NA 患者气道中性粒细胞(neutrophils,NEU)增多机制尚未明确,但研究发现其存在不依赖于Th1/Th2 免疫介导的气道中性粒细胞性炎症[3]。并发现,Th17 细胞及其效应因子IL-17 在哮喘发病的免疫机制中具有重要作用,Th17/IL-17 可介导NEU 的募集、活化及气道重塑,可能是气道NEU 增多的机制之一[4-5]。亦证实,哮喘患者血清IL-17 表达升高与哮喘严重程度紧密相关[6]。因此,本研究拟通过初步探究不同类型哮喘儿童外周血Th2,Th17 细胞及不同样本来源相关细胞因子与气道炎症诱导痰细胞学分类的相关性,以期为临床提供理论依据。
1 材料与方法
1.1 研究对象 选取2018年4月至2020年8月我院儿童呼吸科接诊的急性发作期哮喘患儿55 例作为研究对象,男性30 例,女性25 例,年龄2~14岁,哮喘诊断及严重程度分级符合儿童支气管哮喘诊断与防治指南(2016 版)[7],经支气管镜检查排除气管支气管狭窄、支气管异物等气道异常引起的喘息;均未接受糖皮质激素治疗,近1月内无呼吸道感染,排除支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)病原学检查阳性。入院后均行体格检查、病史询问、肺功能、胸X 线片检查,外周白细胞计数分类及痰液培养等。根据诱导痰细胞学分类将入组哮喘患儿分为NA组24例,男性13例,女性11 例,平均年龄5.1±1.6 岁,轻-中度哮喘16 例、重度哮喘8 例;EA 组31 例,男性17 例,女性14 例,平均年龄4.8±1.9 岁,轻-中度哮喘22 例、重度哮喘9 例,两组患儿年龄、性别、病情程度差异均无统计学意义(P>0.05)。另选取同期50 例健康体检儿童作为健康对照组(HC 组),男性27例,女性23例,年龄3~14岁,平均年龄5.2±1.4岁,无变态反应性疾病,无过敏性鼻炎及哮喘病史,无激素类药物使用史,肺功能正常,近1月内无呼吸道感染。本研究获得我院医学伦理委员会通过,患儿家属均知情并签署同意书。
1.2 仪器与试剂 二硫苏糖醇(DTT)购自美国Sigma 公司。Diff-Quick 染色购自英国Baxter Healthcare 公司。APC 标记抗人CD4 抗体;Per CPCy™ 5.5 标记抗人CD8 抗体;PE 标记的抗人IL-17,IL-10 抗体及Mouse Ig G1 κ 同型对照;Alexa Fluor 488 标记的抗人BCL-2,STAT5 及Mouse Ig G1 κ 同型对照均购自美国BD 公司。qRT-PCR 检测试剂盒购自上海吉玛制药技术有限公司。流式细胞仪购自赛默飞世尔科技(中国)有限公司;ELISA 试剂盒(型号MEXN-H3052)购自上海美轩生物科技有限公司。
1.3 方法
1.3.1 诱导痰细胞分类及计数:参照2016 版儿童支气管哮喘诊断与防治指南[7]进行哮喘严重程度分级,并参照诱导痰液指导指南[8]对不同程度哮喘患儿及对照组儿童分别进行痰液诱导,咳出痰液处理备用。取处理后痰液标本500 mg,1 500 r/min,4 ℃离心,取上清低温保存用于待测细胞因子。细胞沉淀加入DTT 处理,离心弃上清,重悬加入0.1g/dl台盼蓝,调整细胞浓度为0.3×106/ml,加120 μl痰细胞悬液甩片5 min,固定,Diff-Quick 染色,光学显微镜下行痰液细胞计数,分类计算NEU 和嗜酸性粒细胞(eosinophil,EOS)百分比。分组根据诱导痰细胞学分类:NA 组:NEU ≥61%且EOS<2%;EA 组:NEU <61%且EOS ≥2%。
1.3.2 流式细胞仪检测外周血Th17,Th2 细胞:采集各组儿童外周静脉血肝素抗凝,收集培养细胞加入红细胞裂解液,离心、弃上清、重悬,分别加入APC 标记抗人CD4 抗体和Per CP-Cy™ 5.5 标记抗人CD8 抗体,孵育、洗涤、弃上清;取胞外染色细胞,加入固定破膜液,离心、重悬,于Th17,Th2 细胞检测管分别加入PE 标记的抗人IL-17 抗体和抗人IL-10 抗体20 μl,同型对照管加入PE 标记Mouse Ig G1 κ 同型对照,孵育、洗涤、弃上清,多聚甲醛重悬,24 h 内上机检测Th17,Th2 细胞占Th 细胞的百分比。
1.3.3 流式细胞仪检测Th17 细胞STAT5,BCL-2 表达:操作步骤同Th17,Th2 细胞检测,BCL-2 检测管加入Alexa Fluor 488 标记的抗人BCL-2 和PE 标记的抗人IL-17 抗体,同型对照管加入Alexa Fluor 488 标记的Mouse Ig G1 κ 同型对照和PE 标记的Mouse Ig G1 κ同型对照20 μl,其余操作步骤同2.2。STAT5 检测取胞外染色细胞,加入37 ℃的固定液,孵育、洗涤,加入-20 ℃破膜试剂,孵育、弃上清、重悬,检测管加入Alexa Fluor 488 标记抗人STAT5和PE 标记抗人IL-17 抗体20 μl,同型对照管加入同BCL-2 检测,其余步骤操作同前;24 h 内上机检测Th17 细胞STAT5,BCL-2 表达阳性率。
1.3.4 qRT-PCR 检测外周血单核细胞RORγt 表达:采集各组儿童外周静脉血,利用梯度离心法分离单核细胞PBMC,取分离培养PBMC 悬液提取RNA,测定其纯度,逆转录合成cDNA 并以此为模板行RT-PCR 反应,以β-actin 为内参。RORγt引物序列,上游5’-CGTGCGCTGCTGGCGTGACG-3’,下游5’-TGTCTCTCGCGTCACCGTTGCG-3’;β-actin 引物序列,上游5’-CAGCATACTAGCTTCA GATGC-3’,下游5’-CAATGTCGTCGTTCGTCA TG-3’;反应条件:95 ℃ 10 min,95 ℃ 15 s,60 ℃ 60 s,40个循环。采用 2-△△Ct法分析RORγt 相对表达量。
1.3.5 PBMC 培养液及BALF 中IL-17,IL-10 水平检测:使用37 ℃,100 ml 生理盐水于病变部位行纤维镜下支气管肺泡灌洗,抽取各组儿童BALF。取PBMC 培养液及BALF 根据ELISA 试剂盒说明书分别检测IL-17 和IL-10 浓度,并设置空白对照组、标准孔、待测样品孔,每孔加入亲和素标记的HRP,孵育1 h,洗涤、显色,终止反应,测定每孔450 nm 波长处的吸光度值,绘制标准曲线回归方程,计算相应样品中IL-17 和IL-10 浓度。
1.4 统计学分析 采用统计软件SPSS 19.0 进行数据分析,计量数据采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD 检验;计数资料采用n表示,组间比较采用χ2检验;相关性分析采用Pearson 分析,P<0.05为差异有统计学意义。
2 结果
2.1 诱导痰细胞分类计数比较 见表1。NA 组NEU%高于EA 组和HC 组,EA 组高于HC 组,差异有统计学意义(P<0.05);EA 组EOS%高于NA 组和HC 组,NA 组高于HC 组,差异有统计学意义(P<0.05)。

图1 流式细胞仪检测各组外周血Th17,Th2 细胞表达

表1 各组诱导痰细胞分类计数比较(x±s,%)
2.2 外周血Th17%,Th2%比较:见图1,表2。NA组Th17%高于EA组和HC组,EA组高于HC组,差异有统计学意义(均P<0.05);EA 组Th2%高于NA 组和HC 组,NA 组高于HC 组,差异有统计学意义(均P<0.05)。

表2 各组外周血Th17%,Th2%比较(x±s)
根据前向角、侧向角圈出淋巴细胞后以CD4,CD8 设门,CD4+CD8-IL-17+细胞群为Th17 细胞亚群,CD4+CD8-IL-4+细胞群为Th2 细胞亚群。
2.3 PBMC 培养液及BALF 中IL-17,IL-10 水平比较 见表3。NA 组PBMC 培养液及BALF 中IL-17 水平高于EA 组和HC 组,EA 组高于HC 组,差异有统计学意义(P<0.05);EA 组PBMC 培养液及BALF 中IL-10 水平高于NA 组和HC 组,NA 组高于HC 组,差异有统计学意义(P<0.05)。
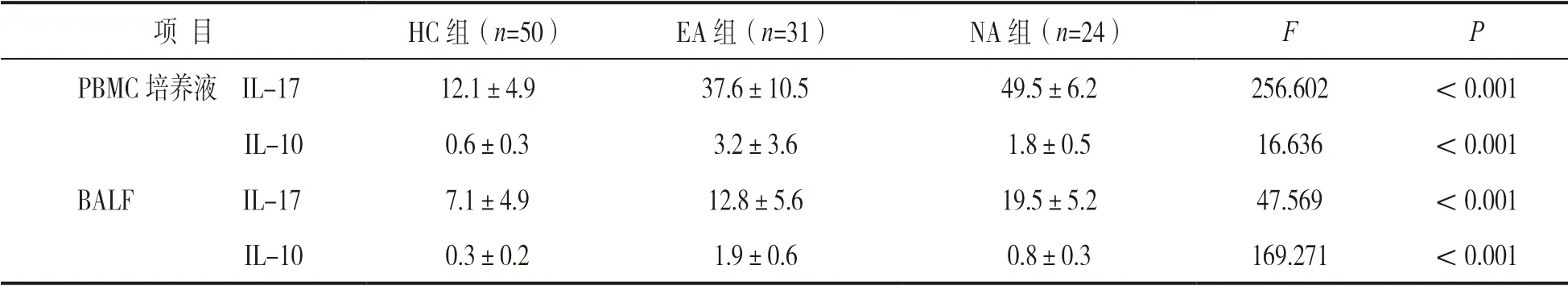
表3 PBMC 培养液和BALF 中IL-17,IL-10 水平比较(x±s,pg/ml)
2.4 相关性分析 NA 组患儿诱导痰NEU%与外周血Th17%(r=0.803,P<0.05),PBMC 培养液IL-17 水平(r=0.736,P<0.05)及BALF 中IL-17水平(r=0.695,P<0.05)均呈明显正相关。EA组患儿诱导痰EOS%与外周血Th2%(r=0.759,P<0.05),PBMC 培养液IL-10 水平(r=0.701,P<0.05) 及BALF 中IL-10 水 平(r=0.684,P<0.05)均呈明显正相关。
2.5 外周血单核细胞RORγt 表达及外周血Th17细胞中BCL-2,STAT5 阳性率比较 见表4。NA组RORγt-mRNA 表达及BCL-2,STAT5 阳性率高于EA 组和HC 组,EA 组高于HC 组,差异有统计学意义(P<0.05)。

表4 各组RORγt-mRNA 及Th17 细胞中BCL-2,STAT5 阳性率比较(x±s)
3 讨论
气道慢性炎症是哮喘气道高反应性的主要机制。既往认为,Th1/Th2 细胞免疫失衡是哮喘发病的经典免疫学机制,EOS 浸润是哮喘典型的气道炎症改变,Th2 主导的免疫应答及激素治疗敏感的哮喘气道炎症中EOS 浸润扮演重要角色[9-10]。但近年随着对哮喘发病机制及气道炎症的深入研究,发现除EOS 性炎症外,部分重症难治性及激素治疗反应差哮喘患者气道炎症EOS 浸润减少,对糖皮质激素治疗不敏感,气道组织活检、痰液及BALF中NEU 数量明显增多,提示哮喘气道炎症存在不同亚型,NEU 在哮喘气道炎症及气道重塑中具有重要作用[11,4]。并发现非应变性哮喘患者存在不依赖于Th2 细胞免疫机制介导的气道中性粒细胞炎症[3]。本研究根据SIMPSON 等[12]研究结果以痰液NEU ≥61% 界定NA,以痰液EOS ≥2% 界定EA,经行诱导痰细胞分类及计数发现,NA 组NEU%明显高于EA 组和HC 组,EA 组EOS%则明显高于NA 组和HC 组,提示不同类型哮喘患儿气道炎症表现差异显著。
目前,NA 患者气道中NEU 浸润增多的机制尚未明确,但研究发现NA 病理生理学改变,经典的Th1/Th2 失衡学说并不能完全解释[13]。Th17 能介导炎症反应,其效应因子IL-17 可以趋化、激活NEU 在气道浸润,通过与IL-17 受体结合可诱导IL-6,IL-8,TNF-α 及粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating Factor,GM-CSF)等炎症细胞因子释放,发挥募集、活化NEU 的功能,参与哮喘等变态反应性疾病[14-16]。既往多项实验证实,NA 哮喘小鼠存在明显的Th17 细胞免疫,Th17 细胞通过IL-17 介导小鼠的气道炎症[15]。同时临床研究也发现,哮喘患者外周血Th17 细胞及血浆IL-17 水平明显升高,与气道损伤程度呈正相关[17]。提示IL-17 对NEU 的募集、活化是导致NEU 气道炎症的机制之一。而本研究中NA 组和EA 组患儿外周血Th17,Th2 细胞表达均较HC 组明显增高,其中NA 组Th17 细胞升高最明显,EA 组Th2 细胞升高最明显,说明Th17,Th2 细胞均不同程度参与不同类型儿童哮喘的发病。与此相对应的与HC 组相比,NA 组和EA组PBMC 培养液及BALF 中IL-17,IL-10 水平也明显升高,NA 组IL-17 水平高于EA 组,而EA 组IL-10 水平高于NA 组。相关性分析发现,哮喘患儿诱导痰NEU%与Th17%和IL-17 水平呈明显正相关;EOS%与Th2%和 IL-10 水平呈明显正相关。结果表明Th2,Th17 细胞及相关不同来源样本IL-17,IL-10 细胞因子分别在EA,NA 患儿中的表达差异显著,介导不同类型哮喘气道炎症,可将其作为不同类型哮喘患儿诊断、治疗及预后的标志物。
Th0 细胞可分化Th17 细胞,初始Th0 向Th17 分化增强及体内已分化的Th17 细胞存活延长被认为可能是导致Th17 细胞优势的机制之一。LIN 等[18-19]发现,Th17 细胞分化受维甲酸相关孤儿受体γt(retinoid-related orphan nuclear receptor γt,RORγt)调控,IL-6 和TGF-β 通过JAK/STAT3 途径共同上调RORγt 表达,促进Th0向Th17 分化,使Th17 细胞数量及IL-17 分泌增多。IL-17 通过介导JAK/STAT5 途径,可上调B 细胞淋巴瘤因子2 生存蛋白,促进T 细胞存活、增殖[20]。既往动物实验通过NA 小鼠模型研究证实,小鼠肺组织中RORγt-mRNA 表达升高,体内已分化Th17细胞通过JAK/STAT5 途径激活维持其存活状态[21]。且临床发现,哮喘患者肺组织及外周血中RORγtmRNA 高表达,IL-17 广泛浸润于肺组织中[22]。基于此,本研究初步分析了Th17 细胞在儿童NA 中的机制,经检测发现NA 组和EA 组外周血单核细胞RORγt-mRNA 表达及外周血Th17 细胞BCL-2,STAT5 阳性表达较HC 组明显升高,NA 组高于EA 组,提示RORγt 表达增强促进Th17 细胞分化和已分化的Th17 细胞存活延长应是Th17 细胞在儿童NA 中发挥优势的机制之一,可能因JAK/STAT5信号途径被激活引起。本研究在探究不同类型哮喘患儿外周血Th17,Th2 及相关炎性因子与气道炎症的相关性的同时初步分析了Th17 参与NA 的相关机制,具有一定临床意义及可推广性。然而本研究病例数较少,Th17 介导NA 中的作用机制还有待于扩大样本量继续深入探究阐明;其次本研究对于Th2 介导EA 的机制未进行初步探究分析,故可将Th17,Th2 参与不同类型哮喘的作用机制作为后期研究的新方向。
综上,NA 与EA 患儿气道炎症分别表现为诱导痰NEU%,EOS%明显增高,并分别与不同来源样本的Th17%,IL-17 水平及Th2%,IL-10 水平呈正相关,提示可将Th2/Th17 作为不同类型哮喘患儿诊断、治疗及预后的标志物。Th17 细胞可能通过IL-17 介导中性粒细胞性炎症的发生,Th17 细胞分化增强及已分化的Th17 细胞存活延长可能是引起中性粒细胞性炎症的机制之一。
