肝细胞内相关mRNA抑制HBV复制与表达的功能验证
2021-06-02范春娇毛德文蒙荫杰何锦轶
黄 鹏,邱 华,范春娇,毛德文,李 旺,蒙荫杰,何锦轶
乙型肝炎病毒(hepatitis B virus,HBV)为嗜肝DNA病毒,全世界大约有2.57亿慢性HBV感染者。HBV持续感染不仅引起慢性乙型肝炎(chronic hepatitis B,CHB),也会显著增加肝硬化、肝衰竭及肝癌的发生风险,抗病毒是HBV相关慢性肝病治疗与防控的关键。干扰素和核苷(酸)类似物目前被认为是两类抗HBV药物,但两者均不能彻底清除共价闭合环状DNA(covalently closed circular DNA,cccDNA)。前期临床与实验研究表明,白花香莲解毒颗粒在抗HBV方面具有较好的效果,但其抗HBV机制尚未完全明确。课题组根据前期mRNA芯片筛选结果及miRNA的靶基因预测结果,选择过氧化物酶体增殖物激活受体α(peroxisome proliferator activated receptorsα,PPARα)、核因子I/B(nuclear factor I/B,NFIB)和白细胞介素-8(interleukin-8,IL-8)代表白花香莲解毒颗粒抑制HBV的靶mRNA进行抗HBV的体外验证实验。该研究采用慢病毒基因转染技术,通过HepG2.2.15和HBV1.3P-HepG2细胞模型,验证PPARα、NFIB和IL-8 mRNA表达对HBV复制与表达的影响,为进一步明确白花香莲解毒颗粒抑制HBV复制与表达的机制及探寻HBV新的治疗靶点提供实验室依据。
1 材料与方法
1.1 材料
HepG2细胞、HepG2.2.15细胞、293A细胞(上海诺百生物科技有限公司),DH5α感受态细胞(上海唯地生物技术有限公司);0.05% Trypsin、lipofectamine 2000购自美国Invitrogen公司;DMEM购自美国HyClone公司;凝胶回收试剂盒购自美国Axygen公司;NheI/AscI内切酶购自加拿大Fermentas公司;胎牛血清、Opti-MEM 、MEM培养基购自美国Gibco公司;包装质粒Packaging Mix购自美国Biomics Biotech公司;SYBR Green PCR Master Mix 购自美国Promega公司;Mouse Anti-HBsAg (H2F4)抗体、Anti-Mouse IgG H&L (PE/Cy5.5) preadsorbed购自比利时Gentaur公司;HBsAg、HBeAg化学发光法检测试剂盒购自上海东寰生物科技有限公司,批号:20181103;PCR引物合成及测序委托上海诺百生物科技有限公司完成。酶联免疫检测仪购自美国Rayto公司;BSL-Ⅱ级生物安全柜购自山东博科生物产业有限公司;台式冷冻离心机购自力康生物医疗公司;荧光定量PCR仪购自南京科信仪器仪表制造有限公司;CO培养箱购自上海润度生物科技有限公司;荧光显微镜购自意大利Sinico公司。1.2 方法
1.2.1
mRNA慢病毒表达载体的制备1.2.1.1 各基因CDS序列的扩增 在NCBI网站查询NFIB(NM_005596)、PPARα(NM_005036)和IL-8(NM_000584)序列,根据In-fusion技术设计上述基因的引物,并扩增基因的CDS序列,引物序列如表1。用HepG2基因组作为模板,用表1引物将基因CDS序列扩增,然后将扩增的序列插入慢病毒表达载体pL6.3-CMV-GFPa1-IRES-MCS中,获得mRNA慢病毒质粒表达载体。扩增体系:10×PCR Buffer for KOD 5 μl、2 mmol/L dNTP 5 μl、25 mmol/L MgSO4 3 μl、引物F(10 mmol/L)1.5 μl、引物R(10 mmol/L)1.5 μl、模板1 ng、KOD 2.5 units,加水至50 μl;PCR扩增条件为:94 ℃、2 min,94 ℃、15 s,60 ℃、30 s,68 ℃、1 kb/min,30个循环,68 ℃、10 min。

表1 基因CDS序列扩增引物
1.2.1.2 慢病毒表达载体酶切及In-fusion连接 将pL6.3-CMV-GFPa1-IRES-MCS载体通过NheI/AscI双酶切,酶切体系:1×Buffer 5 μl、5 μg/50 μl质粒1 μg、NheI 2 μl、AscI 2 μl,加ddHO至50 μl。酶切产物经0.8%琼脂糖凝胶电泳,切胶回收,得到线性化pL6.3-CMV-GFPa1-IRES-MCS载体。pL6.3-CMV-GFPa1-IRES-MCS线性化载体和HBV DNA-1.3P通过Infusion连接后转化DH5α感受态细胞,连接体系:5×CE II Buffer 4 μl、pL6.3-CMV-GFPa1-IRES-MCS线性化载体50~200 ng、HBV DNA-1.3P 20~200 ng、Exnase® II 2 μl,加ddHO至20 μl混匀。选择转化的克隆进行PCR鉴定,阳性克隆委托测序公司测序鉴定。
1.2.2
mRNA慢病毒包装及滴度测定 293A细胞经0.05% Trypsin消化并铺在10 cm培养皿中,细胞数为6×10个/皿,培养过夜。转染前,将培养皿内完全培养液换成5 ml Opti-MEM培养液。在5 ml EP管中加入1.5 ml Opti-MEM、9 μg Packaging Mix和3 μg慢病毒表达质粒,混匀;在另一5 ml EP管中加入1.5 ml Opti-MEM和36 μl lipofectamine 2000混匀。把质粒和lipofectamine 2000稀释液混匀20 min后,再将质粒脂质体复合物加入到培养皿中充分混匀,培养4~6 h后换培养液,培养48 h离心后收集上清液,过滤,获得慢病毒原液。使用荧光法测定病毒活性滴度。1.2.3
HepG2和HepG2.2.15细胞MOI测定 293T细胞用胰酶消化后制成悬液,计算所需病毒液体积,每个感染复数 (multiplication of infection, MOI)梯度设加8%聚凝胺组和不加8%聚凝胺组,将所需的病毒液加至靶细胞中,对照为慢病毒侵染293A细胞,MOI值=1,加8%聚凝胺,放在培养箱中培养48 、72 h后,观察细胞存活状态和侵染后阳性细胞比例并拍照。1.2.4
HepG2和HepG2.2.15慢病毒侵染及转染 病毒侵染前一天将靶细胞接种至96孔板(第2天细胞密度以60%~70%为宜)。将病毒液冰上融解后,根据测定的MOI值用含2%FBS的MEM培养基稀释,加8 μg/ml的Polybrene,混匀后将配置好的病毒液加入细胞中,培养箱中培养4~6 h后换液,观察细胞生长状态和荧光蛋白表达情况并拍照。把293A细胞接种于12孔板中培养,去除原来的培养液,换为opti-MEM,接着配置DNA或RNA与脂质体的复合物,将其加到细胞中孵育4~6 h后换液继续培养,24 h后观察转染情况。1.2.5
qPCR检测HBVDNA复制及结果分析 收集各组细胞,抽提总DNA。HBV DNA的检测引物(上游引物:CTCGTGGTGGACTTCTCTC,下游引物: CAGCAGGATGAAGAGGAA);以18 S rDNA为内参,扩增引物为引物18S-F(序列:GAATTGACGGAAGGGCACCAC)和18S-R(序列:AAGAACGGCCATGCACCACCA)。基因倍数关系以R=2表示 。参考前期反应体系:2×SYBR Green PCR Master Mix 10 μl、引物F 1 μl、引物R 1 μl、模板 1 μl、RNase-free HO 5 μl;PCR反应条件:95 ℃、30 s,60 ℃、30 s,72 ℃、30 s,重复40个循环。
1.2.6
化学发光法检测细胞上清液中HBsAg和HBeAg表达量 参照前期实验方法,收集细胞上清液,测定HBsAg和HBeAg表达量,检测方法根据HBsAg、HBeAg试剂盒说明书。1.2.7
免疫荧光法检测细胞内HBsAg表达量 参照前期实验方法,将细胞爬片,0.25%TRITON X-100/PBS孵育5 min,使细胞通透,用10%BSA/PBS,37 ℃下孵育30 min,再用3%BSA/PBS稀释浓度为1 ∶100的Mouse Anti-HBsAg (H2F4)抗体,37 ℃下孵育2 h,3%BSA/PBS稀释浓度为1 ∶200的Anti-Mouse IgG H&L (PE/Cy5.5) preadsorbed,37 ℃下避光孵育45 min,荧光显微镜观察并拍照,将照片用Image-Pro Plus软件计算平均吸光度和分析荧光的强弱。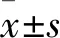
2 结果
2.1 mRNA慢病毒表达载体的制备
以HepG2基因组为模板扩增PPARα、NFIB和IL-8 mRNA的CDS序列,然后将该序列插入慢病毒表达载体pL6.3-CMV-GFPa1-IRES-MCS中,并对这些载体进行测序验证,获得构建正确的pL6.3-CMV-GFPa1-IRES-NFIB、pL6.3-CMV-GFPa1-IRES-PPARα和pL6.3-CMV-GFPa1-IRES-IL-8载体,见图1。
图1 pL6.3-CMV-GFPa1-IRES-NFIB、pL6.3-CMV-GFPa1-IRES-PPARα 和pL6.3-CMV-GFPa1-IRES-IL-8载体的测序图谱

图2 慢病毒滴度测定荧光图 ×100
2.2 mRNA表达慢病毒包装
将pL6.3-CMV-GFPa1-IRES-NFIB、pL6.3-CMV-GFPa1-IRES-PPARα和pL6.3-CMV-GFPa1-IRES-IL-8质粒分别和PSPAX2、PMD2G质粒共转染293A细胞后包装病毒,收集病毒液,浓缩。采用荧光法测定慢病毒滴度,实验分别用0.4 μl慢病毒液侵染1×10个细胞,pL6.3-CMV-GFPa1-IRES-NFIB感染细胞比例达到60%,其滴度为1×10×60%×10/0.4=1.5×10TU/ml;pL6.3-CMV-GFPa1-IRES-PPARα和pL6.3-CMV-GFPa1-IRES-IL-8病毒液感染细胞比例达到40%,其滴度为1×10TU/ml。见图2。2.3 HepG2.2.15、HBV1.3P-HepG2细胞内各组mRNA相对表达量的比较
将PPARα、NFIB及IL-8基因分别转入HepG2.2.15、HBV1.3P-HepG2细胞中,将NC作为对照组,转染48 h收集细胞沉淀。秩和检验结果显示,在以上2种不同细胞中,NC组与PPARα组比较,差异有统计学意义(P
<0.05);NC组与NFIB组比较,差异有统计学意义(均P
<0.05);NC组与IL-8组比较,差异有统计学意义(均P
<0.05)。见表2。
表2 HepG2.2.15、HBV1.3P-HepG2细胞内 各组mRNA相对表达量的秩和检验(n=6)
2.4 HepG2.2.15、HBV1.3P-HepG2细胞内各组HBV DNA相对表达量的比较
PPARα分别转染HepG2.2.15、HBV1.3P-HepG2细胞后能促进HBV DNA的复制,其表达程度分别是NC组的1.46倍和1.27倍,差异有统计学意义(P
<0.05);NFIB分别转染HepG2.2.15、HBV1.3P-HepG2细胞后可以抑制HBV DNA的复制,其表达程度分别是NC组的0.76倍和0.55倍,差异有统计学意义(P
<0.05、P
<0.001);IL-8分别转染HepG2.2.15、HBV1.3P-HepG2细胞后可以促进HBV DNA的复制,其表达程度分别是NC组的1.54倍和1.62倍,差异有统计学意义(P
<0.05、P
<0.001)。见表3。2.5 HepG2.2.15、HBV1.3P-HepG2细胞上清液中各组HBsAg、HBeAg表达量的比较
与NC组比较,在HepG2.2.15、HBV1.3P-HepG2细胞上清液中,NFIB转染后可以下调HBsAg和HBeAg表达,差异有统计学意义(P
<0.001、P
<0.05);在HepG2.2.15、HBV1.3P-HepG2细胞上清液中,PPARα和IL-8转染后可以上调HBsAg和HBeAg表达,差异有统计学意义(均P
<0.05)。见表4、5。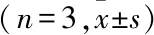
表3 HepG2.2.15、HBV1.3P-HepG2细胞内各组HBV DNA 相对表达量比较
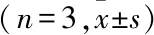
表4 HepG2.2.15、HBV1.3P-HepG2细胞上清液中 各组HBsAg表达量比较
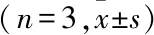
表5 HepG2.2.15、HBV1.3P-HepG2细胞上清液中 各组HBeAg表达量比较
2.6 免疫荧光检测mRNA在HepG2.2.15、HBV1.3P-HepG2细胞内对HBsAg表达的影响
与NC组比较,NFIB转染HepG2.2.15、HBV1.3P-HepG2细胞后HBsAg表达下降,差异有统计学意义(P
<0.05);PPARα和IL-8转染HepG2.2.15、HBV1.3P-HepG2细胞后HBsAg表达上调,差异有统计学意义(P
<0.05)。见表6,图3、4。3 讨论
HBV是用超螺旋结构cccDNA把其基因组物质储存起来,在细胞核内能够持久存在,而且宿主免疫应答不能干扰它。干扰素和核苷(酸)类似物这两大抗病毒药都不能干预到cccDNA,这成为HBV感染很难治愈的关键因素。宿主与病毒通过长时间的相互竞争,使得其抗病毒机理变得复杂。因此,在研究HBV与宿主之间关系的同时,尤其需要关注和有必要从宿主肝细胞内探寻药物治疗的新靶点。
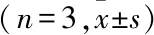
表6 免疫荧光检测mRNA在HepG2.2.15、HBV1.3P-HepG2 细胞内对HBsAg表达的影响

图3 免疫荧光检测mRNA在 HepG2.2.15细胞内对HBsAg表达的影响 ×100

图4 免疫荧光检测mRNA在HBV1.3P-HepG2细胞内 对HBsAg表达的影响 ×100
mRNA是由DNA的一条链作为模板转录而来的,携带遗传信息且能指导蛋白质合成的一类单链核糖核酸。越来越多的研究表明,mRNA在HBV复制中扮演着重要的角色。过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors,PPARs)根据功能不同,将其分为PPARα、PPARβ/δ和PPARγ3种亚型。研究表明PPARα反义序列PPARα-2能够使细胞中的PPARα mRNA和蛋白水平降低,随着剂量的增加,抑制肝癌细胞中HBsAg和HBeAg的水平越明显。Chen et al报道miR-141-3p能通过靶向PPARα mRNA,将HBV启动子的活性减少,从而抑制HBV复制。
NFIB属于核因子-I(nuclear factor-I,NF-I)家族,NFIB是其成员之一,参与各种细胞的基因转录和调控。HBV基因组中有3个NF-I结合位点可以被识别出来,且各自发挥着不同的功能。许多细胞与HBV基因启动子含有NF-1的结合点,表明HBV基因启动子的有效活化需要NF-1的参与,缺失部分或整个NF-1结合点导致HBVS基因的转录降低5~10倍。Guo et al发现NFIB对HBV增强子和核心启动子(ENⅠ-Cp)具有抑制作用,同时还能降低HBsAg和HBeAg的表达,miR372可以与NFIB相结合,从而阻止NFIB抑制HBV复制的作用。
IL-8是肝细胞内重要的炎症趋化因子,迄今为止尚不清楚IL-8在HBV致病过程中的作用。穆玄玄 等报道HBV相关慢加急性肝衰竭患者肝组织及外周血IL-8水平显著升高,且血清IL-8水平与患者肝脏炎症损伤和病情严重程度有关。近年来研究表明,在HBV感染早期阶段,IL-8可以促进HBV复制,IL-8过表达可导致肝细胞内产生许多HBV转录因子,可以促进CHB患者发生慢性化和重症化的风险。
本研究通过慢病毒将PPARα、NFIB及IL-8转入HepG2.2.15和HBV1.3P-HepG2细胞模型中,秩和检验结果显示,在以上2种不同细胞中,NC组与PPARα组、NFIB组、IL-8组两两比较,差异均有统计学意义,说明PPARα、NFIB及IL-8在上述细胞模型中能够正常表达。mRNA干预HBV功能验证显示,PPARα、IL-8能够增加HBV DNA表达量及上调HBsAg、HBeAg表达水平,而NFIB能够减少HBV DNA表达量及下调HBsAg、HBeAg表达水平。随后采用免疫荧光检测mRNA在2个细胞模型内对HBsAg表达的影响,结果显示,NFIB转染HBV1.3P-HepG2后HBsAg表达下降,PPARα和IL-8转染后HBsAg表达上调。本研究在细胞模型内外同时做了验证,因此得出结论,肝细胞内PPARα和IL-8是一种促进HBV复制的mRNA,而NFIB是一种抑制HBV复制的mRNA,这与吴小桃 等、Guo et al、穆玄玄 等的研究结果有相似之处。与上述研究不同的是,本实验在HepG2.2.15细胞中验证的同时,选择前期成功构建的HBV1.3P-HepG2模型进行验证,该模型不仅能够稳定表达HBV标志物,而且HBV1.3P能反映病毒株的自身复制情况,有利于研究HBV复制与转录调节的全过程。
综上所述,本实验利用慢病毒基因转染技术,观察到转染后的mRNA在HepG2.2.15和HBV1.3P-HepG2细胞模型中,其中PPARα、IL-8能够促进HBV复制,而NFIB可以抑制HBV复制,但它们通过何种途径促进或抑制HBV复制,其机制有待进一步深入研究。NFIB可能成为治疗HBV的新型药物作用靶点,有待在动物模型上进一步验证其抑制HBV的疗效。本研究显示,在HepG2.2.15、HBV1.3P-HepG2细胞模型中过表达IL-8能够提高HBV复制水平。该研究结果可能有助于更好地认识肝脏炎症与HBV DNA载量之间的辨证关系,明确中医药(包括壮医药)在抗HBV领域的定位与价值,实现中医药抗HBV治疗的新突破。
