下调PMEPA1表达对肝癌细胞HepG2增殖与转移的影响
2021-06-02杜卫东吴正升
张 涛,陈 强,杜卫东,吴正升
肝细胞性肝癌(hepatocellular carcinoma,HCC)是全世界癌症相关死亡的四大死亡原因之一,也是最常见的恶性肿瘤之一。尽管目前外科手术、消融治疗等技术日益发展,但由于肿瘤复发和肝内转移导致HCC患者的5年生存率仍然很低。因此,探索肝癌生物学的发生发展机制,对寻找新的治疗靶点以改善目前HCC的治疗方式有着重要意义。前列腺跨膜雄激素诱导蛋白1(prostate transmembrane protein,androgen induced 1,PMEPA1)是一种I b 型膜蛋白,其在细胞内主要定位于溶酶体膜、核内体膜和高尔基复合体膜上。PMEPA1最初是在前列腺中被发现,并证实为雄激素诱导上调基因。相关研究表明,PMEPA1在乳腺癌、结肠癌和肺癌等多种类型肿瘤中呈高度表达,因此,PMEPA1也被称为实体肿瘤相关基因1(solid tumor associated gene 1,STAG1)。PMEPA1对HCC发生发展的影响及作用机制目前尚不清楚。该实验通过转染siRNA沉默PMEPA1在肝癌细胞株HepG2中的表达,并分析对其增殖和转移的影响,为进一步探讨HCC发生发展机制提供新的依据。
1 材料与方法
1.1 材料与试剂
收集来自安徽医科大学第一附属医院病理科 2014年1月—2018年12 月HCC石蜡包埋标本112例,癌旁非肿瘤肝组织石蜡包埋标本86例。所有结果均由2位病理科医师采用双盲原则进行评判且所有患者并未进行术前放化疗。从UALCAN数据库中检索数据,其中正常肝组织50例,HCC组织371例。人肝癌细胞株HepG2(美国 ATCC 细胞库); 鼠抗人β-actin抗体、兔抗人PMEPA1抗体(武汉三鹰生物公司); RNA反转录试剂、实时荧光定量PCR试剂(北京全式金生物公司); Transwell小室、Lipofectamine 3000转染试剂、0.25%胰蛋白酶、蛋白裂解液(上海碧云天生物公司);无血清培养基 OPTI-MEM、RPMI 1640 培养基、胎牛血清(fatal bovine serun,FBS)(美国 GIBCO 公司);免疫组化使用通用型 EnVision 两步法试剂盒及 DAB 显色剂(北京中杉金桥公司)。根据实验步骤进行操作,同时以 PBS 缓冲液作为阴性对照。1.2 方法
1.2.1
免疫组化染色 HCC组织及正常肝组织标本使用福尔马林溶液(10%)固定,石蜡包埋,切成约4 μm 的连续切片,采用EnVision 两步法对肝癌及正常肝组织中PMEPA1的表达水平进行检测,操作方法严格按照试剂盒说明书进行。1.2.2
结果判定 将免疫组化染色强度分为以下3类: 0 分:细胞无着色; 1 分:细胞着色为淡黄色;2 分:细胞着色为深棕色: 3分。同时将阳性细胞百分比分值分为以下4类: 0 分: 无阳性细胞;1 分: 阳性细胞 ≤ 20%; 2 分: 阳性细胞 21%~50%;3 分: 阳性细胞 51%~75%;4 分: 阳性细胞 >75%。最终将染色强度分值与阳性细胞百分比分值相乘得出结果并分为以下3组: 0 分:阴性组;1~4分:低表达组;6~12分:高表达组。1.2.3
细胞培养 肝癌细胞株HepG2培养于DMEM培养基中(10% FBS、1% 青霉素-链霉素)并放置于37 ℃,含有5% CO的培养箱中培养,1~2 d后更换培养基,若细胞长满,则进行细胞传代。1.2.4
转染siRNA购买PMEPA1 的 siRNA ( siPMEPA1和siPMEPA2) 和阴性对照(NC) (上海吉玛生物公司)。siRNA序列如下: siPMEPA1上游:5′-GCAACUGCAAACGCUCUUUTT-3′;siPMEPA1下游:5′-AAAGAGCGUUUGCAGUUGCTT-3′;siPMEPA2上游:5′-GAGCAAAGAGAAGGAUAAATT-3′;siPMEPA2下游:5′-UUUAUCCUUCUCUUUGCUCTT-3′;NC上游:5′-UUCUCCGAACGUGUCACGUTT-3′;NC下游:5′-ACGUGACACGUUCGGAGAATT-3′。将购买的HepG2细胞培养传代后,选取对数生长期的细胞接种于6孔板中,平均6孔板每孔接种2×10个细胞密度进行过夜培养,依据转染试剂 Lipofectamine 3000的说明书转染siPMEPA1和NC后收集细胞,然后采用Western blot及qRT-PCR法检测转染效率。
1.2.5
收取蛋白进行Westernblot检测 收集待检测细胞,裂解液裂解细胞后提取总蛋白,使用10% SDS-PAGE 凝胶电泳,在恒流300 mA,转90 min的条件下转至PVDF膜上,再使用5% 牛奶封闭1 h,随后使用一抗4 ℃孵育过夜,第2天使用PBST溶液洗膜后孵育二抗1 h后,再次使用PBST溶液进行洗涤,最后加入显影液进行曝光并采集图像,结果进行灰度分析后进行数据统计。
1.2.6
qRT-
PCR检测 收集细胞,先使用TRIzol试剂从细胞中提取总RNA,再使用RNA反转录试剂盒按照操作说明进行反转录cDNA。在预变性95 ℃、40 s,95 ℃、5 s,60 ℃、30 s,95 ℃、15 s,60 ℃、57 s,95 ℃、15 s下完成,退火后采集荧光信号。本实验每组设置3个平行副孔,取平均值后并将所得数据导出Excel,并绘制柱状图。GAPDH引物序列如下:上游:5′-TGCACCACCAACTGCTTAGC-3′,下游:5′-GGCATGGACTGTGGTCATGAG-3′。PMEPA1引物序列如下: 上游:5′-GTCTGCACGGTCCTTCATCAGC-3′;下游:5′-GCACTATCCATCAGGTCACTGTCG-3′。以上引物序列均由上海生工公司合成。1.2.7
MTT检测细胞增殖能力 先用胰酶消化细胞并计数。实验使用96孔板,每孔接种HepG2细胞1×10个,每1组设置6个平行副孔,连续测定5 d。检测时,现将96孔板中的培养基弃去,待测孔每孔加入100 μl 混合液(MTT液与培养基按1 ∶9比例混合)后放置于37 ℃ 温箱孵育2 h,弃去混合液后待测孔每孔加入100 μl DMSO并置于摇床上避光摇25 min。最后使用酶标仪测检测OD570,得出数值取平均值后作图。1.2.8
Transwell实验检测细胞转移能力 先用胰酶消化细胞并计数。Migration实验使用24孔板,每孔先加入800 μl的含有FBS的培养基,培养基上方置入Transwell 小室,小室中加入总体积200 μl的无血清重悬的细胞5×10个,放置于37 ℃温箱6 h 后,拿出小室。使用1×PBS溶液清洗小室内壁,再用90%的乙醇固定30 min后使用0.1% 结晶紫染色15 min。染色结束后,用细水流清洗小室内壁,用棉签清除剩余的结晶紫。每组随机选取3个视野在荧光倒置显微镜下观察后计数并作图。1.2.9
UALCAN数据库根据UALCAN数据库(http://ualcan.path.uab.edu/index.html)中RNA-seq和肝癌类型的临床数据,分析PMEPA1 mRNA在人肝正常组织和HCC组织中的表达。根据数据库数据进行统计,作图。
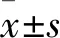
2 结果
2.1 PMEPA1在正常肝组织及HCC中的表达
通过UALCAN数据库检测在50例正常肝组织和371例HCC组织中PMEPA1的表达,结果显示:HCC组织中PMEPA1表达的中位值高于正常肝组织(P
<0.01,见图1)。通过免疫组化染色方法,检测112例HCC组织以及86例肝正常组织PMEPA1蛋白表达,结果表明PMEPA1蛋白定位于细胞质,以弥漫均质淡黄色至棕褐色颗粒作为阳性。每张切片随机选取 5 个高倍视野观察,采用半定量评分标准判断。免疫组化结果显示PMEPA1蛋白在HCC组织呈阳性反应,见图2,与正常肝组织相比,差异有统计学意义(χ=28.94,P
<0.05),见表1。
图1 PMEPA1在正常肝组织及HCC组织中的表达 与正常肝组织比较:**P<0.01

图2 检测PMEPA1在不同肝组织中的表达状况 DAB×100

表1 PMEPA1 在HCC组织和正常肝组织中表达 [n(%)]
2.2 PMEPA1蛋白在HCC组织中的表达与临床病理参数之间的的关系
通过分析112例HCC组织与86例正常肝组织的临床病理参数,发现PMEPA1蛋白表达与患者肿瘤直径(χ=4.369 8,P
<0.05)和淋巴结转移密切相关(χ=4.406 9,P
<0.05) ,但与患者性别、年龄、AFP 水平高低、脉管浸润、组织学分级、TNM分期均无相关性。见表2。
表2 PMEPA1在肝癌组织中的表达与临床病理 特征的关系 [n(%)]
2.3 PMEPA1在HepG2细胞中的表达
随后检测PMEPA1在HepG2细胞中的表达,通过转染PMEPA1特异性的 siRNA后,应用qRT-PCR 检测PMEPA1的 mRNA 水平表达。与NC组相比, PMEPA1-siRNA 组中的mRNA表达水平下调,NC组与PMEPA1-siRNA 组差异有统计学意义(F
=76.06,P
<0.01),见图3A。同时通过Western blot 检测,结果显示: PMEPA1-siRNA 组的PMEPA1的蛋白表达下调,差异有统计学意义(F
=144.9,P
<0.01),见图3B。2.4 下调PMEPA1对HepG2细胞活力的影响
使用已转染siPMEPA1的HepG2细胞,应用MTT实验检测 PMEPA1对HepG2细胞增殖的影响,结果显示,第5天siPMEPA1转染组的细胞增殖低于NC组,且差异有统计学意义(F
=163.5,P
<0.01),见图4。
图3 转染siPMEPA1后PMEPA1表达量

图4 使用MTT检测转染siPMEPA1后对 HepG2细胞增殖能力的影响
a:NC组;b:PMEPA1-siRNA1组;c: PMEPA1-siRNA2组;与NC组比较:P
<0.012.5 下调PMEPA1抑制HepG2细胞迁移
使用上述转染后的细胞,应用Transwell实验检测PMEPA1对HepG2细胞迁移能力的影响。实验结果表明,10倍镜下观察,与NC组相比,PMEPA1-siRNA1组和PMEPA1-siRNA2组细胞的迁移能力降低,且差异有统计学意义(F
=161.3,P
<0.01)。见图5。
图5 使用Transwell法检测转染siPMEPA1后对 HepG2细胞迁移的影响
3 讨论
PMEPA1基因定位于人染色体20q13.31~q13.33。该基因长度约为 62 kb,含有5个外显子和3个内含子。PMEPA1对肿瘤细胞的转化生长因子β (transforming growth factor β, TGF-β)起到诱导作用,进而影响肿瘤细胞的上皮间质转化(epithelial-mesenchymal-transition,EMT)过程,EMT是恶性肿瘤细胞发生侵袭和迁移的重要生物学过程,而TGF-β在EMT的发生过程中起到关键作用。同时,TGF-β可作为胚胎和癌症发展的重要调节剂,与细胞生长,分化和迁移密切相关。
本研究首先通过检索UALCAN数据库,对数据库内371例HCC组织以及50例正常肝组织PMEPA1表达进行分析。结果显示:HCC组织中PMEPA1表达中位值明显高于正常肝组织(P
<0.01)。通过免疫组化染色方法,检测112例HCC组织以及86例肝正常组织,表明PMEPA1蛋白定位于HCC细胞质,呈弥漫均质淡黄色至棕褐色颗粒状。与肝正常组织内PMEPA1表达相比,差异有统计学意义(P
<0.05)。另外,HCC组织内PMEPA1蛋白表达与肿瘤大小(P
=0.036 6)和淋巴结转移(P
=0.035 8)密切相关。与性别、年龄、AFP 水平高低、脉管浸润、组织学分级和TNM分期均无相关性。体外实验显示,经PMEPA1- siRNA转染的肝癌细胞系HepG2的 PMEPA1蛋白及其mRNA表达均下调(P
<0.01)。 siPMEPA1转染HepG2细胞增殖能力以及转染 siPMEPA1 HepG2细胞迁移能力均明显降低 (P
<0.01),这一现象说明PMEPA1可以促进肝癌细胞的增殖和迁移。其作用机制目前尚不明了。推测潜在的分子生物学机制包括:① PMEPAI通过促进TGF-β受体溶酶体降解抑制TGF-β信号通路,促进肺癌的发生发展,影响着肺癌细胞的增殖、侵袭和迁移;② PMEPA1通过抑制Smad3/4-c-Myc-p21 Cip1信号通路促进雄激素受体阴性的前列腺癌细胞增殖;③ PMEPA1分子受经典TGF-β/Smad信号途径的作用发生显著上调,沉默PMEPA1的表达能显著抑制乳腺癌细胞MDA-MB-231的迁移能力,并使细胞形态由间质样向上皮样转变。