植物原生质体培养技术在药用植物中的应用
2021-06-01吴登宇高丹丹臧荣鑫徐红伟郭鹏辉
吴登宇,韦 体,高丹丹,臧荣鑫,徐红伟,郭鹏辉*
(西北民族大学a.生命科学与工程学院;b.生物工程与技术国家民委重点实验室,中国甘肃兰州730030)
据统计,我国中药种植面积达3 335×107m2,2015年我国中药工业产值已达7 867亿元,且以每年超过20%的速度在快速增长[1]。药用植物产生的次生代谢产物具有良好的药用及保健价值,深受人们的喜爱,如黄花蒿中的青蒿素、红豆杉中的紫杉醇及人参中的人参皂苷等,这些代谢产物在疾病治疗与保健等方面发挥着至关重要的作用[2]。然而,自然条件下药用植物产生的天然次生代谢产物产量极低,无法满足人们日益增长的需求,导致许多药用植物被过度采伐,甚至濒临灭绝。因此,如何采取科学有效的措施使药用植物资源得到保护的同时实现合理的、可持续的综合开发利用便显得尤为重要。
植物原生质体是指去除细胞壁后被质膜所包围的、具有生命力和全能性的裸露细胞,其结构包括细胞膜、细胞质(包括各种细胞器、细胞骨架系统及胞基质)和细胞核等部分[3]。目前,植物原生质体再生培养及悬浮培养等技术手段已应用到蔷薇科、紫草科、玄参科等数十个科种中,其应用潜力巨大、技术成熟。相较于其他模式植物与作物而言,药用植物在细胞瞬时转化、细胞融合、信号转导、亚细胞定位及中药品质形成分子机制解析等方面的研究还不够深入,技术体系还不够完善。因此,进一步对药用植物原生质体开展再生培养、相关功能基因解析及代谢产物合成机制研究等具有重要意义。同时,随着基因工程技术的发展,药用植物原生质体在CRISPR/Cas9技术中也将得到进一步的应用和发展。
本文以原生质体分离、培养、纯化等理论为基础,系统阐述了该技术在药用植物中的应用和发展前景,以期为特色药用植物资源的保护和综合开发利用提供新的研究思路与理论支持。
1 药用植物原生质体分离及培养方法
1.1 原生质体分离方法
原生质体的分离是原生质体培养及后续研究的关键步骤,其原材料一般以组织细胞较多、活力强及取材容易的幼嫩植物叶片为主,其分离方法主要有机械法和酶解法两种。1892年Klercher首次通过机械法获得了原生质体,但此法所获得的原生质体存在产量低且获取困难的缺陷;直到1960年Cocking通过酶解法从西红柿的根尖部位分离出大量的原生质体,原生质体的研究才进入了一个新的阶段[4]。采用酶解法进行原生质体分离时,目前广泛应用的酶有纤维素酶(cellulase)、半纤维素酶(hemicellulase)、果胶酶 (pectinase)、离析酶(macerozyme)、蜗牛酶(snailase)及崩溃酶(driselase)等[5]。从近几年的研究来看,其中较为常用的酶是纤维素酶R-10、果胶酶Y-23及离析酶R-10等。2019年,王梦茹等[6]采用2%纤维素酶R-10+0.5%果胶酶Y-23+0.3%离析酶R-10组合对矮牵牛愈伤组织进行了原生质体的分离;2020年,姜倩倩等[7]利用1%纤维素酶R-10+0.3%离析酶R-10对多年生黑麦草进行了原生质体制备,并成功构建了瞬时转化体系。这些酶在进行原生质体制备时发挥着不同的作用,其中纤维素酶与果胶酶起主要作用,纤维素酶水解细胞壁中的纤维素,果胶酶则促进细胞间隙中果胶质的分解,而其他酶类主要对这两种酶起到辅助作用[5]。有研究表明,纤维素酶RS的分离效果比纤维素酶R-10好,但纤维素酶RS的价格远高于纤维素酶R-10,因此多数研究仍主要采用纤维素酶R-10进行原生质体的分离[8]。
采用酶解法对原生质体进行分离时,除了酶的种类对分离结果产生影响外,酶解浓度、酶解时间及渗透压稳定剂等分离条件的选择均对分离结果有较大的影响。酶解液的浓度过高容易导致原生质体被酶降解,浓度过低则导致原生质体分离不彻底,这两个因素都会导致原生质体产量低下[9]。酶解时间对原生质体的产量及活力也存在重大影响,时间不足导致酶解不充分,影响原生质体的产量,酶解时间过长则直接影响原生质体活力,甚至破坏原生质体的完整性[10]。同时,失去细胞壁保护的原生质体对渗透压稳定剂也特别敏感,原生质体与外界渗透压不能维持等渗状态,易发生皱缩或者破裂,常用的等渗溶剂有KCl、NaCl、蔗糖及甘露醇等[10]。
1.2 原生质体纯化
在获取原生质体的酶解过程中,酶解作用会产生很多组织残渣(如细胞碎片、破碎的原生质体)及残留酶解液等,这些残留物的存在会给原生质体的生理状态造成不良影响,因此酶解时间结束后需要进行原生质体纯化。原生质体纯化的方法主要有漂浮法和沉淀法。漂浮法是利用高渗蔗糖溶液比重大于原生质体比重的原理,使原生质体在离心的过程中漂浮在液面上层,而组织残渣等沉淀于离心管底部,这种方法获得的原生质体的完整度与纯度比较高,但是数量较少[11]。沉淀法是通过特定的细胞过滤筛将组织残渣等过滤去除,再利用比重原理,在一定的渗透压溶液中将原生质体沉淀至离心管底部,这种方法在离心振荡过程中会对原生质体造成一定的伤害,但获得的原生质体数量较多。
1.3 原生质体培养
药用植物原生质体的培养常采用MS、B5、KM8p等改良培养基[12~13]。其中,MS培养基因含有较高浓度的NH4+而对原生质体具有一定的毒害作用,会直接影响原生质体的生长[14];B5培养基是专门为大豆组织培养设计的,其主要特点是含有高钾盐、高硝酸盐以及低铵盐等成分[15]。马锋旺等[16]在对山桃原生质体培养的过程中发现,高浓度的NH4+会抑制原生质体的分化,影响原生质体的生长分裂。而KM8p培养基中含有丰富的有机营养物质,如有机酸、氨基酸、维生素及椰乳等,对原生质体的分裂及细胞壁的形成具有一定促进作用[17],蒋友燊等[18]以KM8p+0.20 mg/L 2,4-D+0.50 mg/L 6-BA+100.00 mg/L水解酪蛋白+1.00%蔗糖+0.40 mol/L甘露醇为培养基,对百脉根原生质体进行了再生壁研究,成功测定了原生质体再生壁纤维素的含量,因此KM8p可作为百脉根原生质体分离与培养的培养基进行改良和利用。在原生质体培养过程中,植物激素作为不可或缺的一部分,主要通过调节植物细胞的生理反应影响细胞的生长与分化。目前研究较为深入的植物激素主要包括生长素(auxin)、细胞分裂素(cytokinin)、赤霉素(gibberellin,GA)、脱落酸(abscisic acid,ABA)、乙烯(ethylene)等[19],其中生长素和细胞分裂素在植物组织培养过程中被广泛使用,其主要的天然成分分别是吲哚乙酸(indole acetic acid,IAA)和玉米素(zeatin,ZT)。由于这两种天然成分稳定性差,为提高其稳定性,人们通过人工合成法相继合成了6-苄基腺嘌呤(6-benzylaminopurine,6-BA)及2,4-二氯苯氧乙酸(2,4-dichlorophenoxyacetic acid,2,4-D)等植物生长调节剂。表1对组织培养过程中常用植物生长调节剂的来源及稳定性进行了整理。
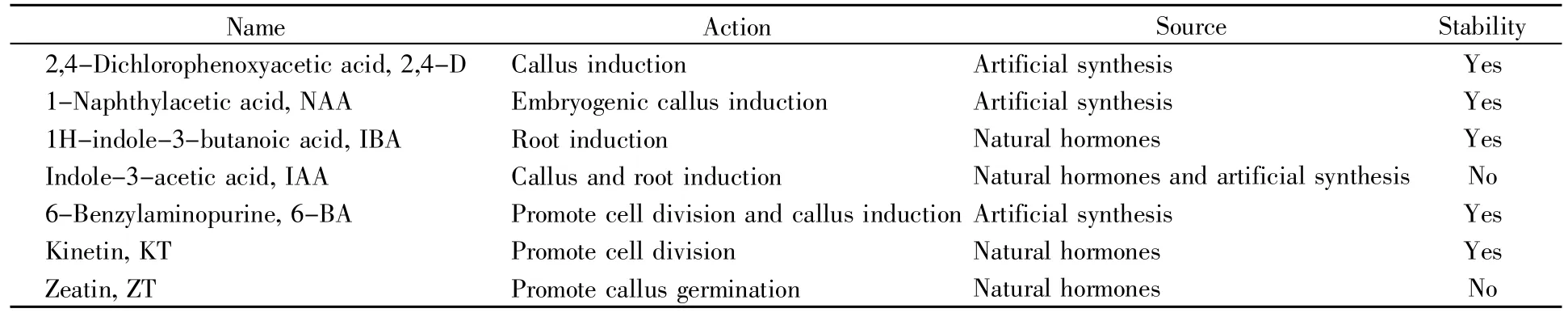
表1 药用植物再生体系建立常用植物生长调节剂Table 1 Commonly used plant growth regulators for establishment of medicinal plant regeneration system
关于药用植物原生质体的培养方法,目前有很多种,但具体方法的选择应因材料而异。常用的培养方法主要有液体浅层培养(culture in shallow liquid medium)、固-液双层培养(liquid-solid culture)、琼脂糖包埋(agarose bead culture)及看护培养(nurse culture)等。范小峰等[20]采用液体浅层培养、固-液双层培养、琼脂糖包埋等方法对南蛇藤的原生质体进行了培养和比较,发现液体浅层培养法对南蛇藤原生质体的培养效果较为理想。在此之前,李乐工[21]也采用液体浅层培养法对人参的原生质体进行了培养,并成功获得人参愈伤组织。另有研究报道,芸薹属植物的原生质体培养大多采用液体浅层培养法和固-液双层培养法,很少采用看护培养法[11]。
2 原生质体培养技术在药用植物中的应用
2.1 在药用植物快速繁殖中的应用
目前,我国将原生质体培养技术运用于药用植物培养并获得成功的主要有前胡(Peucedanum praeruptorum Dunn)、防风(Saposhnikovia divaricata(Trucz.)Schischk.)、党参(Codonopsis pilosula(Franch.)Nannf.)、石刁柏(Asparagus officinalis L.)、枸杞(Lycium barbarum L.)及红景天(Rhodiola rosea L.)等。原生质体主要通过3种途径进行植株再生:一是由原生质体分化形成愈伤组织,再继续分化成植株;二是由原生质体分化成胚状体,再发育成植株;三是由原生质体分化形成愈伤组织,愈伤组织再分化成胚状体,最终发育成植株。王济玫等[22]利用前胡幼苗切段诱导出愈伤组织,经细胞悬浮培养后获得大量具有胚性的细胞团,再经酶解分离得到大量原生质体,原生质体经液体浅层培养后移接至MS固体培养基上进行培养,最终获得完整植株。李继胜等[23]从党参下胚轴愈伤组织中分离出原生质体,经液体浅层培养获得胚状体并发育成完整植株。刘剑锋等[24]通过组织培养获得了红景天组培苗叶,将组培苗叶进行酶解处理得到了红景天原生质体,原生质体经浅层培养后获得了愈伤组织,愈伤组织分化形成不定芽,继而发育形成完整植株。表2对其他一些经原生质体培养获得再生植株的物种[25~30]进行了概括。

表2 药用植物原生质体培养概况Table 2 An overview of protoplast culture of medicinal plants
随着植物组培技术的发展,植物原生质体的研究工作越来越受到重视,其相关研究在国内外不断开展并取得了巨大成就,主要体现在越来越多的植物种类通过原生质体实现了植株再生,突破了常规育种的限制。因此,深入研究如何利用该技术加快育种进程、解决药用植物组培快繁难等问题,对药用植物品种改良和种质资源保护具有重要意义。
2.2 在有效成分分离提取方面的应用
目前,全世界约有千余种植物可通过细胞悬浮培养产生次生代谢产物。药用植物细胞悬浮培养产生的天然产物可应用于药品、香料、色素、食品、化妆品等产品的开发。原生质体培养技术在药用植物有效成分提取方面具有很高的应用价值,很多药用植物的原生质体已完成了实验室阶段的研究,走向了大规模生产阶段,如人参(Panax ginseng C.A.Meyer)、红豆杉(Taxus wallichiana var.chinensis(Pilg.)Florin)、紫草(Lithospermum erythrorhizon Sieb.et Zucc.)、黄芪(Astragalus propinquus Schischkin)等。
紫杉醇作为目前较为有效的抗癌药物,被广泛应用于各类癌症治疗,如卵巢癌、乳腺癌、肺癌等,其生产方式主要有化学合成法、半合成法、人工种植栽培法及细胞培养法,在这些方法中细胞培养法是最具有潜力的方法。该法首先以红豆杉为原材料进行其愈伤组织的诱导和驯化,并筛选出适合于植物细胞培养的细胞株,然后进行细胞悬浮培养生产紫杉醇,目前其生产已完全实现工业化,质量浓度在100 mg/L以上[31]。紫草素为萘醌类化合物,具有抗炎、降胆固醇及抗肿瘤等作用,1983年日本率先成功地进行了紫草宁衍生物的工业化生产[32]。人参皂苷是从人参细胞中分离出的三萜类化合物,具有抗疲劳、提高记忆力、增强免疫等功效。研究表明,通过人参愈伤组织诱导并采用13万L发酵罐进行细胞发酵培养,已能够基本满足人们对于人参药用有效成分的需求[33]。
2.3 在膜侵染方面的应用
由于酶解液的作用,原生质体失去细胞壁的保护,更利于接受外源基因,也更易于进行细胞融合等操作。原生质体不仅可以用于研究植株再生、悬浮培养生产次生代谢产物,同时还是开展病毒侵染机理、膜转运及融合等基础研究的理想材料。陈雅寒等[34]以抗烟草花叶病毒(tobacco mosaic virus,TMV)活性为指标,对马蓝、玉簪、鸦胆子等13种常见中草药进行了抗病毒活性筛选,结果显示被TMV侵染的烟草原生质体在加入0.5 μg/mL马蓝醇提取物后仍可以维持细胞完整性。
2.4 在原生质体融合方面的应用
自1972年Carlson将原生质体融合技术应用于烟草体细胞并获得第1株杂种植株后,该技术便开始被广泛应用于药用植物的原生质体融合[35],例如:霍丽云等[36]将紫外线照射后的柴胡原生质体与石防风原生质体进行融合,得到了34个杂种细胞系;江莉[37]利用原生质体融合技术成功实现了獐牙菜与柴胡的体细胞远缘杂交,且研究结果表明,獐牙菜与柴胡的遗传物质在杂交植株中均有表达。原生质体融合技术不仅克服了种间不亲和的缺点,还能高效地将外源遗传物质成功导入受体细胞,为物种改良、遗传育种提供了重要理论基础[38~39]。虽然原生质体间可以自发融合,但频率很低,聚乙二醇(polyethylene glycol,PEG)诱导法是目前在植物中诱导原生质体融合最广泛的方法,具有诱导融合频率高、无种属特异性要求、不需要特殊的仪器、操作简单等特点。彭章等[40]以酶解法分离出茶树原生质体,通过40% PEG-6000诱导融合,其融合率达10%。目前,介导原生质体融合的方法不仅有PEG法,还有硝酸钠法、高浓度Ca2+高pH值法、电融合法及聚集微束激光法等。
2.5 在分子细胞生物学研究中的应用
植物原生质体瞬时转化体系是研究基因功能与亚细胞定位的快速途径,转化方法包含PEG转化法、电击转化法及显微注射法等[41]。通过遗传转化法分析药用植物有效成分相关合成基因的功能,不仅可为药用植物的遗传改良提供有效的基因资源,也可为药用植物的产业发展提供有利途径。胡添源等[42]对药用植物雷公藤进行了原生质体分离,并通过PEG转化法成功构建了其遗传转化体系,为雷公藤基因编辑及合成生物学研究奠定了基础。Patra等[43]利用电击转化法对长春花叶肉原生质体中参与茉莉酸代谢和长春碱代谢相关的转录因子进行了瞬时转化,并通过qRT-PCR对各个转录子的表达情况进行了检测。
在植物原生质体培养过程中,受到外界环境及培养条件的影响,细胞在生长过程中有时会出现突变体。由于自发变异程度低,人们可通过物理、化学及生物等处理手段定向诱导细胞发生变异,得到变异基因型细胞,从而为植物新品种的选育提供更多的选择。相关研究报道,莴苣原生质体在诱导形成再生植株的过程中发生了变异,再生植株呈现不同的性状表型,如有的长势好;有的成熟期不同;有的育性降低等[44]。
2.6 在中药品质形成分子机制中的应用
目前,药用植物原生质体的研究主要集中于原生质体的分离获取、瞬时转化等方面,在中药品质形成分子机制方面的研究还有很大的空间,而中药品质形成分子机制解析是中药资源研究中的重点和难点[45]。上述细胞融合、细胞瞬时转化及原生质体再生等研究的不断深入,可为中药品质形成分子机制的探究提供理论依据。
张改娜等[46]以秦艽愈伤组织为材料制备原生质体,构建了高效、稳定的培养体系,为秦艽细胞规模化培养及秦艽的品质改良工作奠定了基础。此外,Ren等[47]对中药红花进行了原生质体分离研究,构建了原生质体的转化体系,并解析了红花中有效成分类黄酮在合成过程中的一些功能基因启动子的活性,为其后续品质形成分子机制研究奠定了理论基础。
3 存在的问题
自原生质体培养技术应用于植物研究以来,其在植物细胞融合、天然产物提取、蛋白质互作等方面取得了很多重要的进展[48],同时也存在很多问题。将原生质体培养技术应用于诸多药用植物当中,只有少数药用植物成功构建了再生体系,如人参、红景天等,大部分药用植物的原生质体分离及培养存在较大困难,导致该方面研究很难有重大突破,尤其是近年来,人们对在植物中构建稳定的原生质体分离及培养体系不够重视,致使该技术无法在中药中进行规模化应用。另外,虽然利用原生质体培养获取药用植物次生代谢产物在药用植物资源利用上具有良好的优势,但是目前只有少量药用植物达到大规模生产的程度,主要原因在于其培养成本高于大田培养,且产物不稳定、不能进行商品化,其次是植物原生质体分裂繁殖能力远低于微生物,且由于其特殊性,不能完全适应生物反应器培养。因此,应从实际出发,将原生质体培养技术与其他前沿生物技术(如基因编辑)结合应用于难以进行人工培育且野生资源短缺的药用植物,在保护其种质资源的同时,对其次生代谢产物进行充分利用,满足人们的需求。
4 展望
药用植物是天然药物的重要来源,也是我国中医药事业发展的基础,目前其研究工作主要集中在有效成分分析和药理作用探讨等方面,但在药材品质控制、特色濒危植物保护、人工组培快繁体系构建以及次生代谢产物规模化生产等方面的研究起步较晚,尤其是通过植物组培技术对药用植物进行人工驯化、选育以及次生代谢产物的规模化生产方面仍然存在着许多亟待解决的科学问题。首先,在药用植物优质高产品种的人工驯化和选育方面,其木质化程度往往较为严重,导致组培苗在培养过程中发生褐化或者玻璃化而难以成活;其次,受到生长环境和技术条件的限制,许多药用植物的天然有效活性成分的合成途径与调控机制仍不清楚,极大地制约了药用植物资源的进一步开发利用与可持续发展。原生质体培养技术具有生长速度快、培养条件易于控制的典型特征,不仅克服了传统药用植物在种植栽培过程中对环境条件的过度依赖,而且在基因功能研究和天然活性成分生产方面也有着巨大的应用潜力,但针对药用植物原生质体培养过程中的次生代谢产物不稳定、成本高且技术操作难度高等问题,还需进一步研究和探讨。