基于核酸适配体的DNA纳米结构在肿瘤研究中的应用进展
2021-06-01靳思涵张书睿李婉明
靳思涵,张书睿,李婉明
(中国医科大学生命科学学院卫生部细胞生物学重点实验室医学细胞生物学教育部重点实验室细胞生物学教研室,中国辽宁沈阳110122)
1953年,Watson和Crick提出著名的DNA双螺旋结构模型[1],人类对DNA的研究开启了一个新纪元。1982年,纽约大学的Seeman教授首次提出DNA纳米技术这一概念,即利用碱基之间的互补配对(A-T,C-G)原则将DNA的经典线性组装成三维晶体结构[2]。Seeman教授设计的四臂连接体是利用两个DNA片段单链末端的序列互补发生杂交而成,这个简单的构想逐渐成为了DNA自组装的主要策略。随后,越来越多的研究者设计出各种各样的DNA纳米结构,如四边形DNA纳米结构[3]、DNA双交叉瓦片[4]、DNA张力三角形结构[5]、DNA 折纸术[6]、DNA“乐高”积木[7]等,推动了DNA纳米技术的蓬勃发展,同时也使得DNA纳米结构在不同的研究领域得到广泛的应用。核酸适配体(aptamer,Apt)是一类能够高亲和力、高特异性地与靶标发生结合的寡核苷酸序列,其独特的优势使其近年来成为肿瘤研究的理想工具[8]。将核酸适配体的特异性识别特性与DNA纳米结构相结合形成的核酸适配体-DNA纳米结构,可以为肿瘤诊断和治疗提供更加有效的、低毒副作用的方法[9]。本文主要介绍了DNA纳米结构和核酸适配体的特点与优势,总结了核酸适配体-DNA纳米结构用于肿瘤特异性检测、靶向成像及诊疗新策略等方面的研究进展。
1 DNA纳米结构
DNA纳米结构是以DNA片段作为基本材料,利用碱基互补配对原则进行自组装,进而杂交形成具有特定形状及功能的空间结构,如三链结构、离子桥联配合物、i-motif、G-四链体以及发卡结构等[10]。由于DNA的空间结构具有较高的可控度和精密度,所以组装成的DNA纳米结构具有许多独特的优点:生物相容性和无毒性、不易被核酶降解、良好的可设计性和高渗透性等,这使得DNA纳米结构具有优越的生物医学应用前景[11~14]。Liu等[12]设计出一个具有高选择性的DNA纳米探针,可用于线粒体中pH值和Ca2+的定量分析以及细胞的实时成像。Raniolo等[13]利用设计的叶酸-DNA纳米笼对两种独特的由内化途径介导的细胞摄取过程进行了研究。此外,还有研究者设计了能在特定DNA轨道上行走的DNA纳米小人,其可在DNA互补杂交的热动力学效应产生的能量推动下实现纳米尺度下的物质输送[14]。随着DNA纳米技术的快速发展,不同维度、多种形状和大小各异的DNA纳米结构被组装出来(图1),并且基于其易于修饰的特征,功能化的DNA纳米结构由于兼具DNA纳米结构和特异性功能分子的特性,在生物检测和成像、药物输送等领域应用广泛[14]。
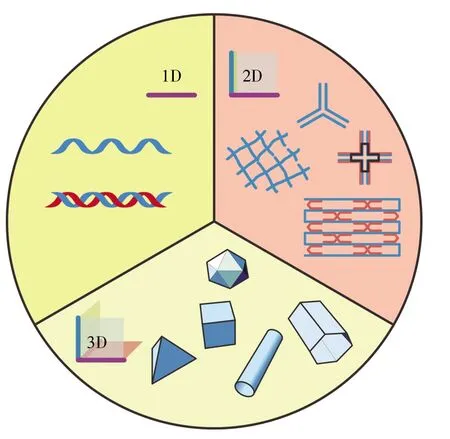
图1 不同维度的DNA纳米结构Fig.1 DNA nanostructures in different dimensions
2 核酸适配体
核酸适配体是一段短的寡核苷酸片段(ssDNA或RNA),通过一种指数富集的配体系统进化技术(systematic evolution of ligands by exponential enrichment,SELEX)在一个人工构建的随机寡核苷酸文库中筛选获得。核酸适配体能够折叠形成特定的三维空间结构(如G-四链体、发夹和假结等),与靶物质发生高亲和力、高特异性的结合[15],因此被称为“化学抗体”(图2)。与蛋白质类抗体相比,核酸适配体具有靶物质广泛、相对分子质量小、稳定性高、免疫原性低、易于化学修饰、特异性与亲和力更高等优势,因此在生物医学领域具有广泛的应用价值[16~17]。利用核酸适配体与靶物质的特异性识别特性,结合不同的修饰基团或纳米材料,可以设计出多种多样的具有靶向性的分子探针,在活细胞靶向成像、肿瘤诊断及治疗、药物递送等领域都有着良好的应用前景[18~20]。比如:作为特异性识别单元构建的荧光探针或传感器,可以快捷、灵敏地对细胞内或细胞表面的物质进行检测和定量分析;与抗肿瘤药物相结合构建的主动靶向药物载体可以实现药物的靶向传递,并有效地降低对周围正常组织的毒副作用。因此,核酸适配体是肿瘤靶向诊断和治疗的一类理想工具。

图2 核酸适配体结合靶标的示意图Fig.2 Schematic diagram of a nucleic acid aptamer binding its target
3 核酸适配体-DNA纳米结构
近年来,将核酸适配体的序列结构镶嵌到自组装的DNA纳米骨架中构建的核酸适配体-DNA纳米结构(图3),既具有核酸适配体的靶向特性,又具有DNA纳米结构良好的生物相容性和可编程性,因此在分离分析、生物传感器、生物成像和药物精准输送等领域得以广泛的研究与应用[21~24]。其作用机制是在核酸适配体靶物质存在的情况下,通过与核酸适配体的特异性识别作用引起自组装体中DNA分子骨架的结构变化,进一步引起光谱性质的改变或自组装体内物质的释放,从而实现生物特异性检测、靶向成像及疾病治疗的目的[21]。Rinker等[22]利用DNA纳米结构的精确寻址性控制与凝血酶不同区域结合的两个核酸适配体Apt-A和Apt-B之间的间距,从而操纵二者与凝血酶结合的能力,这是首例利用核酸适配体-DNA纳米结构人工模拟控制生物大分子相互作用的报道。Tang等[23]将PfLDH(plasmodium falciparum lactate dehydrogenase)核酸适配体整合到DNA纳米结构中用作疟疾治疗,通过蛋白质识别触发核酸适配体的构象改变,从而打开DNA折纸纳米盒,释放盒内的药物,进行靶标特异性治疗。随着以细胞为靶标的SELEX(cell-SELEX)技术的发展,越来越多的肿瘤特异性核酸适配体被筛选出来,基于核酸适配体的DNA纳米结构有望成为肿瘤靶向诊断和治疗的理想工具。
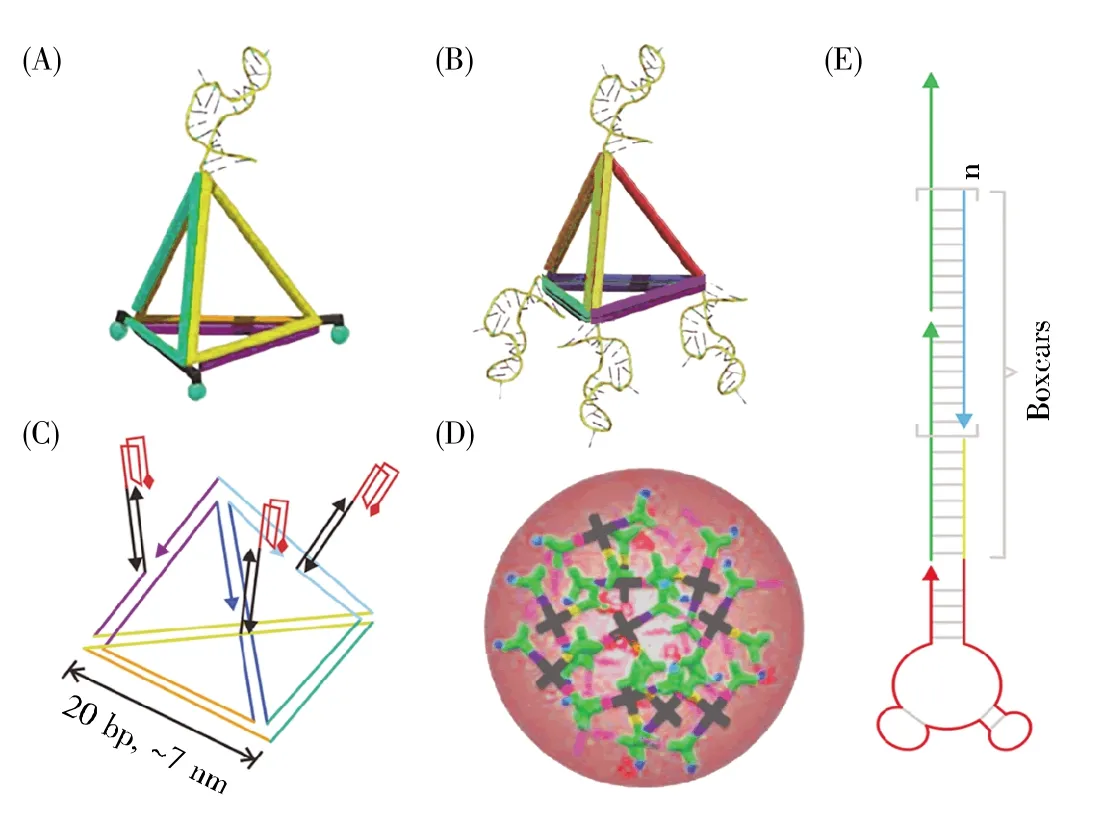
图3 基于核酸适配体的DNA纳米结构Fig.3 DNA nanostructures based on nucleic acid aptamers
4 核酸适配体-DNA纳米结构在肿瘤诊断中的应用
发展能够高灵敏、高特异性地检测和分析肿瘤细胞的新方法或新策略,对肿瘤的预测及早期发现具有重要意义。近几年,越来越多的研究者设计多种多样的核酸适配体-DNA纳米结构用于肿瘤细胞的检测[25~28],有望为肿瘤诊断提供更加便捷、快速和灵敏的新策略(表1)。

表1 核酸适配体-DNA纳米结构在肿瘤诊断中的应用Table 1 Application of aptamer-DNA nanostructures in tumor diagnosis
4.1 用于膜蛋白标志物的检测
细胞膜表面蛋白质被认为是肿瘤的候选生物标志物,因此灵敏而准确地对肿瘤细胞表面的膜蛋白进行定量分析,对肿瘤的发现和预测具有重要意义。Tan课题组通过cell-SELEX技术筛选出的一系列能够特异性识别肿瘤膜蛋白的核酸适配体探针可应用于多种肿瘤细胞的检测。比如,将特异性识别膜蛋白蛋白质酪氨酸激酶7(protein tyrosine kinase 7,PTK7)受体的Sgc8c适配体设计成一种可激活型的荧光分子探针,用于肿瘤细胞的特异性检测[25],遗憾的是其灵敏度未能达到肿瘤早期检测的要求。杂交链式反应(hybrid chain reaction,HCR)是一种基于DNA链取代反应的等温信号放大技术。在HCR体系中,靶分子引发两种DNA茎环交替开环,自组装得到包含大量重复单元的线性双链DNA纳米结构,具有恒温、免酶、效率高等优点。Tan课题组首次在细胞膜上利用HCR构建DNA纳米结构,并提出该结构可以用于细胞监测和细胞活性研究等[26],提供了一种可以在细胞膜上通过DNA自组装的方式进行信号放大的策略。但是,肿瘤细胞表面的膜蛋白标志物往往不是特异性只表达在肿瘤细胞上的,因此,利用单一分子标志物进行检测会导致无法准确判断出早期的疾病,而利用多种分子标志物同时多重检测能够有效地提高疾病诊断的准确性[29]。为进一步提高检测的特异性和准确性,Tan课题组利用前期cell-SELEX筛选获得的3个核酸适配体:Sgc8c、Sgc4f和TD05,设计了基于DNA的设备——纳米爪;结合DNA适配体链置换反应的特殊结构转换特性,当细胞膜表面同时存在这3种核酸适配体结合的靶标时,该纳米爪能够对多种癌细胞表面标志物进行基于自主逻辑的分析,并相应地产生诊断信号[28]。
4.2 用于肿瘤成像
肿瘤的靶向成像在肿瘤的诊断治疗过程中具有重要意义。以恶性肿瘤特异性表达的分子作为靶点,利用与其特异性识别的核酸适配体结合DNA纳米结构,可以特异性区分肿瘤组织和正常组织,这在肿瘤的早期诊断及手术精确切除中具有明显的优势。Zhu等[26]构建了基于核酸适配体的自组装荧光DNA纳米装置(self-assembled fluorescent DNA nanodevices,aptNDs),利用核酸适配体Sgc8与PTK7的特异性识别,引起aptNDs在细胞膜表面的自组装,并发生荧光能量共振转移,实现靶肿瘤细胞的原位成像。Liu等[27]构建了一种双靶向的DNA-四面体药物载体,用于乳腺癌细胞的靶向成像和靶向药物传递。可活化的黏蛋白1(mucin 1,MUC1)探针是由荧光基团标记的MUC1适配体序列与DNA四面体顶点延伸的带有淬灭基团的互补序列杂交形成。当存在MUC1阳性细胞时,MUC1适配体与细胞发生结合,引起探针的构象发生改变,释放带有淬灭基团的互补序列并导致荧光恢复,该过程不仅可对细胞膜上的MUC1蛋白进行成像分析,而且可成功地对MUC1阳性细胞和MUC1阴性细胞进行区分。
5 核酸适配体-DNA纳米结构在肿瘤治疗中的应用
目前的癌症疗法通常缺乏选择性,且吸收率低、药物排泄迅速,因此,制定可以靶向到达肿瘤细胞并减轻对正常组织不良反应的药物传递系统,一直是癌症领域的研究重点。利用核酸适配体-DNA纳米结构构建的主动靶向递送系统(表2),能够将药物精准地递送至肿瘤部位,显著增强药物治疗的效果[30~38]。
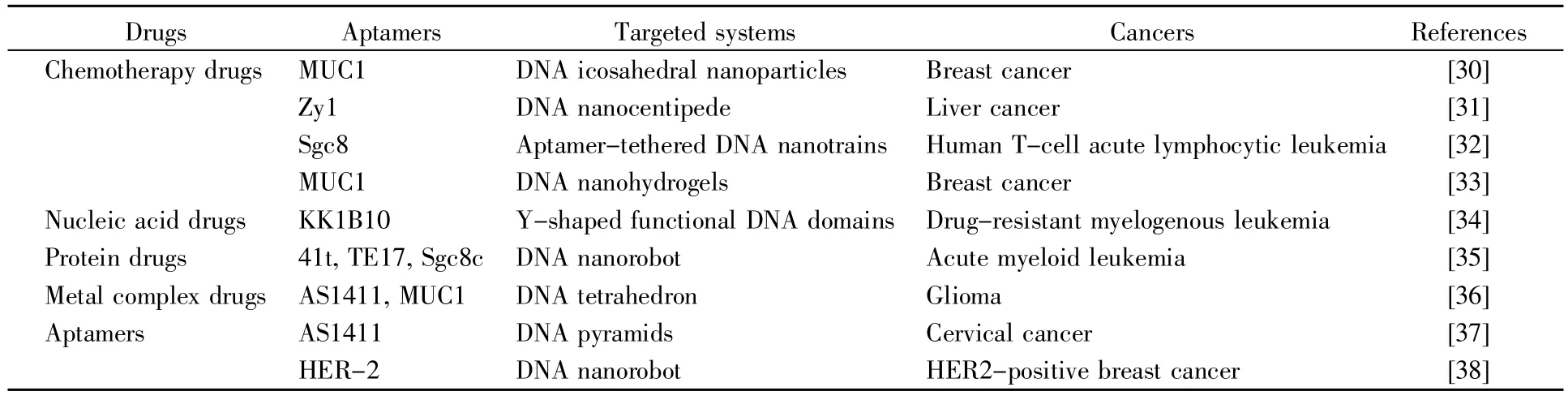
表2 核酸适配体-DNA纳米结构构建的药物靶向递送系统Table 2 Targeted drug delivery system constructed by aptamer-DNA nanostructures
5.1 用于化疗药物的运输
阿霉素(doxorubicin,Dox)是临床广泛使用的抗肿瘤药物,但Dox没有选择性,具有严重的毒副作用,这限制了其在临床上对肿瘤的疗效。Chang等[30]构建了一个核酸适配体共轭的DNA二十面体作为化疗药物Dox的纳米载药体系(aptamer-conjugated doxorubicin-intercalated DNA icosahedra,Doxo@Apt-DNA-icosa),实现了Dox药物的靶向摄入并特异性杀伤乳腺癌细胞的目的。这是最早关于核酸适配体-DNA纳米结构作为药物载体的报道之一。Li等[31]利用HCR构建了基于核酸适配体Zy1的多价DNA纳米蜈蚣结构,这个结构表现出高的载药量和药物的选择性输送;Zy1能够靶向人肝癌细胞SMMC-7721,与SMMC-7721细胞发生结合后将装载的Dox释放至细胞内发挥毒性作用,同时Zy1对人正常肝细胞L02并没有靶向和给药的作用。Zhu等[32]利用核酸适配体Sgc8构建了自组装的DNA纳米火车(aptamer-tethered DNA nanotrains,aptNTrs),aptNTrs能够将药物转运至靶细胞并诱导选择性的细胞毒性,同时可增强非靶细胞的最大耐受剂量;小鼠的体内实验证实通过aptNTrs递送的药物具有强大的抗肿瘤功效,并大大降低了毒副作用。Wei等[33]通过简单的一步法自组装方式将由pH响应的imotif序列和靶向MUC1适配体-免疫佐剂(cytosine-phosphate-guanine,CpG)融合序列(CpG-MUC1)组装成十字形DNA,并整合至DNA纳米水凝胶中,构建成一个具有靶向、免疫刺激和化疗疗法的智能DNA纳米系统;将Dox插入CpG-MUC1水凝胶的碱基对中,在酸性条件下其会分解并释放Dox和CpG。研究结果表明,该系统具有精确的靶向递送功能、强大的免疫刺激活性以及相当高的诱导细胞凋亡效率,且几乎没有副作用。
5.2 用于核酸药物的运输
为了克服多药耐药的问题,Wu等[34]将MDR-1(multidrug resistance 1)的反义核苷酸(antisense,AS)装载在KK1B10核酸适配体修饰的多功能DNA纳米组装体(aptamer-based DNA nanoassembly,Apt-NA),用于选择性杀伤耐药性骨髓性白血病细胞。研究报道,当KK1B10核酸适配体特异性识别耐药细胞系K562/D时,AptNA被选择性摄入细胞内,此时特异性抑制P-糖蛋白(P-glycoprotein,P-gp)表达的MDR-1-AS就会被释放,并通过降低细胞的耐药性发挥作用。实验结果证实AptNA对靶肿瘤细胞具有特异性的细胞毒性作用。这种多功能的、可编程的、基于核酸适配体的DNA纳米组装体是一种理想的生物医学研究工具,有望为癌症的靶向治疗提供新的思路。
5.3 用于蛋白质药物的运输
目前,疫苗、免疫球蛋白等药物在癌症的治疗中已被广泛使用,然而其静脉注射的给药方式缺乏特异性,且细胞穿透性较差,这使其药效受到影响。Douglas等[35]设计了一个利用核酸适配体的构象变化人为控制开关的DNA六面桶状纳米结构,抗体药物被装载在DNA纳米结构的桶内,只有当两个核酸适配体同时与其靶标受体相结合时,DNA六面桶状纳米结构才能被打开,内部装载的抗体药物才能被释放出来发挥作用。研究证实,该结构系统不仅提高了对靶肿瘤细胞的选择性,还成功实现了抗体药物的可控释放,有效地抑制了白血病细胞的增殖生长。这种基于DNA自组装结构构建的逻辑门控制药物释放的方法使得药物的输送和释放具有很强的可控性,显著提高了药效。
5.4 用于金属络合药物的运输
有些药物只有进入细胞核内才能发挥抗癌作用,比如部分金属络合药物,但核膜的屏障作用使得细胞质中的药物只有极少量(1%~5%)能够扩散至细胞核中发挥毒性作用[39]。为了增加进入细胞核中的药物剂量,Tian等[36]制备了一种基于双靶向DNA四面体的抗癌金属络合物载药系统Apts-DNA@Ir,将识别MUC1的核酸适配体和识别核仁素的核酸适配体AS1411分别连接在DNA的5′末端。实验结果表明,在MUC1核酸适配体的靶向识别作用下,Apts-DNA@Ir能够特异性识别胶质瘤细胞,同时在AS1411靶向识别核仁素的作用下,Apts-DNA@Ir能够逐渐进入胶质瘤细胞核内并释放抗癌金属络合物IrPP([Ir(ppy)2phen]﹢PF6),从而抑制细胞的生长和侵袭,而游离的IrPP由于细胞核的屏障作用几乎不能进入到细胞核内。该研究为更加高效精确地治疗胶质瘤提供了新的思路,同时也提示采用这种双靶向设计的DNA纳米结构能很好地解决一些药物难以扩散至细胞核的问题。
5.5 本身作为药物发挥作用
AS1411是一种靶向核仁素的DNA核酸适配体,研究表明其对人类急性骨髓性白血病和实体瘤均具有抑制肿瘤细胞增殖的作用,目前正处于Ⅱ期临床试验阶段[40]。Bermudez等[37]将AS1411适配体悬挂在DNA四面体的3个顶点构建DNA纳米结构;实验研究显示,在不使用转染试剂的情况下,与单一的AS1411适配体和DNA四面体相比,AS1411-DNA纳米结构更容易被细胞摄取并选择性抑制癌细胞的生长,而对非癌细胞的生长却几乎没有作用。此外,该研究发现AS1411-DNA纳米结构对核酸酶的降解具有更大的抵抗性,提示这种DNA自组装纳米结构在癌症治疗中具有更大的应用潜力,为输送多种生物活性分子实现协同作用提供了参考。Ma等[38]将抗人表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)适配体(anti-HER2 aptamer,HApt)连接在DNA四面体(tetrahedral framework nucleic acid,t-FNA)构建DNA纳米机器人HER2-HApt-tFNA,该HER2-HApt-tFNA可以靶向HER2阳性的乳腺癌细胞,并特异性诱导膜蛋白HER2的溶酶体降解。体内实验表明,将HER2-HApt-tFNA注射到小鼠模型中,tFNA的存在增强了HApt的稳定性并延长了其血液循环时间,提示HER2-HApttFNA可以更高效地驱动HER2溶解酶的降解,进而诱导细胞凋亡并阻止细胞生长。这种新颖的DNA纳米机器人为乳腺癌精准治疗提供了针对性靶向蛋白质降解的新思路。总的来讲,这些DNA纳米结构既具有对肿瘤细胞的靶向功能,又具有独特的细胞毒性特征,还具有能够将活化的有效载荷携带和释放到靶标的能力,为肿瘤的靶向治疗提供了新手段。
6 结语与展望
DNA纳米结构经过几十年的发展,实现了从一维、二维再到三维的组装模式,其精确的可控性、良好的生物相容性和低毒性的特点,使其在生物医学领域具有巨大的应用潜力[41]。基于核酸适配体的DNA纳米结构在核酸适配体的靶向识别基础上,可更好地发挥其生物成像、特异性检测和药物主动递送等作用,从而达到靶向综合诊疗的效果。尤其在肿瘤靶向药物输送方面,核酸适配体-DNA纳米结构实现了化疗药物、核酸药物、蛋白质药物和金属络合药物等的主动性靶向运输,既解决了抗肿瘤药物缺乏选择性的难题,也提高了药物的载量和抗肿瘤效果。因此,多功能的核酸适配体-DNA纳米结构已经成为越来越重要的分子工具。除了用作靶向肿瘤诊疗的平台之外,核酸适配体-DNA纳米结构在生物医学领域还可以拥有更为广泛的应用空间,例如生物传感、组织工程和仿生学等方面。随着针对不同分子靶标的核酸适配体的出现,更多的核酸适配体-DNA纳米结构将被设计制备出来并应用于不同的研究领域。然而,虽然DNA纳米技术发展快速,但其仍处于发展的初级阶段,依然面临诸多问题,比如更高级和有效的结构的设计、细胞的摄取和代谢效率、体内的安全性评估等。因此,该领域的发展仍需研究人员不断努力。相信在不久的将来,核酸适配体-DNA纳米结构可以真正地实现从实验室走向临床实践。