阿法替尼抗小鼠肺炎支原体感染的效果研究
2021-06-01
(1. 南华大学公共卫生学院, 湖南省衡阳市 421001;2.南华大学衡阳医学院,湖南省衡阳市421001;3.武汉轻工大学生物与制药工程学院,湖北省武汉市 430023)
肺炎支原体(mycoplasma pneumoniae,Mp)可引起儿童或青少年急性呼吸道感染,常伴间质性肺炎。少数患者因Mp过度免疫应答引发严重肺损伤,如肺脓肿、坏死性肺炎、急性呼吸窘迫综合征等,严重者可危及生命[1-2]。此外,慢性持续性Mp感染可诱发哮喘[3-4],脑膜脑炎[5]等并发症,其诱发机制尚在研究中[6]。近年来,儿童难治性支原体肺炎(持续性Mp感染)病例日趋增多,且死亡病例逐年增加[7]。在中国约超过70% Mp临床分离株对大环内酯类抗生素耐药[8],加大了Mp感染患者的治疗难度[9]。因此,研究新型抗Mp感染的有效药物具有重要意义。
临床应用的阿法替尼(Afatinib,BIBW-2992,2013年上市)属于不可逆ErbB家族阻滞剂[10],是一种酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI),可靶向抑制肺癌、胰腺癌、结肠直肠癌、头颈部鳞状细胞癌等肿瘤的发展[11]。此外,阿法替尼与DMSO联用可有效杀灭革兰阴性菌如大肠杆菌,并可对细菌胞外聚合物基质进行化学修饰,从而显著降低其生物膜的形成[12]。本研究拟通过体内外实验评价阿法替尼抗Mp感染的效果。
1 材料和方法
1.1 实验试剂
肺炎支原体Ⅰ型标准株M129(ATCC29342)由昆明医科大学馈赠;阿法替尼(Afatinib,CAS 850140-72-6)(图1)由武汉轻工大学生物与制药工程学院提供,纯度≥98.0%;活性氧(reactive oxygen species,ROS)检测试剂盒购自上海翊圣生物科技有限公司;细胞因子ELISA试剂盒购自上海恒远生物科技有限公司。
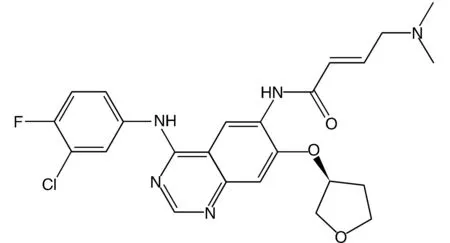
图1 阿法替尼化学结构式(C24H25ClFN5O3)
1.2 Mp培养
将Mp M129株接种到PPLO液体培养基中,置于37 ℃(5%CO2,95%N2)培养3~5天,10 000 ×g 4 ℃离心20 min,PBS重悬菌体沉淀,取100 μL菌液涂布于PPLO固体培养基,37 ℃厌氧(5%CO2,95%N2)培养7天,显微计数并计算Mp数量。将Mp菌悬液分别调至5.0×108CFU/L与3.5×1011CFU/L,备用。
1.3 阿法替尼药物溶解及溶剂对照的准备
称取50 mg阿法替尼溶于45 mL无菌去离子水中,以500 μL的1 kg/L柠檬酸溶液助溶,调pH至6.5后定容50 mL,制成1 g/L的阿法替尼溶液,0.22 μm滤器除菌备用。依照上述方法,不含阿法替尼的柠檬酸溶液作为溶剂对照组。
1.4 阿法替尼体外抗Mp最小抑菌质量浓度和颜色变化单位的测定
取28支预先加入1.8 mL PPLO液体培养基的试管,每组7支试管,将其分为PBS组、Mp组、Afatinib组和溶剂对照组。PBS组预先加入1.8 mL PPLO液体培养基;Mp组于该组第一支试管中加入0.2 mL的5.0×108CFU/L Mp菌液,吸吹混匀后,吸出0.2 mL加入第二管,依次类推10倍梯度稀释至第七支试管(104~1010CCU/L的Mp菌液),吸吹混匀后弃去0.2 mL,最后在每支试管中均加入0.2 mL灭菌PBS;Afatinib组方法同Mp组,最后在每支试管中均加入0.2 mL Afatinib溶液;溶剂对照组方法同Mp组,最后在每支试管中均加入0.2 mL溶剂对照溶液。观察培养7天和14天后PPLO培养基颜色变化情况。
微量肉汤稀释法[13]测定阿法替尼抗肺炎支原体的最小抑菌质量浓度(minimal inhibitory concentration,MIC),连续观察7天,以培养基颜色不变的最高稀释度质量浓度为MIC,平行测定3次。
1.5 肺炎支原体感染小鼠模型的建立和分组
本研究经南华大学实验动物福利伦理审查委员会批准。将32只SPF级6周龄雌性BALB/c小鼠随机分为空白组和模型组两组,每组16只。温度24 ℃、湿度45%、循环光照(明暗各12 h)环境饲养,自由摄食饮水,适应环境1周。向空白组小鼠鼻内滴入30 μL PBS,向模型组小鼠鼻内滴入等量的3.5×1011CFU/L Mp悬液构建Mp感染模型(Mp数量约1.0×107个)。随后将空白组小鼠分为正常组和药物对照组,每组8只。将模型组分为Mp组与Afatinib组,每组8只。正常组与Mp组于次日用PBS溶液雾化处理,Afatini组和药物对照组则用1 g/L阿法替尼雾化给药。雾化条件为0.2 mL/min,15 mim/次,2次/天,共2天。
1.6 肺组织中Mp活菌计数
于Mp感染后第3天,取100 μL小鼠肺匀浆上清涂布于PPLO固体培养基,37 ℃厌氧(5%CO2,95%N2)培养7天,显微计数并计算Mp数量。
1.7 血细胞计数及炎症指数计算
内眦静脉采集Mp感染后第3天的小鼠血液标本,抗凝管低温保存,全血细胞分析仪检测白细胞总数(white blood cells,WBC)、中性粒细胞数(neutrophile granulocyte,NEUT)、淋巴细胞数(lymphocyte,LYMPH)、单核细胞数(mononuclear leucocyte,MONO),分析中性粒细胞数/淋巴细胞数(NLR)和单核细胞数/淋巴细胞数(MLR)。NLR和MLR升高,对CAP具有高诊断价值,且与CAP严重程度有显著相关性[14]。
1.8 HE病理切片
取福尔马林固定后的Mp感染第3天小鼠肺组织,石蜡包埋,切成<5 μm薄片,苏木精伊红染色,观察肺组织切片炎性细胞浸润情况。
1.9 细胞内活性氧水平的检测
取Mp感染第3天小鼠1 mL肺组织匀浆分离细胞,参照ROS检测试剂盒方法测定细胞的ROS水平。以荧光强度作为ROS水平高低评价标准。
1.10 炎症因子的测定
肺匀浆上清炎性细胞肿瘤坏死因子(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)及白细胞介素-6(interleukin-6,IL-6)的测定参照ELISA试剂盒说明书进行测定并计算各组细胞因子质量浓度。
1.11 数据处理
2 结 果
2.1 体外颜色变化单位与最小抑菌质量浓度结果
阿法替尼体外抗Mp结果显示Afatinib及PBS组培养14天后仍无颜色变化,而Mp组与溶剂对照组培养7天颜色变化单位为107CCU/L,培养14天为1010CCU/L。通过微量肉汤稀释法测定阿法替尼抗肺炎支原体的MIC为16 mg/L。
2.2 各组小鼠肺组织中Mp活菌计数比较
正常组及药物对照组无Mp菌落,Afatinib组Mp数量较Mp组明显降低(P<0.05;图2)。
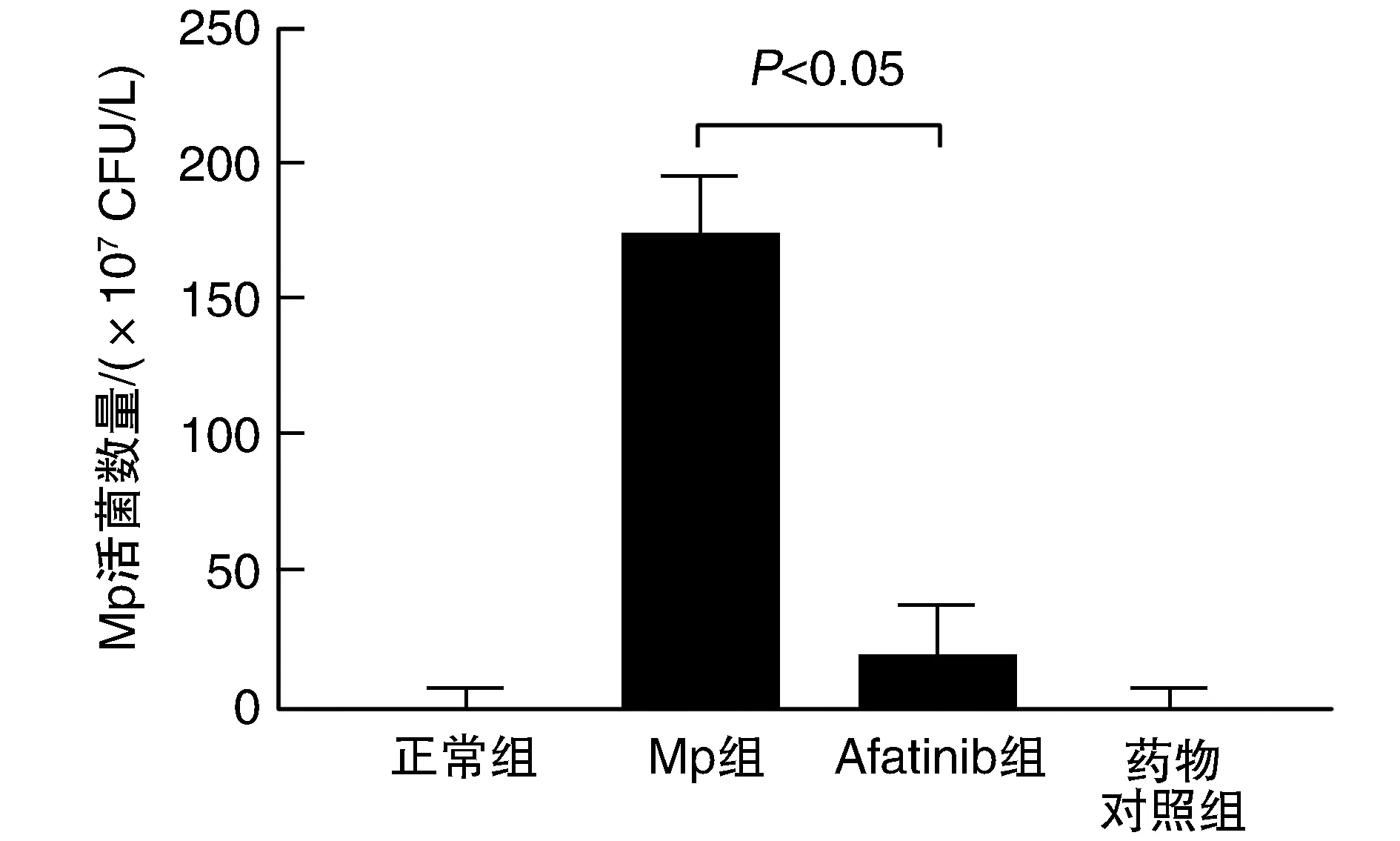
图2 各组小鼠肺组织中Mp活菌计数的比较
2.3 各组小鼠血细胞计数及炎症指数比较
小鼠血液中血细胞计数结果显示,Mp组的白细胞总数及中性粒细胞数均高于Afatinib组(P<0.05;表1),药物对照组白细胞总数低于正常组。炎症相关指数结果显示Afatinib组NLR、MLR低于Mp组(P<0.05;表2)。
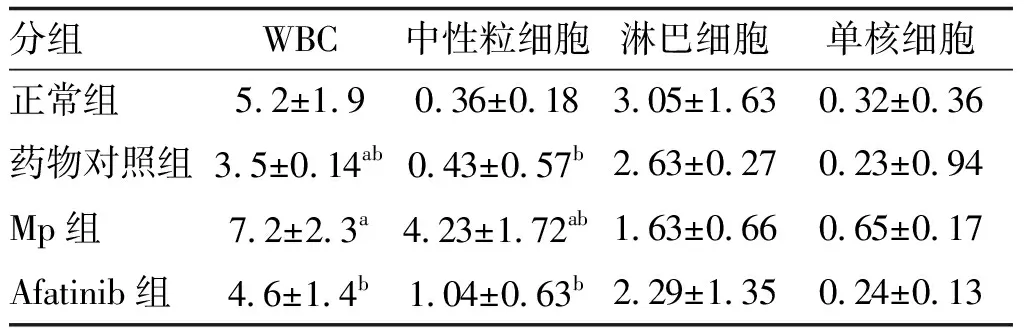
表1 各组小鼠血细胞计数比较 单位:×109个/L

表2 各组小鼠炎症指数比较
2.4 各组小鼠肺组织病理变化
正常组小鼠肺组织形态结构清晰,肺泡较完整,未见水肿及炎症细胞浸润等。Mp组可见严重的炎症反应,肺泡间隔增厚,且血管及支气管周围炎症细胞浸润。Afatinib组肺泡间隔宽度、血管及支气管周围水肿程度及炎症较Mp组明显下降,药物对照组肺组织可见轻微炎症(图3)。
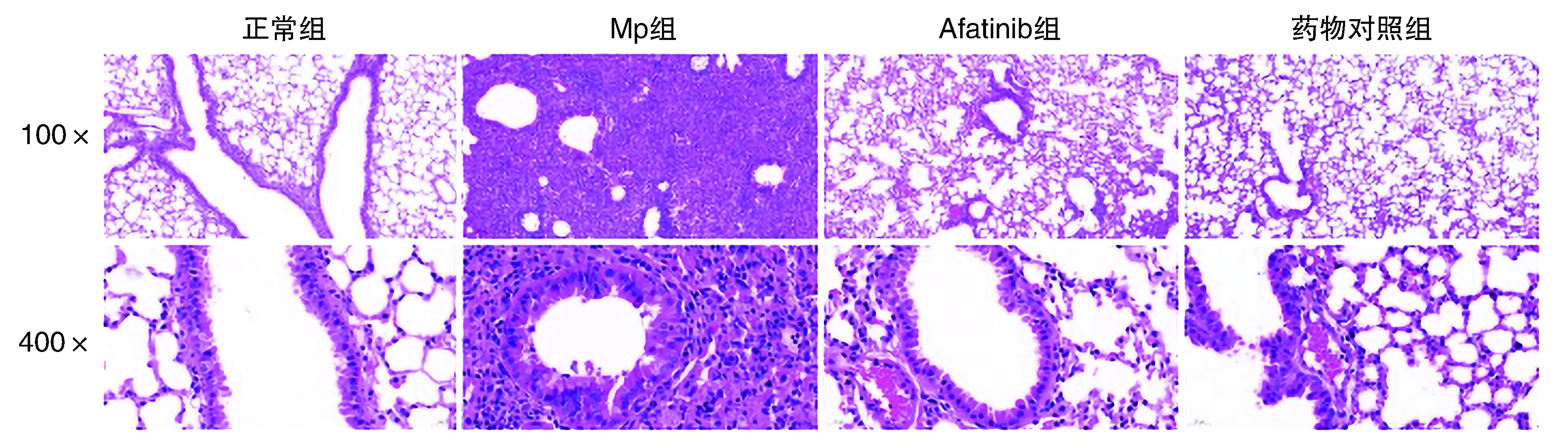
图3 各组小鼠肺组织切片HE染色的比较
2.5 各组小鼠肺组织细胞胞内ROS水平变化
DCFH-DA荧光探针法测定Afatinib组ROS水平较Mp组降低(P<0.05;图4)。
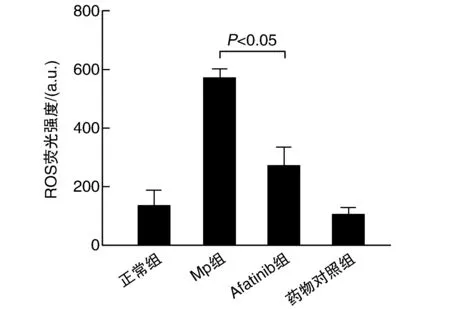
图4 各组小鼠肺组织胞内ROS水平的比较
2.6 各组小鼠炎症因子含量的变化
Afatinib组的TNF-α含量较Mp组降低(P<0.05),而IL-1β及IL-6含量差异无显著性(图5)。
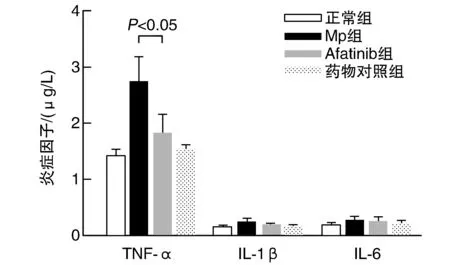
图5 各组小鼠肺匀浆中细胞因子含量的比较
3 讨 论
Mp是引起社区获得性肺炎的主要病原体之一,随着Mp对大环内酯类抗生素耐药率的日趋增加使其感染的临床治疗难度加大[15],同时耐大环内酯类Mp感染引起的肺外并发症发生率增高[16],且耐大环内酯类Mp引起的难治性肺炎死亡率逐年增高。目前尚无可用疫苗。因此,抗Mp感染的药物研究具有重要意义。
阿法替尼是临床上的一种抗肿瘤药物,但其抗菌抗感染研究非常少。文献[12]报道阿法替尼与DMSO联用可有效杀灭铜绿假单胞菌及鼠伤寒杆菌,而其抗菌机制需要进一步的研究。TKI依鲁替尼可通过抑制病原菌侵入胞内并降低细菌在胞内的增殖能力,从而增加宿主细胞的存活率[17],依鲁替尼还能使结核分枝杆菌难以在病变部位M1型巨噬细胞中寄居,从而使感染部位难以形成稳定的肉芽肿结构[18],推测TKI的杀菌作用可能与其抑制酪氨酸激酶有关,使细菌代谢异常,进而抑制细菌的增殖。据文献报道[19],Mp糖脂与动物组织化合物具有同源性,是引起宿主细胞自身免疫疾病重要原因,而布鲁顿酪氨酸激酶(bruton tyrosine kinase,Btk)缺陷小鼠对Mp糖脂类抗原无免疫反应。基于上述研究,本文探究了酪氨酸激酶抑制剂阿法替尼对Mp的抑制作用及抗感染效果。
本文通过颜色变化单位及最小抑菌质量浓度实验评价阿法替尼体外抑菌效果,构建小鼠Mp感染模型,检测小鼠肺组织匀浆中Mp活菌数量,表明阿法替尼亦具有体内抑制Mp增殖的效果。阿法替尼的体内外抗菌、抗感染机制尚待研究。本研究通过血液学常数、炎症指标、肺组织病理切片评价阿法替尼体内抗炎效果,结果显示,阿法替尼治疗后使外周血中WBC及其炎症指标NLR、MLR降低,且肺部病理切片可见炎症明显减轻。NLR[20]、MLR[14]可间接反映Mp感染导致的间质性肺炎的感染程度;HE病理切片反映了肺部炎细胞浸润及肺组织病变程度,表明阿法替尼可有效抑制肺炎支原体感染后引起的炎症反应。
ROS是包括超氧阴离子、过氧化物和自由基等的活性含氧分子,机体代谢异常时其含量升高,损伤细胞。据文献[21]报道,Mp感染可引起肺组织细胞中ROS水平升高,导致大量肺上皮细胞发生凋亡,进而引起肺组织炎性损伤。Mp自身具有特殊的ROS耐受机制,因此ROS对Mp影响较小[22]。本研究对阿法替尼抑炎作用机制进行了初步探索,结果显示其氧化介质ROS显著降低。阿法替尼可通过降低肺组织中ROS水平而抑制ROS介导的炎症反应,可能是其抗炎机制之一。阿法替尼可有效降低炎症因子TNF-α水平,炎症因子TNF-α含量对炎症及其后续抗炎机制的研究有重要意义,与Al-Harbi NO等[23]的研究结果类似,该研究表明TKI依鲁替尼可通过降低SOD氧化应激及炎症因子TNF-α减轻小鼠银屑病样炎症,此外,TKI也可作用于酪氨酸激酶介导的炎症通路[24],如MAPK、PI3K和JAK-STAT等,从而调节炎症因子水平。由此可见,在未来实践中,可基于以上炎症通路,对阿法替尼的抗炎机制做进一步深入研究。
本研究发现阿法替尼能有效减轻Mp感染引起的炎症,但药物对照组的小鼠肺部有少许炎症细胞,本文研究与文献报道一致,TKI可抑制酪氨酸激酶作用的哮喘气道炎症[25],但缺乏酪氨酸激酶会激活NLRP3炎症小体[26],酪氨酸激酶在维持机体稳态有重要意义。因此,阿法替尼及其他TKI作为抗感染药物需慎重考虑使用剂量及使用条件。
综上所述,本研究基于体内外实验证明了阿法替尼具有抗Mp感染的效果,但其剂量与治疗效果、安全性仍需进一步研究,其抑制Mp增殖及其抗炎机制亦需深入研究。
