阿法替尼对人乳腺癌细胞增殖与凋亡的影响及机制研究*
2017-09-04赵颖迟江瑞赵洪猛张斌余岳曹旭晨
赵颖 迟江瑞 赵洪猛 张斌 余岳 曹旭晨
·基础研究·
阿法替尼对人乳腺癌细胞增殖与凋亡的影响及机制研究*
赵颖 迟江瑞 赵洪猛 张斌 余岳 曹旭晨
目的:探讨酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)阿法替尼(afatinib)对乳腺癌细胞增殖、周期及凋亡的影响,并就阿法替尼与吉非替尼(gefitinib)对乳腺癌细胞的作用进行比较。方法:应用MTT法检测人乳腺癌细胞系MCF-7、T47D、MDAMB-231细胞活性,流式细胞术的PI染色法检测细胞周期变化以及Annexin-V/PI双染法检测细胞凋亡,通过Western blot法检测蛋白表达情况。结果:阿法替尼对MCF-7、T47D、MDA-MB-231细胞均有明显的抑制作用,IC50分别为0.101、0.141、0.887 μmol/L。阿法替尼对T47D、MDA-MB-231细胞作用24 h后G0/G1期细胞比例明显升高,细胞凋亡率增加,晚期的凋亡率分别为88.9%、58.1%,并可促进细胞凋亡通路蛋白PARP、caspase-3发生剪切。阿法替尼、吉非替尼使MDA-MB-231细胞的EGFR磷酸化水平受到明显抑制,相同浓度下,阿法替尼作用较吉非替尼更强、持续时间更长。结论:阿法替尼可显著抑制乳腺癌细胞增殖、促进其凋亡,且具有明显的量效关系,较吉非替尼具有更有效的作用。
乳腺癌 阿法替尼 细胞周期 细胞凋亡
阿法替尼(afatinib)为EGFR、HER-2的非可逆双靶点酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI),可与EGFR的Cys773位点及HER-2的Cys805位点结合。阿法替尼已于2013年通过美国食品药品监督管理局(FDA)批准用于治疗EGFR突变阳性非小细胞肺癌,而对乳腺癌作用的研究较少。本研究旨在研究阿法替尼对乳腺癌细胞的作用,并与单靶点EGFR可逆性TKI吉非替尼(gefitinib)进行比较。
1 材料与方法
1.1 材料
阿法替尼、吉非替尼购自美国Selleck Chemicals公司;RPMI 1640、DMEM基础培养液购自美国Gibco公司;胎牛血清购自美国Hyclone公司;Annexin V/PI试剂盒购自美国BD Pharmingen公司;EGFR、磷酸化EGFR、多聚ADP核糖聚合酶(poly ADP-ribose polymerase,PARP)、caspase-3抗体均购自美国Cell Signaling公司。人乳腺癌细胞系MCF-7、T47D、MDA-MB-231由天津市肿瘤研究所提供。
1.2 方法
1.2.1 细胞培养MCF-7、T47D细胞由含10%胎牛血清、100 μg/mL青霉素和0.1 mg/mL链霉素的RPMI 1640培养液培养,MDA-MB-231细胞由含10%胎牛血清、100 μg/mL青霉素和0.1 mg/mL链霉素的DMEM基础培养液培养。细胞均置于37℃、5%CO2的细胞培养箱培养。1.2.2MTT法检测取对数生长期的细胞进行细胞活性检测,调整细胞密度为5×104/mL,接种于96孔细胞培养板中,待细胞贴壁后,将不同抑制剂按照不同浓度梯度加入96孔细胞培养板(200 μL/孔),以含等体积浓度DMSO的细胞培养液作为对照。每组设3个复孔。不同抑制剂作用24 h后,每孔加入MTT(5 mg/mL)20 μL,孵育4 h,离心弃上清。每孔加入DMSO 200 μL,震荡10 min。酶联免疫检测仪检测570 nm波长各孔的吸光度(OD)值。参照文献[1],计算不同抑制剂对细胞的抑制率,采用Excel绘制抑制率曲线分别计算半数抑制浓度(IC50)值。细胞的抑制率=(D对照组-D实验组)/D对照组×100%。
1.2.3 流式细胞术检测取对数生长期的细胞进行细胞周期检测,调整细胞密度为1×106/mL,接种于6孔细胞培养板。细胞贴壁后,将不同抑制剂按照不同浓度梯度加入6孔细胞培养板,以含等体积浓度DMSO的细胞培养液作为对照。不同抑制剂作用24 h后收集细胞,使用4℃预冷PBS缓冲液洗涤2次,离心弃上清。加入冰预冷的70%乙醇4℃固定2 h。离心弃上清,PBS缓冲液洗涤1次,离心弃上清,加入1 mL PI染液避光孵育10 min,于流式细胞仪进行细胞周期检测。取细胞重悬于结合缓冲液。各组分别取100 μL细胞悬液至5 mL测试管中,分别加入5 μL的Annex⁃in-V标记液和5 μL的PI,避光室温孵育15 min,加入500 μL结合缓冲液,4℃静置30 min,于流式细胞仪进行细胞凋亡测定。
1.2.4 Western blot法细胞处理后,使用4℃预冷的PBS缓冲液洗涤3次,弃上清,加入细胞裂解液,冰上静置30 min,收集细胞裂解液,4℃下12 000 r/min离心5 min后收集上清,95℃加热15 min。利用分光光度计测定蛋白浓度,加入相应体积加样缓冲液,95℃加热10 min。每组取40 μg蛋白于10%SDS-PAGE中进行蛋白电泳,电泳后转移至硝酸纤维素膜上,5%脱脂牛奶室温孵育1 h,将硝酸纤维素膜置于一抗稀释液中4℃孵育过夜。用含0.1%Tween20的PBS缓冲液洗涤3次,置于二抗稀释液中室温孵育1 h,再次使用含0.1%Tween20的PBS缓冲液洗涤3次。加入化学底物发光液,暗室曝光、显影、定影。
1.3 统计学分析
2 结果
2.1 乳腺癌细胞系EGFR、HER-2表达
通过Western blot法检测MDA-MB-231、MCF-7、T47D细胞中EGFR、HER-2表达情况,结果提示MDAMB-231、T47D细胞中EGFR阳性、HER-2阴性,而MCF-7细胞中EGFR弱阳性、HER-2阳性(图1)。
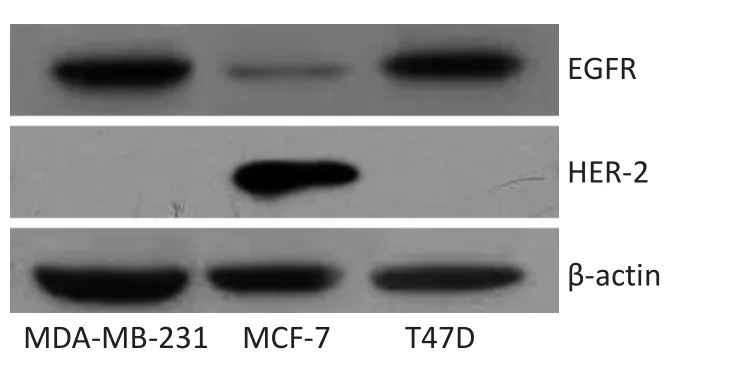
图1 MDA-MB-231、MCF-7、T47D细胞EGFR、HER-2表达情况Figure 1Expression levels of EGFR and HER-2 in MDA-MB-231,MCF-7,and T47D cell lines
2.2 阿法替尼、吉非替尼对乳腺癌细胞增殖的影响
MTT法检测结果显示,在MDA-MB-231、MCF-7、T47D三种乳腺癌细胞系中,MCF-7、T47D细胞对阿法替尼的抑制作用最为敏感,IC50分别为0.101、0.141 μmol/L,MDA-MB-231细胞的增殖也可明显被阿法替尼抑制(IC50=0.887 μmol/L)。与阿法替尼相比,三种乳腺癌细胞系对吉非替尼的敏感性均较差,T47D、MDA-MB-231细胞IC50分别为10.375、19.340 μmol/L,均表现出良好的量效关系,而MCF-7细胞对吉非替尼耐药,IC50>20μmol/L(图2)。
2.3 阿法替尼、吉非替尼对乳腺癌细胞周期的影响
通过流式细胞术测定阿法替尼、吉非替尼对T47D、MDA-MB-231细胞周期的影响。结果表明阿法替尼、吉非替尼作用T47D、MDA-MB-231细胞后,G0/G1期细胞比例明显升高,S期及G2期细胞明显减少,阿法替尼较吉非替尼的抑制作用明显增强(图3)。
2.4 阿法替尼、吉非替尼对MDA-MB-231细胞凋亡的影响
流式细胞术Annexin-V/PI双染法检测阿法替尼、吉非替尼对T47D、MDA-MB-231细胞凋亡的影响。结果表明1 μmol/L吉非替尼作用T47D、MDA-MB-231细胞后,早期的凋亡率分别为54.6%、60.4%,晚期的凋亡率分别为21.4%、12.4%;1 μmol/L阿法替尼作用T47D、MDA-MB-231细胞后,早期的凋亡率分别为6.0%、24.3%,晚期的凋亡率分别为88.9%、58.1%(图4)。

图2 不同浓度阿法替尼、吉非替尼对乳腺癌细胞系抑制率曲线Figure 2Inhibition ratio curves of breast cancer cell lines under afatinib and gefitinib at different concentrations
2.5 阿法替尼、吉非替尼对EGFR磷酸化水平及凋亡通路的影响
通过Westren blot法检测阿法替尼、吉非替尼对MDA-MB-231细胞的EGFR磷酸化水平的影响及持续效果显示,10 μmol/L的阿法替尼、吉非替尼对MDA-MB-231细胞作用3 h后,经100 nmol/L表皮生长因子(epidermal growth factor,EGF)刺激10 min,EGFR磷酸化水平受到明显抑制。洗脱后6 h,经100 nmol/L EGF刺激10 min,阿法替尼处理组的EG⁃FR磷酸化水平仍受到明显抑制,而吉非替尼处理组的EGFR磷酸化水平明显升高(图5A)。Western blot法检测阿法替尼、吉非替尼对T47D、MDA-MB-231细胞凋亡通路蛋白PARP、Caspase-3的影响结果表明,1 μmol/L的阿法替尼、吉非替尼均可促进细胞凋亡通路蛋白PARP、Caspase-3发生剪切,而相同浓度的阿法替尼较吉非替尼作用更强(图5B)。
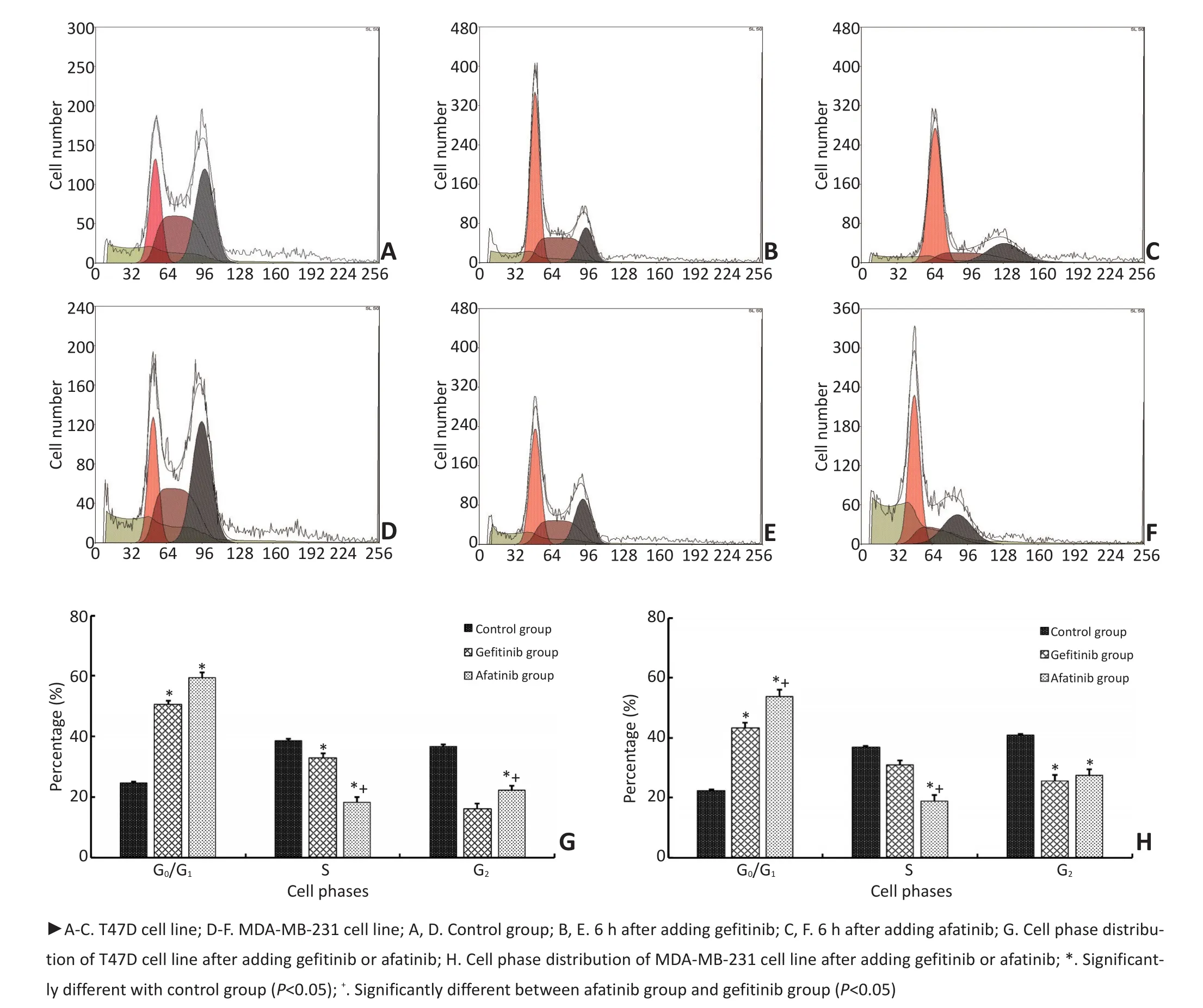
图3 阿法替尼、吉非替尼对乳腺癌细胞周期的影响Figure 3Effect of afatinib and gefitinib on breast cancer cell cycles
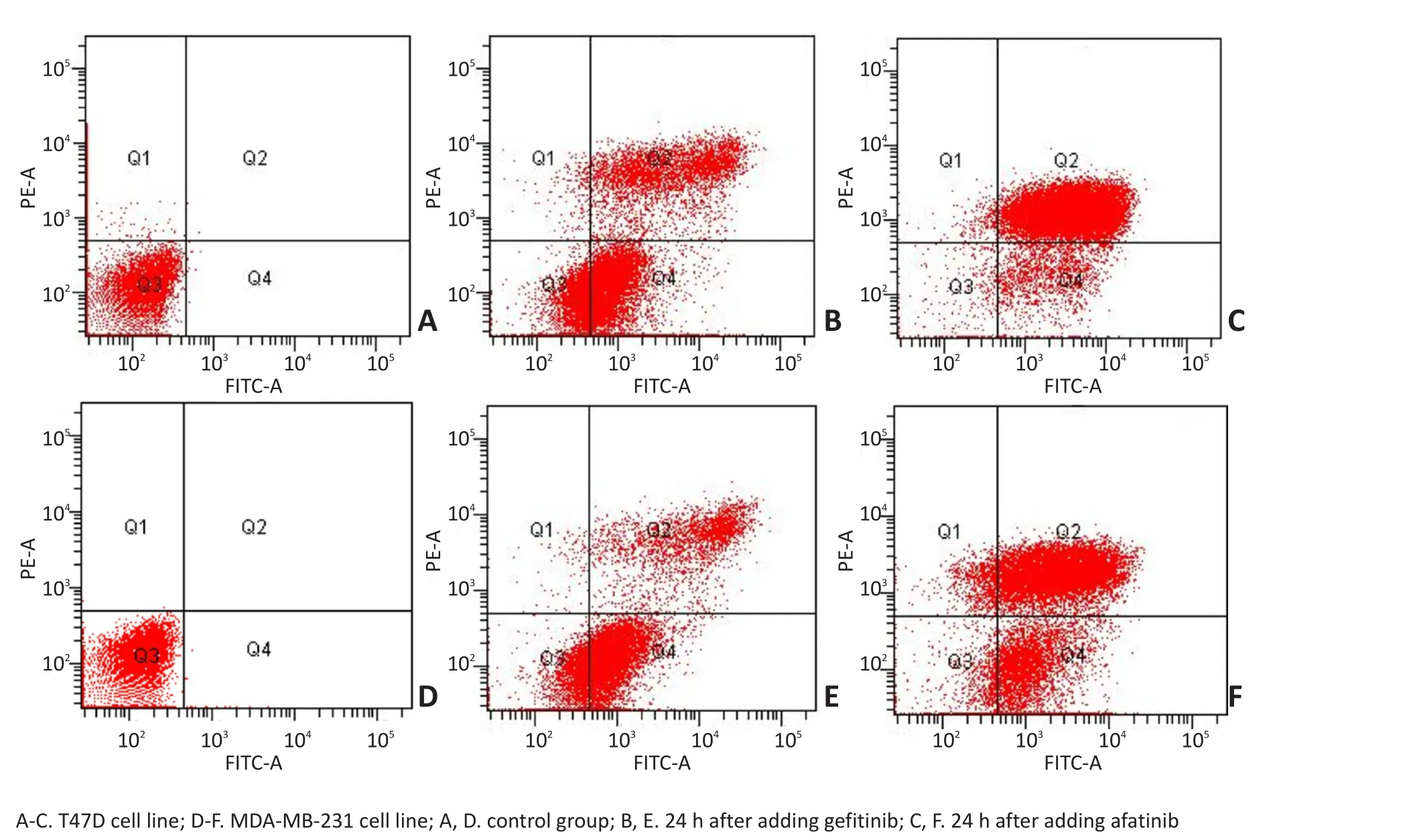
图4 阿法替尼、吉非替尼对乳腺癌细胞凋亡的影响Figure 4Effect of afatinib and gefitinib on breast cancer cell apoptosis

图5 阿法替尼、吉非替尼对EGFR磷酸化水平及凋亡通路的影响Figure 5Effect of afatinib and gefitinib on phosphorylation of EGFR and apoptosis signal pathway
3 讨论
目前,曲妥珠单抗靶向治疗已成为HER-2阳性乳腺癌的标准治疗[2]。但对于HER-2阴性乳腺癌,尤其是三阴性乳腺癌,尚未发现明确有效的治疗靶点[3]。尽管HER-2阳性及Luminal型乳腺癌对于曲妥珠单抗及内分泌治疗具有较好的疗效,但耐药仍是其治疗的棘手问题[4]。因此,寻找有效的靶点及新的靶向治疗药物成为乳腺癌研究的热点。在肺癌、头颈部肿瘤及胶质母细胞瘤等肿瘤中,EGFR的作用受到广泛关注[5],乳腺癌中14%~91%为EGFR高表达[6],而EGFR高表达与肿瘤的进展及预后密切相关[7]。尤其是在复发转移常见、预后最差的三阴性乳腺癌中,50%以上患者的EGFR表达呈阳性[8]。因此,针对EGFR的靶向治疗可能为乳腺癌治疗带来新的希望。吉非替尼是一种EGFR酪氨酸激酶小分子抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitor,EGFR-TKI),可通过竞争性结合ATP抑制EGFR胞内酪氨酸激酶结构域的自身磷酸化,从而阻断下游信号的传递。在肺癌治疗中吉非替尼已得到广泛的应用,并取得了一定的疗效[9]。对经其他治疗的转移性乳腺癌患者,吉非替尼的Ⅱ期临床试验的早期结果未显示有效性,尤其是对曾行化疗的患者[10]。因此,在乳腺癌中对吉非替尼的原发性耐药可能普遍存在。阿法替尼是第二代高效双重非可逆性的TKI,可与EGFR的Cys773位点及HER-2的Cys805位点进行不可逆结合,从而阻断下游信号转导[11]。目前,阿法替尼已用于非小细胞肺癌治疗,但在乳腺癌治疗中的应用仍在研究之中。
本研究通过MTT法检测表明,阿法替尼可显著抑制乳腺癌细胞的活性,且具有明显的量效关系。通过流式细胞术检测细胞周期发现,阿法替尼可抑制乳腺癌细胞于G0/G1期,从而阻断乳腺癌细胞的增殖。Schütze等[12]研究了阿法替尼对人鳞状细胞癌的作用发现,阿法替尼同样可阻滞癌细胞于G0/G1期,并且有一定的放疗增敏作用。阿法替尼可通过不可逆结合EGFR及HER-2受体,抑制其磷酸化,而PI3K/Akt是生长因子受体重要的下游信号分子,可促进细胞周期的进程。因此,阿法替尼主要通过抑制EGFR/PI3K/Akt通路信号转导进而发挥抑制癌细胞增殖的作用[13]。caspase-3是细胞凋亡信号通路中重要的凋亡执行分子,PARP是一种DNA修复酶,可被cas⁃pase-3剪切而失活,为caspase-3激活的重要指标。本研究进一步通过Annexin-V/PI双染法发现,阿法替尼阻断乳腺癌细胞增殖后诱导细胞凋亡,阿法替尼促进乳腺癌细胞caspase-3及PARP的剪切。因此,阿法替尼可通过caspase途径促进细胞凋亡。
阿法替尼的药物作用较吉非替尼有以下优势:1)作用癌细胞广泛:因阿法替尼是一种多靶点抑制剂,因此可针对多种乳腺癌细胞类型;2)作用相应更强:相较于吉非替尼,阿法替尼IC50更低,相同浓度下其对癌细胞抑制作用更显著;3)作用时间更久:因阿法替尼是一种不可逆的抑制剂,其信号阻断时间更长,经洗脱后仍可抑制EGFR的磷酸化。Ninomiya等[14]利用小鼠肺癌模型,比较阿法替尼与吉非替尼的药物作用,研究结果发现阿法替尼可显著延长小鼠的存活时间,验证了阿法替尼较吉非替尼的治疗优势。
综上所述,阿法替尼可抑制乳腺癌细胞增殖,促进其凋亡,相较吉非替尼具有更有效的作用。因此,阿法替尼对于乳腺癌治疗可能具有较好的前景,但需要进一步的临床试验验证。
[1]Jiang H,Zhao PJ,Su D,et al.Paris saponinⅠinduces apoptosis via increasing the Bax/Bcl-2 ratio and caspase-3 expression in gefitinibresistant non-small cell lung cancer in vitro and in vivo[J].Mol Med Rep,2014,9(6):2265-2272.
[2]Saxena R,Dwivedi A.ErbB family receptor inhibitors as therapeutic agents in breast cancer:current status and future clinical perspective[J].Med Res Rev,2012,32(1):166-215.
[3]Dawood S.Triple-negative breast cancer:epidemiology and management options[J].Drugs,2010,70(17):2247-2258.
[4]Shojaei S,Gardaneh M,Rahimi Shamabadi A.Target points in trastuzumab resistance[J].Int J Breast Cancer,2012,(2012):761917.
[5]Penne K,Bohlin C,Schneider S,et al.Gefitinib(Iressa,ZD1839)and tyrosine kinase inhibitors:the wave of the future in cancer therapy[J].Cancer Nurs,2005,28(6):481-486.
[6]Perez EA,Spano JP.Current and emerging targeted therapies for metastatic breast cancer[J].Cancer,2012,118(12):3014-3025.
[7]Lurje G,Lenz HJ.EGFR signaling and drug discovery[J].Oncology,2009,77(6):400-410.
[8]Foulkes WD,Smith IE,Reis-Filho JS.Triple-negative breast cancer[J].N Engl J Med,2010,363(20):1938-1948.
[9]Lee CK,Davies L,Wu YL,et al.Gefitinib or erlotinib vs chemotherapy for EGFR mutation-positive lung cancer:individual patient data meta-analysis of overall survival[J].J Natl Cancer Inst,2017,109(6):1-9.
[10]Agrawal A,Gutteridge E,Gee JM,et al.Overview of tyrosine kinase inhibitors in clinical breast cancer[J].Endocr Relat Cancer,2005,12(Suppl 1):S135-144.
[11]Minkovsky N,Berezov A.BIBW-2992,a dual receptor tyrosine kinase inhibitor for the treatment of solid tumors[J].Curr Opin Investig Drugs,2008,9(12):1336-1346.
[12]Schütze C,Dörfler A,Eicheler W,et al.Combination of EGFR/HER-2 tyrosine kinase inhibition by BIBW 2992 and BIBW 2669 with irradiation in FaDu human squamous cell carcinoma[J].Strahlenther Onkol,2007,183(5):256-264.
[13]Chao TT,Wang CY,Chen YL,et al.Afatinib induces apoptosis in NSCLC without EGFR mutation through Elk-1-mediated suppression of CIP2A[J].Oncotarget,2015,6(4):2164-2179.
[14]Ninomiya T,Takigawa N,Ichihara E,et al.Afatinib prolongs survival compared with gefitinib in an epidermal growth factor receptordriven lung cancer model[J].Mol Cancer Ther,2013,12(5):589-597.
(2017-04-11收稿)
(2017-07-05修稿)
Effect of afatinib on the proliferation and apoptosis of human breast cell lines and its mechanisms
Ying ZHAO,Jiangrui CHI,Hongmeng ZHAO,Bin ZHANG,Yue YU,Xuchen CAO
Xuchen CAO;E-mail:cxc2017@126.com
The First Department of Breast Cancer,Tianjin Medical University Cancer Institute and Hospital;National Clinical Research Center for Cancer;Tianjin Key Laboratory of Cancer Prevention and Therapy,Tianjin's Clinical Research Center for Cancer,Tianjin 300060,China This study was supported by the National Natural Science Foundation of China(No.81372843)
Objective:To investigate the effect of afatinib,a tyrosine kinase inhibitor,on the proliferation,cell cycle,and apoptosis of human breast cell lines,and compare its effects with those of gefitinib.Methods:Three human breast cell lines,MCF-7,T47D,and MDA-MB-231,were cultured as cell models.A methyl thiazolyl tetrazolium assay was utilized to measure cell viability.Flow cytometer was used to analyze the cell cycle arrest(PI staining)and apoptosis rates(Annexin-V/PI staining).The protein expression was detected by Western blot analysis.Results:The proliferation of three human breast cell lines was significantly inhibited by afatinib,and the IC50levels of MCF-7,T47D,and MDA-MB-231 were 0.101,0.141,and 0.887 μmol/L,respectively.The G0/G1phase cell ratio increased considerably 24 h after afatinib was added to T47D or MDA-MB-231.The cell apoptosis rate also increased in the two cell lines(88.9%and 58.1%).The cleavage of apoptosis pathway proteins PARP and caspase-3 was also promoted by afatinib.Phosphorylation of EGFR was significantly inhibited by afatinib in the MDA-MB-231 cell line.Finally,the inhibition effect of afatinib was stronger than that of gefitinib.Conclusion:Afatinib could significantly inhibit the proliferation of breast cancer cells and promote apoptosis.The effect was dose-dependent.Afatinib was a more effective tyrosine kinase inhibitor as compared with gefitinib.
breast neoplasm,afatinib,cell cycle,apoptosis

10.3969/j.issn.1000-8179.2017.15.422
天津医科大学肿瘤医院乳腺一科,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室,天津市恶性肿瘤临床医学研究中心,乳腺癌防治教育部重点实验室(天津市300060)
*本文课题受国家自然科学基金面上项目(编号:81372843)资助
曹旭晨cxc2017@126.com
赵颖专业方向为乳腺肿瘤临床治疗及肿瘤信号转导通路机制等基础研究。
E-mail:zhaoyingtjmu@126.com
