梅毒血清固定患者外周血Th1,Th2,Treg和Th17相关细胞因子检测
2021-05-31李富容侯建玲李中伟郑荣涛田洪青
温 晶 李 珍 赵 伟 李富容 侯建玲 李中伟 郑荣涛 田洪青
山东第一医科大学附属皮肤病医院(山东省皮肤病医院,山东省皮肤病性病防治研究所),山东济南,250022
梅毒血清固定亦称血清抵抗,是比较棘手的临床难题,目前还没有明确定义。中国中西医结合皮肤性病专业委员会认为,梅毒患者经规范的抗梅毒治疗和充分随访(一期梅毒随访1年、二期梅毒随访2年、三期梅毒随访3年),非梅毒螺旋体血清学试验维持在一定滴度(一般在≤1∶8,部分>1∶8)超过 3个月,排除再感染、神经梅毒、心血管梅毒和生物学假阳性等,即为梅毒血清固定[1]。郑和国等[2]报道一期梅毒血清固定发生率为4.35%,二期梅毒为11.88%。与梅毒的类型和病期、血清初始滴度、是否经过规范治疗、是否为复发或再感染、体内是否存在潜在病灶、机体免疫情况等均有关系。血清固定的发生机制目前尚不十分清楚。有研究表明,梅毒血清固定患者体内存在Th1/Th2型以及Treg/Th17型细胞因子失衡,导致机体产生免疫抑制,进而降低机体免疫对病原体的清除能力,造成梅毒病程的迁延。本研究选取了Th1型代表细胞因子IFN-γ、IL-2、和IL-12,Th2型代表细胞因子IL-4、IL-10和IL-6;Th17型代表细胞因子IL-17和IL-22;调节性T细胞(Treg)型代表细胞因子TGF-β为对象,研究分析其在梅毒血清固定组、新发梅毒组、梅毒治疗后转阴组和对照组外周血中的浓度,探讨梅毒血清固定的发生与机体免疫功能异常的相关性。
1 资料与方法
1.1 研究对象 研究对象为2012年6月至2016年10月就诊于我院性病门诊的120例梅毒患者,分为三组:梅毒血清固定组、新发梅毒组、梅毒治疗后转阴组,另根据配对原则选取30名同时间段内健康体检者作为正常对照组。梅毒血清固定组入选标准为:已接受过规范的驱梅治疗,无临床症状或治疗后临床症状消失,并经脑脊液常规、生化及TRUST等检测排除神经梅毒,TRUST仍持续阳性,持续时间定为2年以上。新发梅毒组入选标准:综合流行病学史、临床表现及实验室检查(TPPA/TRUST/PCR等)结果,梅毒确诊病例均符合梅毒诊断标准。梅毒治疗后转阴组入选标准:患者经梅毒正规治疗后TRUST试验转阴。剔除标准:①HIV抗体检测阳性;②患有自身免疫性疾病或其他感染性疾病者;③妊娠、哺乳期妇女;④追踪期间有不洁性生活史者等。组间临床资料经对比并未发现有统计学差异(P>0.05),具有可比性。本研究符合医院伦理委员会要求。所有人员均表示自愿配合本研究。
1.2 方法
1.2.1 主要仪器和试剂 IFN-γ、IL-2、IL-12(P70)、IL-4、IL-10、IL-6、IL-17、IL-22和TGF-β ELISA试剂盒(武汉博士德生物工程有限公司)、酶标分析仪(北京普朗新技术有限公司)、微孔振荡器、电热恒温培养箱(上海精宏试验设备有限公司)、TPPA试剂盒(富士株式会社)、TRUST试剂盒(上海荣盛)等。
1.2.2 标本采集 收集梅毒血清固定患者、梅毒治愈患者、梅毒新发患者、健康体检者外周血标本分离血清-20℃冰箱内冷存。
1.2.3 对所有标本进行TPPA、TRUST、HIV、肝肾功能等检测,操作均严格按照操作规则进行。
1.2.4 细胞因子水平的检测 (1)加样:取出预先包被封闭好的96孔板,分别加入100 μL稀释好的标准品和稀释好的样品,37℃孵育 90 min。(2)吸板:吸干酶标板内反应液,在对着吸水纸拍几下,不洗。(3)加生物素标记抗体:加入100 μL按1∶100稀释好的生物素标记的抗体,37℃孵育60 min。(4)洗板:1X洗涤缓冲液洗涤3次,每次浸泡1 min。(5)加过氧化物酶标记的亲和素(ABC):加入100 μL按1∶100稀释好的ABC,37℃孵育30 min。(6)洗板:1X洗涤缓冲液洗涤5次,每次浸泡90 s。(7)加入底物(TMB):每孔90 μL TMB,37℃孵育避光孵育20 min。(8)加终止液:每孔100 μL终止液,轻柔混匀。(9)读板:根据酶标仪器操作方法,上机检测OD值(450 nm 处),通过软件(ELISACalc)计算获得所测物质的浓度。
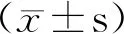
2 结果
2.1 一般资料 梅毒血清固定组:30例,其中男12例,女18例;年龄21~48(32.6±8.6)岁;一期梅毒3例,二期梅毒7例,隐性梅毒20例;初始滴度分别为RPR≤1∶2(11例)、RPR 1∶4~1∶8(3例)、RPR≥1∶16(16例)。新发梅毒组:30例,其中男14例,女16例;年龄19~50(36.8±10.3)岁;一期梅毒4例,二期梅毒11例,隐性梅毒15例。转阴组:30例,其中男13例,女17例;年龄21~51(32.3±8.7)岁。对照组:30例,血清TRUST,TPPA及HIV均阴性的健康查体者,其年龄、性别等构成比相匹配。
2.2 Th1型和Th2型细胞因子表达情况 梅毒血清固定组与新发梅毒组、转阴组以及对照组相比,Th1型细胞因子IFN-γ(P=0.005、0.04、0.004),IL-2(P=0.049、0.000、0.014)和IL-12(P=0.021、0.046、0.030)水平均明显较低,差异均有统计学意义。但Th2型细胞因子IL-4(P=0.004、0.012、0.007)和IL-10(P=0.000、0.001、0.000)水平均明显较高,差异有统计学意义;而对于IL-6,仅表现出血清固定组IL-6仅比对照组显著较高(P=0.025)(表1)。

表1 Th1,Th2,Treg和Th17相关细胞因子在各组人群外周血中的浓度
2.3 Tregs和Th17型细胞因子表达情况 结果显示,梅毒血清固定组的TGF-β与新发梅毒组、转阴组以及对照组相比均明显较高(P=0.005、0.013、0.032),而血清固定组IL-17仅显著低于新发梅毒组、转阴组(P=0.01、0.007),IL-22显著低于新发梅毒组(P=0.023)(表1)。
3 讨论
2019年全国梅毒报告535819例,胎传梅毒1934例。1995-2016年,中国每年新发梅毒确诊数量从11336例增加至438199例,梅毒总发病数量由每1.0/105增加到32.2/105[3]。伴随中国梅毒的发病率迅速增长的同时,血清固定的发病率也明显上升。李军等[4]报道一期梅毒血清抵抗发生率为8.7%,二期梅毒为20.3%,潜伏梅毒患者为42.2%。Sea等[5]发现约有15%~41%的梅毒患者会发生血清固定。梅毒血清固定发生与诸多因素有关,如梅毒的分期、血清初始滴度和是否进行规范治疗等。一旦进入血清固定,重复治疗对降低血清非特异性抗体滴度影响不大[6]。研究表明,如果治疗初期机体能发生针对梅毒螺旋体强有力的促炎性免疫反应,那么能发生血清固定的几率会低很多[7]。
Veldhoen等[8]1986年首次依据细胞分化、功能特征和其产生细胞因子的不同,将特异性CD4+Th细胞细分为Th1和Th2细胞,Maggi等[9]又在1991年证实人类存在Th1和Th2亚群。Th1细胞主要分泌IL-2,IL-12和IFN-γ等细胞因子,介导细胞免疫反应。Th2细胞主要分泌IL-4,IL-10和IL-6等细胞因子,介导体液免疫反应[10]。Leader等[11]发现梅毒患者免疫状况早期以Th1型细胞因子为主,Th1占优势。徐刚等[12]研究显示,梅毒血清固定患者的Th1型细胞因子IL-2和IL-12明显低于健康组和治愈组(P<0.05);但其Th2型细胞因子IL-10又明显高于健康组和治愈组(P<0.05)。本研究结果显示,梅毒血清固定组与新发组、转阴组相比,Th1型细胞因子IFN-γ,IL-2和IL-12水平均显著较低(P<0.05),其中IL-2可刺激NK细胞增殖,激活杀伤细胞的效应功能;IL-12可促进T细胞和NK细胞增殖并增强其活性,同时可诱导IFN-γ的产生,使免疫反应朝向Th1型方向发展,并抑制IL-4的产生。但Th2型细胞因子IL-4和IL-10水平均显著较高(P<0.05),其中IL-4可刺激活化B细胞和T细胞增殖;IL-10可促进体液免疫,抑制细胞免疫,使Th1/Th2细胞达到平衡[2]。另外本研究发现梅毒血清固定组的IL-6与新发组无显著差异,但与对照组相比有显著差异(P<0.05)。IL-6细胞因子属于IL-6家族,不但是Th2型典型细胞因子,还是一种促炎细胞因子,一种瞬间高温细胞因子,会伴随着青霉素的杀菌作用而产生,同样在调节Treg和Th17细胞的分化也有重要作用[15]。
随着研究的深入,来源于幼稚CD4+T细胞的另外两种Th细胞亚群,即调节性T细胞(Tregs)和Th17细胞再度引起广泛关注。Tregs细胞能够下调机体免疫应答的水平,减轻对机体组织的损伤以维持自身耐受,发挥免疫抑制作用;而Th17细胞恰恰相反,是最早参与抗感染免疫的效应T细胞,可以通过IL-17细胞因子而发挥抗感染作用,并促进炎症反应过程。Tregs/Th17动态平衡同样对维持机体适应性免疫内环境的稳定起着重要作用[13]。Zhao等[14]研究提出,如果患者体内Tregs/Th17细胞平衡状态异常,就会造成免疫抑制,减弱了机体对梅毒螺旋体的控制,从而导致血清固定。本研究显示,梅毒血清固定组的TGF-β显著高于转阴组、对照组(P<0.05),而IL-17和IL-22则相反。机体内TGF-β的分泌水平会显著影响Treg和Th17细胞的分化发育方向,伴随着患者体内TGF-β的升高,导致细胞分化偏向于Treg细胞,造成Th17细胞的反馈性减少。
综上所述,本研究发现无论是Th1细胞/Th2细胞,还是Treg细胞/Th17细胞,在机体内相互作用构成复杂的免疫网络,而各种细胞因子之间同样是相辅相成,亦或是此消彼长,从而影响到机体对病原体的免疫应答程度。一旦上述平衡被破坏,造成机体免疫应答的紊乱,有可能导致一部分梅毒螺旋体逃过机体免疫监视,致使梅毒感染进入慢性阶段,而在临床上表现为血清固定。从而推测无论是Th1/Th2,还是Treg/Th17的失衡在梅毒患者体内也许是普遍现象,只是血清固定患者的失衡现象更加明显。
