脑转移瘤立体定向放疗后近期MRI变化及疗效评价
2021-05-31汤子茜欧阳苗
汤子茜,林 州,欧阳苗,赵 奇
(苏州大学附属第一医院肿瘤放疗科,江苏 苏州 215006)
脑转移瘤(B M)发生率约占中枢神经系统肿瘤的40%[1]。BM发病率最高的是肺癌(20%~56%),其次是乳腺癌(20%~30%)和黑色素瘤(5%~10%)。25%~40%的非小细胞肺癌(NSCLC)患者在疾病过程中发生脑转移。此外,肺腺癌比鳞状细胞癌更容易向脑部扩散[2],且常常为多发,随着生存期的延长,BM的发生率更高。对于脑转移患者,BM的两种主要治疗方式是手术和放疗。以往的临床试验[3]表明,单纯手术切除显示局部控制率(LC)不足,虽然术后全脑放疗(WBRT)可显著提高LC率,但这并没有带来生存获益,且使用WBRT早期和晚期的脑毒性对生活质量和神经认知功能(NCF)有不良影响[4]。对于寡转移和多发转移者,其治疗策略不同,对于1~4 个病灶的BM,单纯立体定向放疗(SBRT)比WBRT具有生存优势,且能更好地保留认知功能[5]。因此,SBRT在多发BM的治疗中展现了越来越大的潜力,已逐渐成为BM的重要治疗手段。通过客观评价指标选择治疗反应差的患者(转移灶)进行追加放射治疗来实现个性化治疗,在不明显增加毒性的同时,可能会改善局部控制。不幸的是,放射治疗的疗效有时需要数周/数月才能显示出来,有部分患者可能会失去及时治疗的机会。
不同性质、大小、分化程度的转移瘤对放射治疗反应可能并不相同,而影像学变化是帮助临床医师推断肿瘤性质,决定下一步治疗方案的重要依据,因此有必要对颅内转移瘤SBRT治疗后的影像学变化特点进行分析,以指导临床决策。
1 资料与方法
1.1 临床资料 收集2018年7月—2021年2月我院放疗中心就诊的17 例BM患者的20 个颅内转移灶作为研究对象,全部患者预期生存期大于6 个月,KPS>80 分。其中男性13 例,女性7 例,年龄36~71岁,肺癌为14 例,食管癌2 例,脑胶质瘤原发病灶治疗后(脑转移)1 例,原发癌未明确(影像检查未发现原发肿瘤)1 例,除不明原发癌无原发病灶,全部患者原发病灶有影像及病理证实,颅内转移均为MR检查结合临床症状确诊。
1.2 治疗方法 SBRT计划系统为瑞典Elekta公司的Monaco治疗计划系统,治疗用直线加速器为Elekta公司的Access。采用增强定位CT图像与磁共振T1WI增强与T2WI融合图像进行GTV勾画,正常组织勾画脑干、眼球、晶体、视神经、视交叉,在GTV基础上均匀外扩3 mm生成PTV。处方剂量35~50 Gy/5~10 f。
1.3 疗效评价 在SBRT治疗前及治疗结束后1~3 个月内进行增强磁共振扫描,疗效评价采用RECIST 1.1标准:完全缓解(CR):所有目标病灶完全消失。部分缓解(PR):目标病灶的最大直径减少≥30%。进展(PD):目标病灶最大直径增加至少20%(如果基线测量值最小就以基线值为参照),出现1 个或多个新病灶也视为疾病进展。稳定(SD):靶病灶减小的程度没达到PR,增加的程度也没达到PD水平,介于两者之间。
1.4 检查方法 采用西门子3.0T磁共振扫描仪,嘱患者取仰卧位,先行横轴位T1WI、T2WI和DWI扫描,然后行T1WI横轴位、冠状位和矢状位增强扫描,具体参数如下:T1WI:TR 250 ms,TE 2.5 ms;T2WI:TR 6 000 ms,TE 93 ms;扫描层厚均为5 mm,层间距1.25 mm,矩阵128×128,视野(FOV)230 mm×230 mm。DWI采用平面回波成像序列,TR 7 000 ms,TE 80 ms,b值为0 s/mm2和1 000 s/mm2。平扫结束后行T1WI增强扫描,对比剂为钆喷酸葡胺(Gd-DTPA),用量0.1 mmol/kg,流速3 mL/s。图像后处理DWI数据分析在西门子3.0T磁共振仪自带工作站上进行,图像后处理软件PACS系统自动分析DWI原始数据,并生成表观弥散系数(ADC)图。
1.5 磁共振图像分析 结合常规MRI、DWI和ADC图,确定病变范围,于ADC图上在肿瘤实质区(T1WI增强扫描图像上呈明显强化的区域)手动勾画感兴趣区域(ROI),面积3~8 mm2,避开肉眼可见的囊变、坏死出血区;实性成分较少的肿瘤如增强仅表现为环形强化,根据增强图像尽量包含病变的实性成分。于病灶中央测值,重复测量3次,参数取3 个ROI平均值,并计算出其相对表观弥散系数(rADC):rADC值=病变实质ADC值/对侧相应部位正常脑白质ADC值。
1.6 统计学方法 应用SPSS 17.0软件分析数据,比较SBRT治疗前与治疗后的肿瘤ADC值及rADC值的变化,配对样本数据使用t检验,以P<0.05为差异有统计学意义。肿瘤最大直径、ADC值及rADC值数值改变的纵向比较利用单因素方差分析完成。肿瘤最大径与ADC及rADC值相关性利用Pearson相关性检验完成。
2 结果
2.1 一般结果 SBRT治疗后3 个月内病灶变化情况以SD居多,为10 例(占50.0%),其次为PR,有6例(占30.0%),PD为3 例(占15.0%),CR的病灶数目最少,为1 例(占5.0%)。
病灶体积明显缩小10 例,其中水肿减轻或强化减弱4 例,水肿或强化无明显变化5 例,水肿增多或强化增强1 例。病灶体积无明显变化7 例,其中水肿减轻或强化减弱1 例,水肿或强化无明显变化4例,水肿增多或强化增强2 例。病灶增大3 例。
2.2 相关分析 分析结果显示,7 例客观缓解(CR+PR)病灶SBRT后的ADC[(1.06±0.24)×10-3mm2/s]高于SBRT前的ADC[(0.90±0.15)×1 0-3m m2/s],差异具有统计学意义(P=0.021);SBRT后的rADC[(1.55±0.31)]高于SBRT前的rADC[(1.32±0.14)],差异具有统计学意义(P=0.044);SBRT后的肿瘤最大直径[(7.96±4.88)mm]低于SBRT前的肿瘤最大直径[(16.59±5.83)mm],差异具有统计学意义(P=0.008)。见表1。
表1 CR+PR的各指标在SBRT前和SBRT后之间的差异比较分析(±s)

表1 CR+PR的各指标在SBRT前和SBRT后之间的差异比较分析(±s)
分组 n ADC(×10-3mm2/s) rADC 肿瘤最大直径(mm) 对侧ADC(×10-3mm2/s)SBRT前 7 0.90±0.15 1.32±0.14 16.59±5.83 0.68±0.08 SBRT后 7 1.06±0.24 1.55±0.31 7.96±4.88 0.68±0.07 t值 -3.090 -2.539 3.877 0.053 P值 0.021 0.044 0.008 0.959
10 例SD病灶SBRT后的ADC[(1.16±0.26)×10-3mm2/s]高于SBRT前的ADC[(0.91±0.13)×10-3mm2/s],差异具有统计学意义(P=0.003);SBRT后的rADC[(1.73±0.53)]高于SBRT前的rADC[(1.27±0.20)],差异具有统计学意义(P=0.020),见表2。3 例PD病灶SBRT后其ADC及rADC值降低,见表3。
表2 SD的各指标在SBRT前和SBRT后之间的差异比较分析(±s)

表2 SD的各指标在SBRT前和SBRT后之间的差异比较分析(±s)
分组 n ADC(×10-3mm2/s) rADC 肿瘤最大直径(mm) 对侧ADC(×10-3mm2/s)SBRT前 10 0.91±0.13 1.27±0.20 24.31±9.05 0.72±0.09 SBRT后 10 1.16±0.26 1.73±0.53 22.66±6.85 0.68±0.08 t值 -4.049 -2.813 1.450 1.222 P值 0.003 0.020 0.181 0.253
表3 PD的各指标在SBRT前和SBRT后之间的差异比较分析(±s)
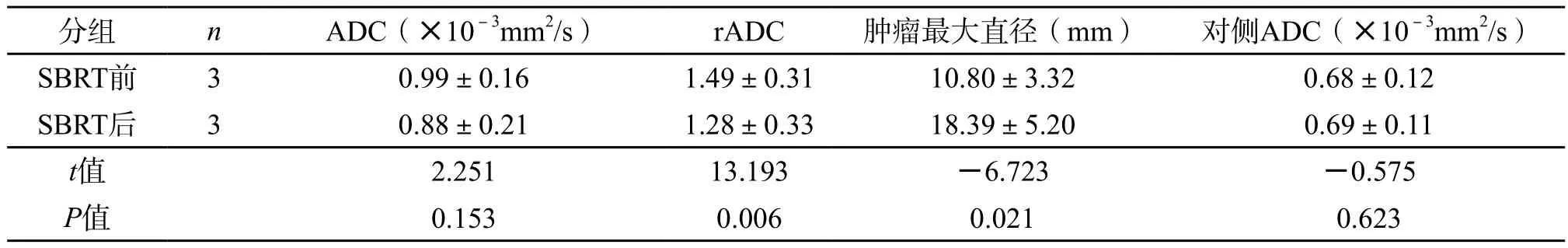
表3 PD的各指标在SBRT前和SBRT后之间的差异比较分析(±s)
分组 n ADC(×10-3mm2/s) rADC 肿瘤最大直径(mm) 对侧ADC(×10-3mm2/s)SBRT前 3 0.99±0.16 1.49±0.31 10.80±3.32 0.68±0.12 SBRT后 3 0.88±0.21 1.28±0.33 18.39±5.20 0.69±0.11 t值 2.251 13.193 -6.723 -0.575 P值 0.153 0.006 0.021 0.623
3 讨论
临床上放疗效果的判定通常以治疗前后磁共振提供的形态和信号变化为基础,疗效判定的金标准依然为肿瘤体积的变化。但临床有时仅仅依靠肿瘤大小变化作为判断标准并不一定能准确地反应真实疗效。因此单纯依靠RECIST 1.1标准作为疗效评价指标存在一定缺陷:(1)肿瘤大小的变化并不能直接反映治疗后肿瘤生物学性质的变化,在某些情况下,大小改变要比功能的改变来得慢(例如伊马替尼治疗胃肠间质瘤)。(2)影像学技术的发展让更小的肿瘤(直径<1 cm)都能被检测到,而且精确的重复测量也得到了提高,还能检测肿瘤密度上的变化,当肿瘤体积没有缩小的情况下肿瘤密度上的变化也是反映治疗疗效很重要的一个指标。在立体定向放射手术(SRS)后,1/3的病例的脑转移灶最初会增大。鉴于早期体积扩张可能是相对常见的,短间隔成像和3 个月反应评估的价值,如许多早期研究中进行的,是有疑问的[6-7]。所以,单纯依靠肿瘤大小变化来判定治疗效果很可能会延误对病情的判断,而精准的诊断对后续的治疗选择至关重要。近年来,研究人员提出了一些创新的方法来鉴别脑肿瘤,这些方法使用先进的MRI模式,如扩散张量成像(DTI),扩散加权成像(DWI),灌注加权成像(PWI),磁共振波谱,或这些方法的组合[8-9]。使用这些方法,通过评估组织微观结构和肿瘤动态,可以更准确地评估脑肿瘤。
本研究的重点是DWI,一种基于水分子运动提供图像的方法。在生物组织中,水的运动受到组织间室、细胞膜和细胞内细胞器相互作用的限制。因此,低细胞或细胞膜破裂的组织允许水分子更大的运动,反之亦然。水在生物组织内的扩散程度是用ADC这个参数来测量的[10]。由于细胞密度的空间变化,细胞结构和水分含量改变。在高细胞区,水分子的流动性受到限制,ADC较低,而在坏死或水肿区域,水分子运动更自由,ADC较高。当肿瘤对治疗有反应时,高细胞区ADC可因细胞收缩、吞噬或坏死而增加。此外,水肿区由于细胞向水肿区移动,水分流失,ADC值降低[11]。因此,DWI中ADC值的增加和低信号强度的产生,使得SRS对转移的早期评估成为可能[12],BM在伽玛刀治疗后,放疗使得细胞损伤的同时还伴随周围组织的改变如纤维化增生、水肿,从而可能会导致肿块持续存在,甚至影像学上表现为肿块增大,因此放疗引起的肿瘤结构改变往往落后于肿瘤细胞的死亡。有效的放射治疗会导致肿瘤细胞溶解,细胞膜完整性丧失,细胞间隙增宽,水分子弥散能力增加,表现为ADC值增加[13]。因此DWI可作为脑肿瘤早期检测、鉴别诊断、疗效监测的工具[14]。
相关研究[15]认为BM瘤体的rADC治疗前后差值可以预测疗效,即rADC值升高表明治疗有效,降低则提示治疗无效。理论上,化疗或放疗等非手术治疗都是通过药物及射线最终导致肿瘤细胞凋亡、坏死,从而达到治疗目的,而DWI恰可对这种微观结构的变化做出定量及定性评估。Lee等[16]通过对107 例患者的144 个转移灶进行SRS治疗,发现治疗后得到控制的病灶ADC值增加,相反控制不佳的病灶ADC值呈现下降的趋势。利用DWI观察放疗过程中肿块的ADC值变化趋势,可动态监测疗效,放疗后早期ADC值的变化可能可作为肺癌疗效评价的早期监测指标。
本研究回顾性分析了17 例患者的20 个颅内转移灶,发现运用RECIST 1.1评价标准的有效率只有35%,结合病灶大小、功能磁共振提供的信息以及临床症状综合判断,疗效达85%,与文献[17-18]报道的70%~95%的局部控制率相似。RECIST 1.1标准没有考虑到转移瘤治疗后出现病灶短期内可能增大包含放疗后病灶坏死和进展两种情况,因此单纯依靠RECIST 1.1标准可能不适合BM行SBRT后疗效判断。
另外本回顾性分析显示,全部病灶治疗后ADC值升高,较治疗前差异有统计学意义(P<0.05),结合磁共振显像原理分析可能是因为局部大剂量放疗后肿瘤细胞坏死,细胞膜完整性消失,细胞密度减少,细胞膜外间隙增加,水分子扩散能力增加导致DWI信号减低,进而导致ADC值增加。而1 例治疗后PD病灶的ADC值较治疗前下降,原因可能是放疗后肿瘤未控,边缘复发有新的肿瘤细胞生长致肿瘤细胞成分增多,细胞间隙水分子扩散受限。其中1 例CR病灶其SBRT前后ADC及rADC值较前降低,考虑完全缓解后原发病灶位置无法精确定位,并且由正常脑组织代替,导致其SBRT前后ADC及rADC值较前降低,产生误差。本文也存在着一些不足之处:由于ROI采用人工手绘,无法完全规避出血、坏死区域,这在一定程度上导致了肿瘤实质区ADC值出现测量误差。
总之,BM行SBRT后影像学表现多样,大部分病灶逐渐缩小强化减弱以致消失,部分病灶短期内保持稳定,但BM实质区ADC治疗前后却又变化,因此单纯靠分析肿瘤大小检查很难确定性质,应综合判断确定治疗效果。BM实质区ADC治疗前后差值能一定程度上辅助判断BM的SBRT效果,ADC值增高提示治疗有效,降低提示治疗无效或进展,对临床治疗方式的选择和个性化治疗方案的制定提供了一种可行的手段。
