基于FAERS挖掘硫唑嘌呤相关不良反应信号*
2021-05-29吴逢波
杨 霞,吴 斌,吴逢波
(四川大学华西医院临床药学部,四川 成都 610041)
硫唑嘌呤为临床常用的免疫抑制剂,通过影响嘌呤代谢的所有环节,抑制嘌呤核苷酸合成,导致细胞脱氧核糖核酸(DNA)、核糖核酸(RNA)及蛋白质合成被抑制,主要用于移植术后免疫抑制治疗及各类免疫性疾病,如系统性红斑狼疮、炎症性肠病、类风湿关节炎等[1]。硫唑嘌呤的药品不良反应(ADR)种类繁多,轻重程度不一,以血液系统损害、肝脏损伤、胃肠道功能紊乱、流行性感冒症状、胰腺炎、过敏性反应等最常见,导致患者停药的概率高达40%[2-4]。硫唑嘌呤的ADR可能与其代谢酶基因变异有关,如硫唑嘌呤甲基转移酶(TPMT)[5-6]、水解酶超家族中的核苷酸焦磷酸酶15(NUTD15)[7]和三磷酸肌苷焦磷酸酶(ITPA)[6]等。不良事件报告系统(AERS)是目前各国收集上市后ADR数据最有效的系统,基于AERS大数据的ADR信号挖掘方法也在国内外逐渐形成,并将其应用于药品上市后的安全性监测[7,8-10]。美国食品和药物管理局不良事件报告系统(FAERS)具有数据量大且对公众免费开放的特点,常被用于ADR信号挖掘研究[8]。硫唑嘌呤已有60多年的临床应用史,国外临床收集了大量硫唑嘌呤相关ADR的数据。基于FAERS硫唑嘌呤的相关研究中,有1篇关于非布索坦与硫唑嘌呤相互作用导致骨髓抑制的研究[11]。国内,有1篇关于硫唑嘌呤相关死亡事件的数据挖掘研究[12]。目前,国内外均缺乏基于FAERS硫唑嘌呤相关ADR的研究。本研究中基于FAERS对硫唑嘌呤ADR信号进行数据挖掘,为该药的安全使用提供预警。现报道如下。
1 数据来源与方法
1.1 数据来源
ADR源数据:数据来源于FAERS,以ASCⅡ或XML形式存储,按季度上传,提供免费下载[8,13]。本研究中下载2004年第1季度至2018年第4季度(共60个季度)的ASCⅡ数据,选择个人信息记录(DEMO)、不良事件记录(REAC)和药物使用记录(DRUG)进行数据挖掘。
药品名称标准化系统:采用美国Vanderbilt大学开发的Medex_UIMA_1.3.7系统进行药品名称标准化和RxNorm编码(RxCUI)[9,14]。
ADR编码:下载人用药物注册技术要求国际协调理事会(ICH)编制的国际医学术语集《ICH国际医学用语词典》(MedDRA)21.1版,用于首选语、高位语、高位组语、系统器官分类(SOC)编码和语言汉化[10,15]。
1.2 数据处理
数据清洗:根据FAERS说明文件去除DEMO表重复报告,采用Medex_UIMA_1.3.7系统对DRUG表中药品名称进行标准化处理,采用MedDRA 21.1对REAC表中不良事件首选语进行系统映射和汉化处理,得到可进一步检索利用的基础数据。
数据提取:筛选标准化DRUG表中RxCUI为1256(Azathioprine)和267476(Azathioprine sodium)的记录作为目标药品。筛选REAC表中所有与之相关的首选语编码。
数据分析:经过上述操作,得到易于信号挖掘的结构化数据和目标药品数据。ADR信号检测采用美国食品和药物管理局(FDA)推荐的报告比值比法(ROR)和比例报告比值法(PRR)。ROR法双侧检验95%置信区间(CI)下限>1提示“信号”(Signal);PRR法报告数不低于3,PRR法报告数不低于2且χ2≥4提示“信号”[16],即该事件很可能与药品存在关联。采用SPSS20.0统计学软件和Microsoft Excel 2017软件进行分析。
2 结果
2.1 ADR报告情况
通过数据清洗,得到ADR报告9 289 249例次,以硫唑嘌呤为首要怀疑药物的ADR报告3 301份,共6 609个ADR报告,共挖掘出1 577个首选语信号。患者中位年龄47岁,19~59岁占44.62%;由医师和其他卫生专业人员报告的占62.25%;通过口服给药的占已知给药途径报告数的90.86%。硫唑嘌呤ADR的基本信息见表1,硫唑嘌呤ADR逐年报告数量见图1,硫唑嘌呤ADR报告数量前20的国家见图2。

表1 硫唑嘌呤ADR报告基本信息(n=3 301)Tab.1 Basic information of azathioprine-related ADR reports(n=3 301)

图1 2004年至2018年硫唑嘌呤相关ADR报告数量Fig.1 The azathioprine-related ADR reports from 2004 to 2018

图2 硫唑嘌呤相关ADR报告数量前20位的国家Fig.2 Top 20 countries with azathioprine-related ADR reports
2.2 信号检测结果
ADR信号数:根据ROR和PRR法信号检测,共筛选出以硫唑嘌呤为首要怀疑药物的285个信号,首选语报告总数2 711份。按MedDRA术语集的SOC对有信号的首选语进行SOC分类排序,剔除SOC为各类检查,各类损伤、中毒及手术并发症,各类手术及医疗操作,社会环境,产品问题所对应的事件,得到264个信号,首选语报告总数为2 414。在有信号的首选语中,PRR和ROR值按大小排序的前20位和ADR报告例数前20见表2、表3。RPR和ROR值越大,ADR信号越强[17],提示药物与ADR的相关性越大,但是否在生理学上有联系还需进一步研究[18]。仅从统计学角度看,相关性较大的ADR为胎粪性腹膜炎、非硬化性门脉高血压、结节再生性过度增生等。从报告数分析,较常见的ADR为发热、全血细胞减少、脓毒症、胰腺炎等。本研究中还将检出信号与药品说明书进行对比,结果挖掘所得的前50位ADR信号中,34个未在硫唑嘌呤药品说明书中提及。
ADR信号累及的SOC:“血液与淋巴系统疾病”SOC映射的ADR报告数最多,共541例,占22.41%,其中全血细胞减少报告数(86例)最多,占总报告数的3.56%。此外,报告数居前5位的SOC涉及感染及侵染类疾病(15.41%),其中脓毒症报告数(52例)最多,占2.15%;胃肠系统疾病占14.62%,其中胰腺炎总报告数(92例)最多,占3.81%;全身性疾病及给药部位各种反应占11.89%,其中发热报告数(114例)最多,占4.72%;肝胆系统疾病占10.48%,其中门静脉高压(30例)最多,占1.24%。264个首选语信号中,感染及侵染类疾病、血液与淋巴系统疾病、胃肠系统疾病、肝胆系统疾病SOC映射的ADR信号数最多。详见表4。
3 讨论
3.1 报告时间和国家分布
通过FAERS数据挖掘发现,硫唑嘌呤ADR报告数呈逐年上升趋势,其中2014年达峰值,表明硫唑嘌呤相关ADR的上报越来越受临床重视。各国呈报数据显示,报告例数排名前5的国家分别为美国、英国、德国、荷兰、法国,均为发达国家,以上国家累计报告数占总报告数的60.40%,提示国家发达程度可能与药品安全性重视度存在关联性,同时也对其他国家使用硫唑嘌呤提出了警示,应加强硫唑嘌呤ADR的监测与上报。
3.2 硫唑嘌呤对器官/系统的损伤
本研究结果显示,硫唑嘌呤ADR累及最多的器官/系统为血液与淋巴系统,累计报告ADR 541例(22.41%)。血液系统毒性[19]是硫唑嘌呤最常见的ADR,主要与TPMT、NUDT15的活性和遗传多态性密切相关[6-7,20]。硫唑嘌呤对血液系统的损害是可逆的,且属剂量依赖性的ADR,可通过及时减量或停药得以缓解[1]。本研究中,来源于感染及浸染类疾病的占15.41%,其中排名前50的ADR信号共1 273例,感染有174例,占13.67%。SHIPKOVA[21]等发现,硫唑嘌呤治疗后出现流感样ADR,与ITPA基因的单核酸多态性密切相关,同时ITPA活性低的患者更易出现。患者使用硫唑嘌呤后,一旦发生感染,预后较差,严重者甚至可能导致死亡,临床应加强监护[22]。肝脏毒性[23]和胃肠道反应[19]也是硫唑嘌呤常见的ADR。有研究表明,硫唑嘌呤肝脏损伤机制可能是硫唑嘌呤代谢产物6-甲基巯基嘌呤(6-MeMP)在肝内蓄积,干扰特殊代谢过程引起组织脂肪变性而坏死[24]。硫唑嘌呤胃肠道ADR可能与ITPA 94C>A突变基因纯合子有关[6]。针对ADR信号挖掘结果,单纯从统计学角度分析,ADR信号越强,提示药物与不良事件的相关性越大,但在生理学上是否有联系还需作进一步临床研究[18]。本研究中,报告频率和信号强度较多的ADR信号所累及的器官/系统损伤类似,且与文献[2,4]报道硫唑嘌呤主要引起血液系统、肝脏、感染、胃肠道等ADR结果一致。印证了本研究的数据相对准确,结果可靠。
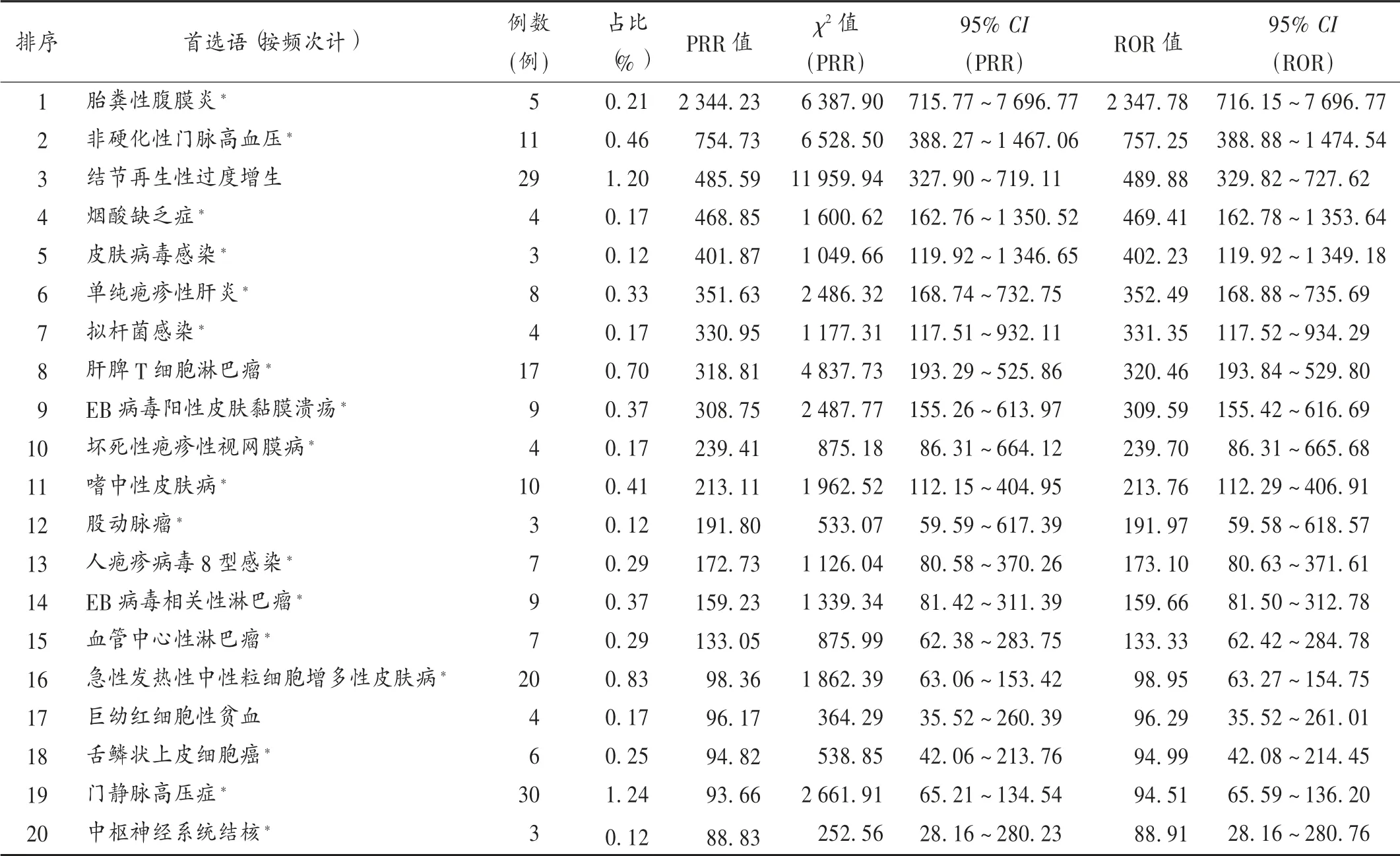
表2 硫唑嘌呤信号强度排名前20的ADR(n=2 414)Tab.2 TOP 20 ADR signals of azathioprine in descending order of signal strength(n=2 414)
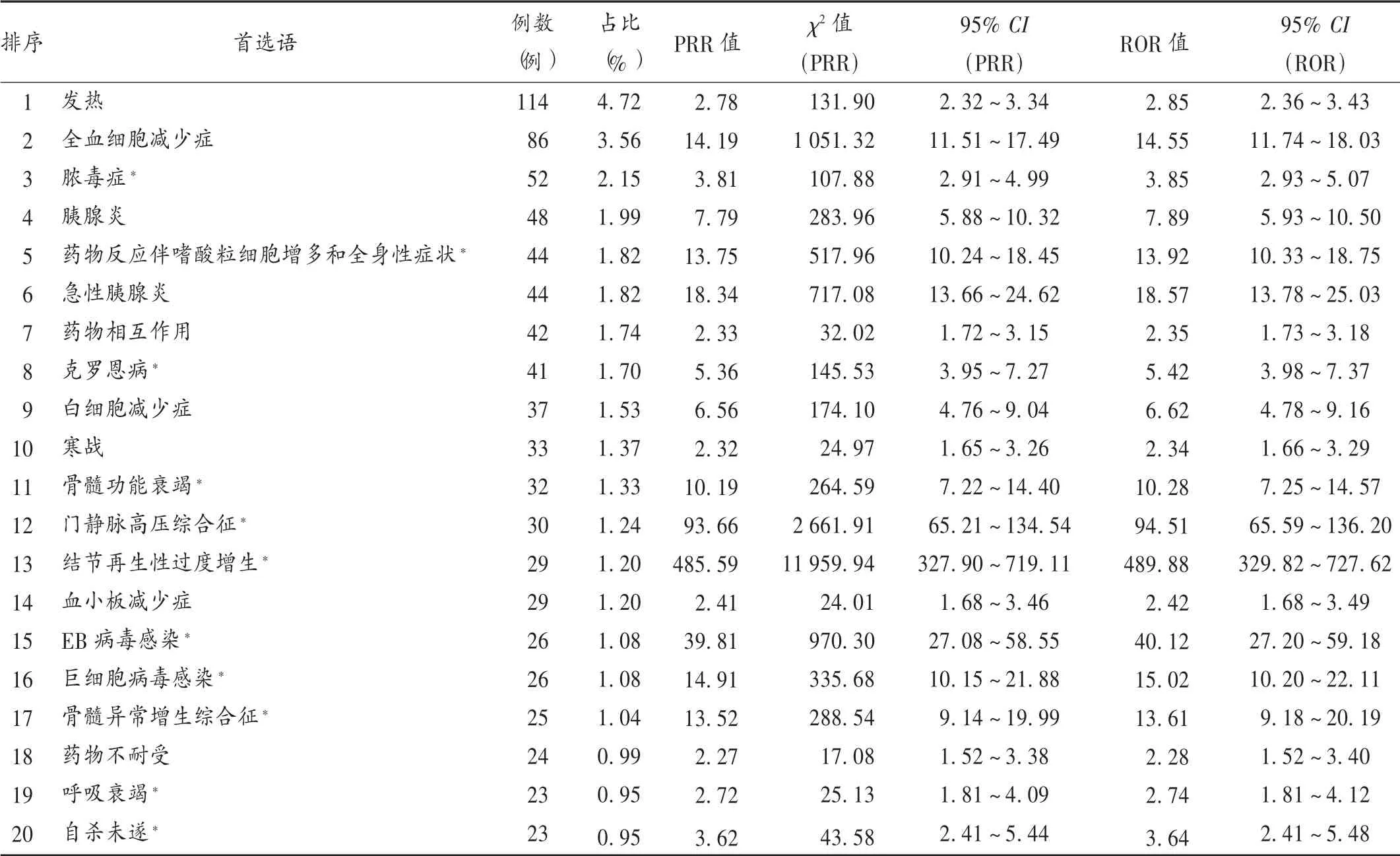
表3 硫唑嘌呤报告数前20的ADR(n=2 414)Tab.3 TOP 20 ADR signals of azathioprine in descending order of signal reports(n=2 414)

表4 硫唑嘌呤ADR信号SOC涉及疾病(n=2 414)Tab.4 Diseases involved in SOC of the azathioprine-related ADR signals(n=2 414)
与文献[19]报道相比较,本研究结果中ADR信号更全面,挖掘出的ADR信号在以往文献研究中均能得到印证。但本研究中挖掘出的部分ADR信号未曾在文献报道中提到,特别是信号强度高的ADR信号。一部分原因是文献中常报道便于临床识别且药品说明书有记载的ADR;另一部分原因是文献报道的样本量较少,且数据来源单一。以上原因可能导致这些信号强度高的ADR在临床实践中未被识别到。通过与文献研究对比,突显了FAERS挖掘ADR的优越性,能更全面、准确地挖掘硫唑嘌呤的相关ADR信号,为临床提供新的ADR信号,为临床安全用药提供预警。研究结果与药品说明书对比发现,报告频率排名前50的ADR信号中,34个尚未载入硫唑嘌呤药品说明书,可能与药品上市前研究的局限性(如样本量少、研究周期短、研究对象范围窄等)有关。对于新的ADR信号,医务人员应重点关注;对于有条件的医疗机构,在使用硫唑嘌呤前可进行基因检测,以便后续剂量的调整及ADR的监测。
3.3 研究局限性
一是FAERS系统对公众免费开放,故数据来源多样,存在部分数据缺失和数据不规范情况,且数据大多来源欧美国家,亚洲国家数据相对较少。二是比例失衡法计算所得信号值仅从统计学意义来看,信号强度表示目标药物与目标ADR在统计学上具有相关性,但不能表明其在生理学上有因果联系[18],两者的关联性还需进一步评估和验证。三是自发呈报系统存在漏报和低报的缺点,可能导致信号被低估[9]。
3.4 小结
综上所述,本研究中基于FAERS系统,利用比例失衡法中的ROR法和PRR法挖掘硫唑嘌呤上市后的ADR信号,弥补了药品说明书中ADR的不足,获得了相对真实、完整的药品安全信息,为促进临床安全使用硫唑嘌呤提供了参考。
