蛇葡萄素抗乳腺癌的网络药理学分析及细胞试验研究*
2021-05-29张芸绮王妙然蔺晓菁李继斌
李 月,周 永,张芸绮,王妙然,蔺晓菁,钟 莹,李继斌
(1.重庆医科大学公共卫生与管理学院营养与食品卫生学教研室,重庆 400016; 2.重庆医科大学附属第一医院重大代谢性疾病转化医学重点实验室,重庆 400016; 3.重庆市巴南区人民医院临床营养科,重庆 401320)
乳腺癌为常见恶性肿瘤,2018年乳腺癌发生率位居全球恶性肿瘤第2,病死率第5[1]。目前,乳腺癌的临床治疗措施主要有手术切除、放射治疗(简称放疗)、化学治疗(简称化疗)和分子靶向治疗。随着早期诊断和治疗策略的改进,患者预后明显改善,但仍有较多患者最终出现肿瘤复发和耐受现象。蛇葡萄素(AMP)又名二氢杨梅素(DMY),属黄酮类化合物。植物化学研究表明,DMY和杨梅素分别是藤茶中的2种主要黄酮类化合物。AMP(20%~30%,m/m)的含量远高于杨梅素(1.5%~3.0%,m/m)[2]。AMP具有抗氧化、抗炎、抗肿瘤等生物学活性[3]。网络药理学以系统生物学为基础,对“药物-靶点-疾病”间关系进行分析,强调对信号通路的多调节途径,与中药“多成分-多靶点-多通路”的作用机制相似[4]。本研究中运用网络药理学方法预测AMP作用靶点及相关信号通路,并结合细胞试验对潜在作用靶点进行验证,阐释AMP抗乳腺癌的作用机制。现报道如下。
1 靶点研究
1.1 靶点获取
AMP靶点:通过Pubchem数据库获取AMP的3D分子结构,保存为sdf格式,然后上传至PharmMapper数据库,得到AMP作用的靶点基因,根据fit score进行排序,利用UniProt数据库的Retrieve/ID Mapping功能,将靶点的UniProt ID转换为Gene Symbol。
疾病靶点:以“breast cancer”作为关键词,检索GeneCards数据库,并进行筛选,获取疾病相关靶点数据集。使用R 4.0.4软件,提取AMP与疾病靶点中的共同靶点,作为AMP治疗乳腺癌的潜在作用靶点(即药物-疾病共同靶点)。
1.2 蛋白相互作用(PPI)网络的构建及关键靶点筛选
将上述过程获得的靶点交集导入String蛋白质分析平台,蛋白种类设置为“Homo sapiens”,构建PPI网络图,输出结果格式为TSV格式。将文件中的node1和node2信息导入Cytoscape 3.2.1软件中绘制PPI网络图,利用“Tools”中的“Network Analysis”功能进行网络拓扑结构分析,以大于或等于中位数1倍值的接近中心度和介数中心度,以及大于或等于中位数2倍值的度值为筛选标准。值越大表明节点在网络中的地位越重要,从而筛选出关键靶点。
1.3 关键靶点的生物过程与信号通路分析
将筛选出的关键靶点导入R 4.0.4软件中建模,对关键靶点进行GO富集分析和KEGG通路富集分析,探讨AMP关键靶点的功能分布,预测AMP潜在的调控通路。
将上述过程获得的靶点交集导入String蛋白质分析平台,将蛋白种类设置为“Homo sapiens”,构建PPI网络图,输出结果格式为TSV格式。将文件中的node1和node2信息导入Cytoscape 3.2.1中绘制PPI网络图,利用“Tools”中的“Network Analysis”功能进行网络拓扑结构分析,以大于或等于中位数1倍值的接近中心度和介数中心度及大于或等于中位数2倍值的度值为筛选标准;值越大表明节点在网络中的地位越重要。将PharmMapper数据库AMP作用靶点与GeneCards得到的乳腺癌相关基因进行比对,筛选出119个AMP-乳腺癌潜在作用靶点。结果见图1和图2。
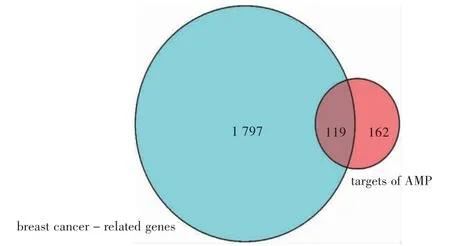
图1 蛇葡萄素抗乳腺癌靶点分析Fig.1 The anti-breast cancer targets of ampelopsin
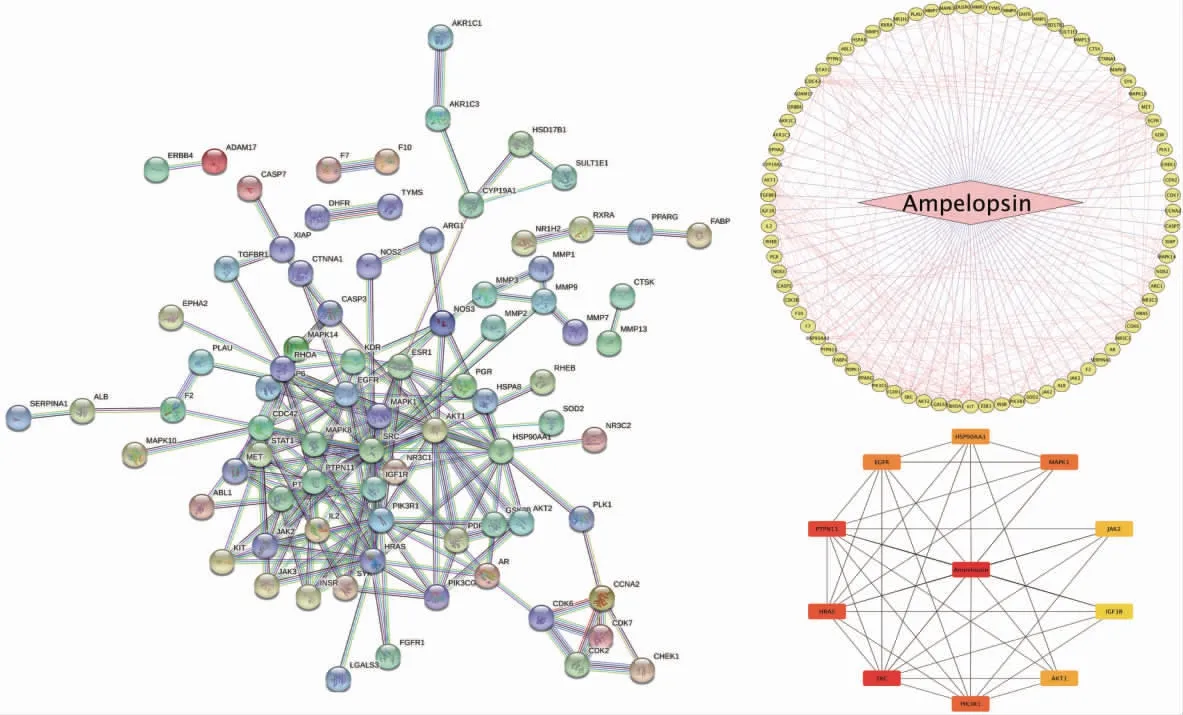
图2 蛇葡萄素抗乳腺癌PPI网络分析Fig.2 Protein-protein interaction(PPI)network of ampelopsin against breast cancer
1.4 关键靶点的生物过程与信号通路分析
将筛选出的关键靶点导入R 4.0.4软件中建模,对关键靶点进行GO富集分析和KEGG通路富集分析,探讨AMP关键靶点的功能分布,预测AMP潜在的调控通路。GO富集分析结果表明,这些靶点被富集到1 926个生物学过程,与response to oxidative stress,response to reactive oxygen species,cellular response to oxidative stress,regulation of MAPkinase activity,peptidyl-tyrosine phosphorylation 5个生物学过程密切相关;在细胞组分方面,靶点富集最多的是focal adhesion,cell-substrate adherens junction,cell-substrate junction;在分子功能中,主要起作用的是endopeptidase activity和protein serine/threonine kinase activity。结果见图3 A(图中BP为生物过程,CC为细胞组分,MF为分子功能)。
KEGG通路富集分析结果显示,与83个潜在靶点基因显著相关(P≤0.05)的通路有63条,排名靠前的信号通路为:PI3K-Akt signaling pathway、MAPK signalingpathway、Rassignalingpathway等,涉及基质金属蛋白酶2(MMP2)和非受体酪氨酸激酶(SRC)等。结果见图3B。
2 细胞验证试验
2.1 仪器、试药与细胞
仪器:3111型CO2培养箱、1510型酶标仪(美国ThermoFisher公司);AX10型倒置荧光显微镜(德国Zeiss公司);CFX96型实时定量聚合酶链反应仪(美国Bio-Rad公司)。
试药:AMP(成都曼斯特生物科技有限公司,批号为A0049,含量≥98%);CCK-8检测试剂盒(日本同仁公司);Trizol总RNA提取试剂盒、逆转录试剂盒(大连宝生物工程有限公司);PRMI 1640培养基和胎牛血清(FBS)均购自美国Gibco公司;Transwell小室(美国Coning公司);PCR引物(生工生物工程<上海>股份有限公司)。
细胞:三阴性乳腺癌细胞MDA-MB-231(受赠于重庆医科大学公共卫生与管理学院练雪梅教授)。
2.2 对MDA-MB-231细胞活力的影响
采用CCK-8法。于37℃及5%CO2条件下,培养MDA-MB-231细胞至对数生长期,调整细胞密度至每1 mL 1×104个,接种于96孔板中,每孔100μL。设定AMP浓度分别为0,20,40,60,80,100μmol/L,每组设5个复孔,作用24 h。培养结束后加入CCK-8,于450 nm波长处测定吸光度(A),计算细胞活力。细胞活力=(A试验-A空白)/(A对照-A空白)×100%,A试验为具有细胞、CCK溶液和AMP溶液的吸光度,A空白为具有培养基和CCK溶液而无细胞的吸光度;A对照为具有细胞、CCK溶液而无AMP溶液的吸光度。结果,与0μmol/L比较,AMP浓度为20,40,60,80,100μmol/L时细胞活力显著减弱,40μmol/L作用最明显。结果见图4。采用GraphPad Prism 6.0统计学软件分析,行Dunnett-t和独立样本t检验。P<0.05为差异有统计学意义(下同)。
2.3 对MDA-MB-231细胞迁移的影响
采用划痕试验及Transwell试验。将MDA-MB-231细胞接种于6孔板中,待细胞生长至80%~90%后,利用200μL枪头进行垂直划痕。磷酸盐缓冲溶液(PBS)清洗3次,加入一定浓度的AMP处理细胞24 h,分别在0 h和24 h时镜下观察并采集图片。将MDA-MB-231细胞接种于6孔板中,加入20,40,60μmol/L的AMP处理细胞24 h后,将细胞接种于无基质胶小室。上室加入不含血清的培养基(200μL),下室加入含10%FBS的培养基(600μL)。24h后,细胞置4%多聚甲醛中固定15 min,PBS清洗细胞3次后,结晶紫染色液(0.05 mmol/L)染色20 min,在荧光显微镜下观察。结果见图5。
2.4 对MDA-MB-231细胞MMP2和SRC mRNA表达的影响
采用逆转录定量聚合酶链反应(RT-PCR)法。收集细胞,细胞按2×105个/孔的密度接种于6孔板中,以Trizol法提取总RNA,逆转录合成cDNA,以β-actin引物为内参。PCR条件:95℃预变性10 min,95℃变性4 s,58℃退火10 s,65℃延伸5 s,共40个循环。以BioRad CFX软件记录扩增曲线和Ct值,根据2-ΔΔCt计算各基因的相对表达量,试验重复3次。引物序列见表1,结果见图6。
3 讨论
乳腺癌发病率和死亡率逐年上升,2018年全球癌症报告显示其占新发女性癌症的24.2%[1]。根据常规病理学分型,乳腺癌分为激素受体阳性、表皮生长因子受体2阳性和三阴性[5]3种类型。三阴性乳腺癌(TNBC)是指患者的雌激素受体(ER)、孕激素受体(PR)和表皮生长因子受体2(HER2)均为阴性,具有复发率高、病死率高和侵袭性强的临床特点[6]。本研究中采用的MDA-MB-231细胞即为TNBC细胞。目前,临床对乳腺癌的治疗多采取化疗,其存在很大的耐药性和复发性,预后极差。
有研究发现,显齿蛇葡萄富含的AMP具有良好的抗癌(尤其对骨瘤、胃癌和乳腺癌)作用[7-9]。有研究证实,AMP可通过抑制乳腺癌细胞Akt/mTOR通路,诱导细胞死亡[10];通过MAPK和PI3K/Akt信号传导可促进高热诱导的淋巴癌细胞凋亡[11];可有效抑制乳腺癌荷瘤小鼠的肿瘤生长,且对模型小鼠的心、肝、肾功能均无明显影响[12];也有研究探讨了AMP抑制肿瘤生长的可能机制,包括细胞周期阻滞、诱导细胞死亡和增加细胞内活性氧(ROS)的产生等信号通路[13]。

图3 蛇葡萄素抗乳腺癌靶点GO富集分析和KEGG通路富集分析Fig.3 Go enrichment analysis and KEGG pathway enrichment analysis of the anti-breast cancer t argets of ampelopsin

图4 MDA-MB-231细胞生长情况Fig.4 The proliferation of MDA-MB-231 cells
本研究中利用网络药理学方法分析获得AMP作用于乳腺癌相关靶基因共119个。通过PPI网络筛选出10个关键靶点,包括MMP2,SRC,PTPN11,HRAS等。进一步对核心靶点进行GO和KEGG通路富集分析,初步预测出AMP通过氧化应激反应等功能途径及PI3KAkt信号通路、MAPK信号通路、Ras信号通路等多条通路途径发挥治疗乳腺癌的作用。此外,本研究中以MDA-MB-231细胞试验加以验证。结果表明,AMP作用MDA-MB-231细胞24 h能明显抑制细胞的活力及迁移,同时抑制与增殖迁移相关的MMP2和SRC mRNA的表达。但本研究结果显示,AMP对细胞迁移能力的抑制作用并非严格呈剂量依赖性,40μmol/L抑制能力强于60μmol/L,该现象与其他研究结果类似[14],但具体机制还需进一步证实。

图5 MDA-MB-231细胞迁移能力Fig.5 The migration ability of MDA-MB-231 cells

表1 引物序列Tab.1 Primer sequence
在关键靶点中,采用细胞试验观察了AMP对SRC的作用。SRC与细胞增殖、分化、存活和侵袭相关[15]。已有研究发现,其通过PI3K,MAPK,STAT3,FAK信号通路介导癌细胞生长、迁移和血管生成[16-17]。黏着斑激酶(FAK)是一种非受体酪氨酸激酶,FAK-SRC复合物在许多肿瘤细胞中被激活,FAK和SRC的催化活性在促进蛋白酶相关肿瘤转移方面扮演着重要角色[18]。大量研究显示,MMP尤其是MMP2和MMP9涉及肿瘤迁移环节[19]。有研究表明,AMP通过减少MMP2的表达来减弱增殖性玻璃体视网膜病变(PVR)的侵袭和迁移[20];在肝癌细胞中,AMP也发挥了抑制肝癌细胞的迁移和侵袭作用[21]。在本研究中,AMP可显著降低MDA-MB-231细胞的MMP2表达水平,提示MMP2可能是AMP抑制肿瘤细胞迁移的关键靶点。
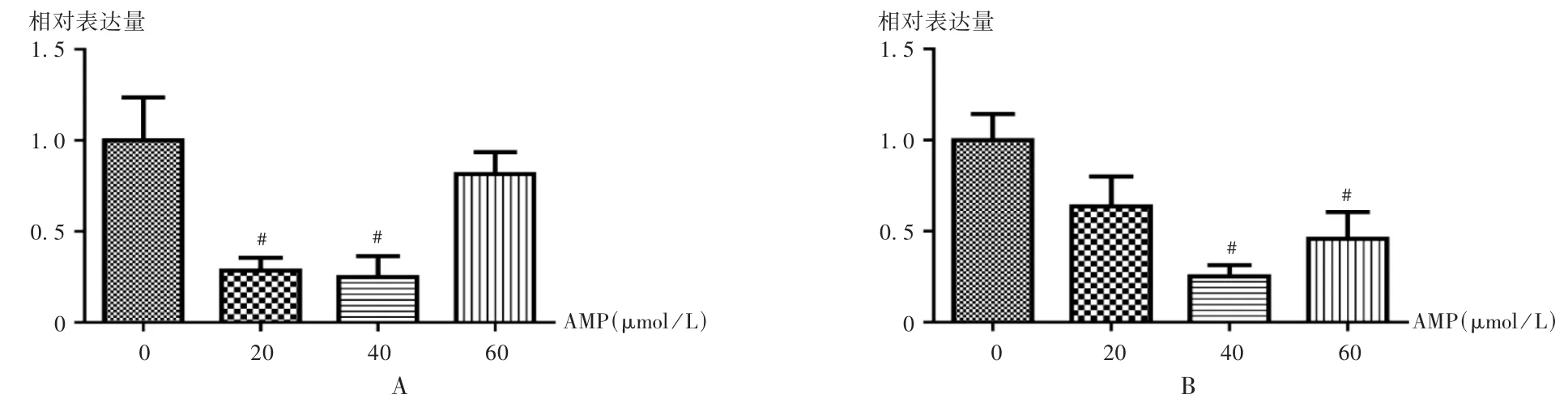
图6 MMP2和SRC mRNA表达情况Fig.6 The mRNA expression of MMP2 and SRC
综上所述,AMP治疗乳腺癌具有多成分、多靶点、多途径的特点。本研究为AMP应用于乳腺癌的防治提供了理论依据和研发思路。
