不同浓度氧合血红蛋白对大鼠蛛网膜下腔出血后迟发性脑血管痉挛的影响
2021-05-29王玉妹唐思魏张少兰吴蕾石广志
王玉妹,唐思魏,张少兰,吴蕾,石广志
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是一种严重威胁患者生命的疾病[1],迟发性脑血管痉挛(delayed cerebral vasospasm,DCV)是动脉瘤性SAH患者致残率和死亡率较高的重要原因[2]。血管造影显示,高达70%的动脉瘤性SAH患者在出血后会出现脑血管收缩,但只有约50%的患者出现脑血管痉挛症状,约20%的患者将继续发展成脑梗死[3]。近年来,很多临床和动物研究不断探索DCV的发生机制,但其确切机制目前尚不清楚,这也使得DCV的预防和治疗成为临床中的一个重点和难点[4]。
有研究显示,氧合血红蛋白(oxyhemoglobin)是引起SAH后DCV的重要因素[5-9]。但目前氧合血红蛋白对于DCV作用的研究大多是在体外进行,将脑血管分离出来,给予一定浓度的氧合血红蛋白观察脑血管痉挛情况,且氧合血红蛋白对DCV的影响尚不明确。目前多采用枕大池二次注血法制作SAH模型[10],但是尚缺乏一种能够在动物体内模拟不同浓度氧合血红蛋白引发DCV的方法。本研究首次采用自体动、静脉血模拟不同浓度的氧合血红蛋白,将动、静脉血分别注入大鼠枕大池内,建立SAH模型,通过观察基底动脉面积及超微结构变化明确有无DCV。
1 材料与方法
1.1 实验动物及分组 选取成年SD大鼠24只,雌雄各半,体质量280~300 g,购于北京维通利华实验动物技术有限公司。实验通过了北京市神经外科研究所动物福利伦理委员会的批准(批准号:Z141107002514126)。所有大鼠均饲养在温度20~25 ℃、相对湿度40%~80%室内环境下,光照及黑暗时间均为12 h,可自由进食饮水。将24只大鼠按照随机数字表法分为三组,动脉血SAH组、静脉血SAH组和对照组,每组8只。
1.2 SAH模型制作及血气分析 采用枕大池二次注血法制作SAH模型。将大鼠称质量,用10%水合氯醛溶液(北京化学试剂公司)0.4 mL/100 g进行腹腔麻醉,麻醉后将大鼠仰卧位固定于鼠板上,消毒一侧腹股沟区,逐层切开皮肤及皮下组织,分离出股动脉及股静脉,备用。大鼠改为俯卧位,胸前垫高,头部自然前屈,枕部备皮,沿中线切开枕顶部皮肤及皮下组织、寰枕筋膜,显露硬膜,经枕部寰枕间硬膜处,穿刺枕大池,注射器缓慢回抽,可见清凉脑脊液而无血液,提示手术成功,抽出0.3 mL的脑脊液。动脉血SAH组自股动脉抽取1 mL动脉血,行血气分析(测量动脉血氧分压及氧饱和度)以观察血氧饱和度;同时,将0.3 mL动脉血在2 min内缓慢注入枕大池;静脉血SAH组自股静脉抽取1 mL静脉血,行血气分析,同时将0.3 mL静脉血缓慢注入枕大池;对照组向枕大池内缓慢注入0.3 mL生理盐水。注射后将穿刺针眼用骨蜡封闭,缝合皮肤。将大鼠置于30 °头低位15~30 min,辅助血液在颅内基底动脉周围分布。第一次注射后24 h重复同样的操作。所有大鼠腹腔注射10万U青霉素,持续3 d。第二次注射结束后,饲养7 d,可自由进食饮水。
1.3 一般情况及脑组织观察 每天观察大鼠的意识状态、外观、运动、饮食状况等,早晚各记录一次,同时观察其是否有神经症状。饲养7 d后,将大鼠用10%水合氯醛0.6 mL/kg进行腹腔麻醉后,经左心室灌注0.9%生理盐水250 mL后,再灌注4%多聚甲醛磷酸盐缓冲液(北京化学试剂公司)250 mL,灌注完毕后,双侧前顶枕开颅,在枕骨大孔上方,将含基底动脉的脑、小脑、脑干解剖完整取出,4%多聚甲醛固定24 h后,观察脑组织标本、基底动脉周围有无血液凝集。
1.4 HE和免疫荧光染色观察基底动脉形态变化 取基底动脉分叉处的动脉,石蜡包埋,切片HE染色,并采用免疫荧光法进行一抗、二抗(北京中杉金桥生物有限公司)染色。在光学显微镜(E600,日本尼康公司)下观察基底动脉的平均管径面积、管壁的厚度及基底动脉的形态变化。用图像采集与分析系统(西德奥伯肯卡尔-蔡司股份有限公司)收集数据,记录每只大鼠基底动脉的平均管径面积、管壁厚度。
1.5 电镜下观察基底动脉的超微结构 取一部分基底动脉进行固定、冲洗,通过光学显微镜定位超薄组织切片后,应用电子显微镜(H-7650,日立)观察基底动脉的超微结构变化。
1.6 统计学方法 采用SPSS 22.0统计学软件进行数据分析。符合正态分布的计量资料用表示,两组比较采用配对t检验;多组间的比较采用单因素方差分析,两两比较采用LSD检验。以P<0.05为差异有统计学意义。
2 结果
2.1 动脉血与静脉血比较 动脉血的氧分压(94.8±9.8 mm Hgvs41.8±6.5 mm Hg,P<0.001)和氧饱和度(96.6%±1.7%vs72.4%±8.9%,P<0.001)明显高于静脉血(图1)。
2.2 各组一般情况及脑组织比较 二次注血后,动脉血SAH组和静脉血SAH组均出现了一系列的精神神经症状,如活动及进食减少、体重减轻、对刺激反应减弱、困倦,严重者甚至出现瘫痪等。对照组无明显的神经功能缺损症状。
肉眼观察:对照组大鼠脑组织未见蛛网膜下腔内有血液,基底动脉及其周围无血凝块。动脉血SAH组和静脉血SAH组解剖标本可见不同程度的粘连和血凝块残留,蛛网膜下腔、基底池均可见血凝块,基底动脉及其分支被血凝块包裹,脑组织肿胀,脑组织结构无明显变化(图2)。
2.3 基底动脉管腔面积及管壁厚度比较 显微镜下观察:对照组基底动脉管径平滑,组织结构基本正常,管壁无增厚;动脉血SAH组基底动脉管径变窄,管壁增厚,可见粒细胞、单核细胞浸润;静脉血SAH组基底动脉较动脉血SAH组管径增宽,管壁较薄,血管痉挛较动脉血组不明显(图3)。
对照组、静脉血SAH组、动脉血SAH组基底动脉的管径面积分别为84 130.27±11 397.9 nm2、68 480.89±12 687.4 nm2、40 816.09±10 410.51 nm2,三组整体比较差异具有统计学意义(F=28.9,P<0.001)。与对照组相比,动脉血和静脉血SAH组管径面积均明显变小,基底动脉出现血管痉挛(对照组与动脉血SAH组P=0.039,与静脉血SAH组P<0.001);与静脉血SAH组相比,动脉血SAH组管径面积较小(P<0.001)。
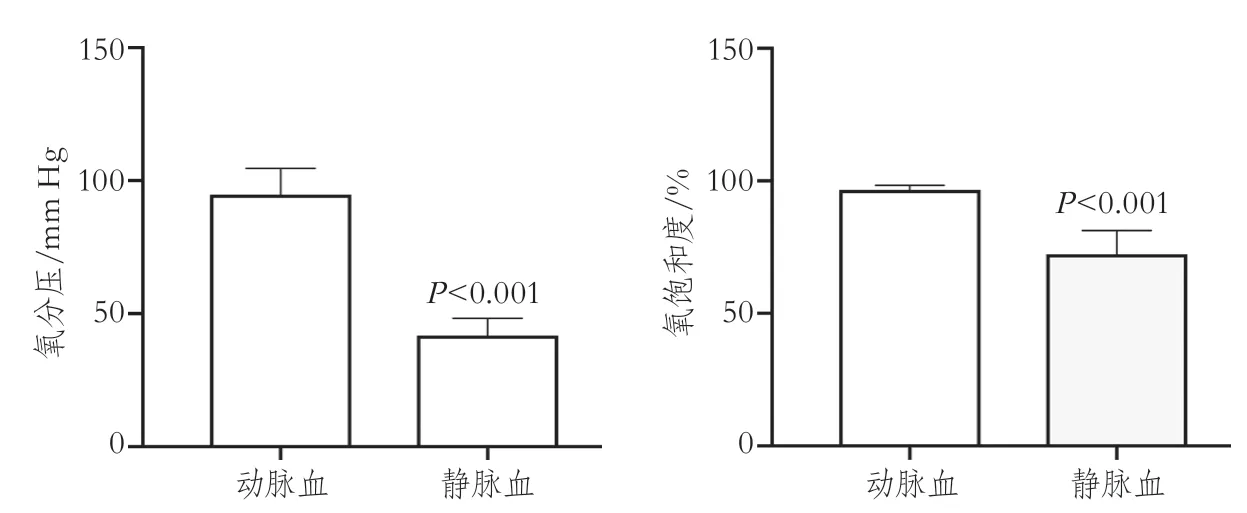
图1 动脉血和静脉血氧分压和氧饱和度的比较
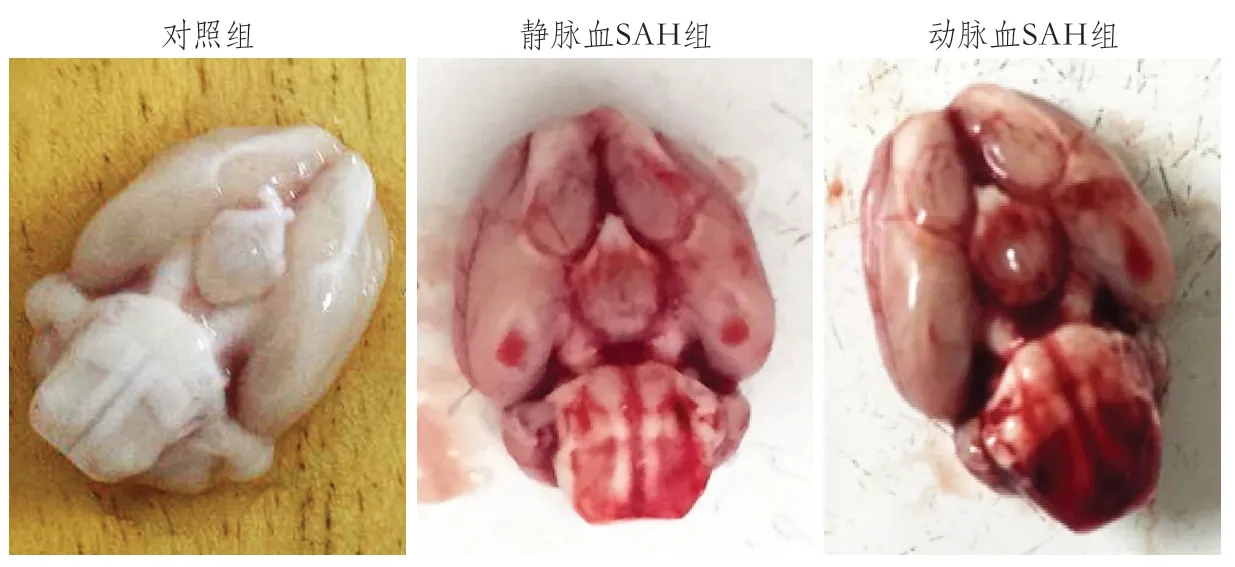
图2 三组大鼠SAH后脑组织图像
对照组、静脉血SAH组、动脉血SAH组基底动脉的管壁厚度分别为1.84±0.33 μm、2.36±0.25 μm、3.07±0.59 μm,三组整体比较差异具有统计学意义(F=17.9,P<0.001)。与对照组相比,动脉血SAH组管壁厚度明显增加(P<0.001);静脉血SAH组管壁厚度有增加的趋势,但无统计学差异(P=0.61);与静脉血SAH组相比,动脉血SAH组管壁明显增厚(P=0.007)(图4)。
2.4 基底动脉的超微结构 电镜下观察:对照组内皮细胞及中层平滑肌细胞正常,内皮细胞无空泡变性,中层平滑肌细胞厚度正常。动脉血和静脉血SAH组均出现一些超微结构的改变,平滑肌细胞排列紊乱,均有不同程度的内皮细胞空泡变性。与静脉血SAH组相比,动脉血SAH组内皮细胞空泡变性更严重,且动脉血SAH组平滑肌细胞排列更加紊乱(图5)。
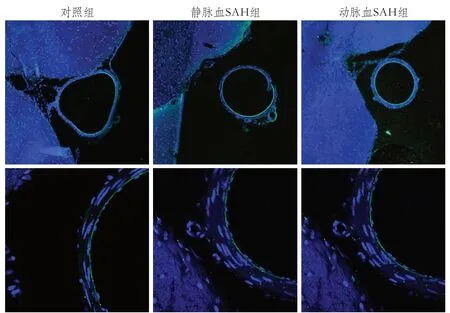
图3 三组大鼠基底动脉的免疫荧光染色图(光学显微镜×20,×40)
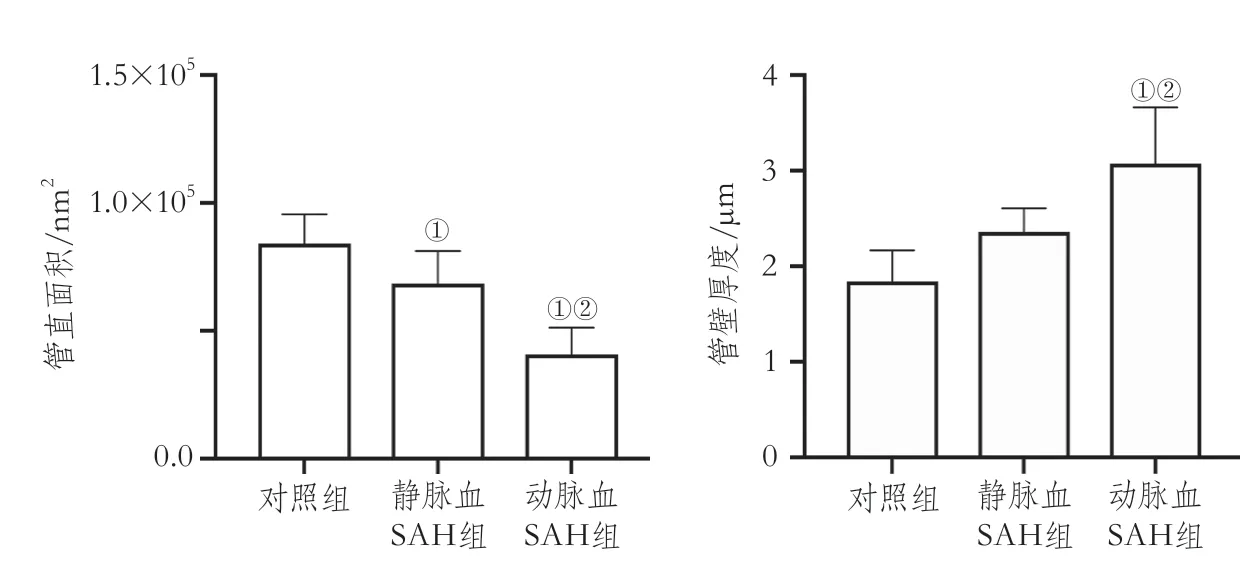
图4 三组大鼠基底动脉的管径面积及管壁厚度比较
3 讨论
SAH是临床上一种常见的疾病,也是威胁患者生命的一种严重疾病,尤其是SAH一旦发生DCV后,可能引起进一步的缺血损害,出现神经系统功能缺失,甚至出现脑梗死,导致死亡[11]。影响SAH后DCV的因素很多,如一氧化氮含量、血管内皮细胞功能障碍、血液中各种免疫因子水平等[12-13],其中氧合血红蛋白是引起SAH后DCV的重要因素。氧合血红蛋白引起脑血管痉挛的机制可能有:Kv通道抑制[9],细胞内Ca2+水平升高[6],Rho激酶和(或)蛋白激酶C活性增加,导致Ca2+敏感性增加,降低一氧化氮的有效性和增加血管收缩剂20-HETE合成。
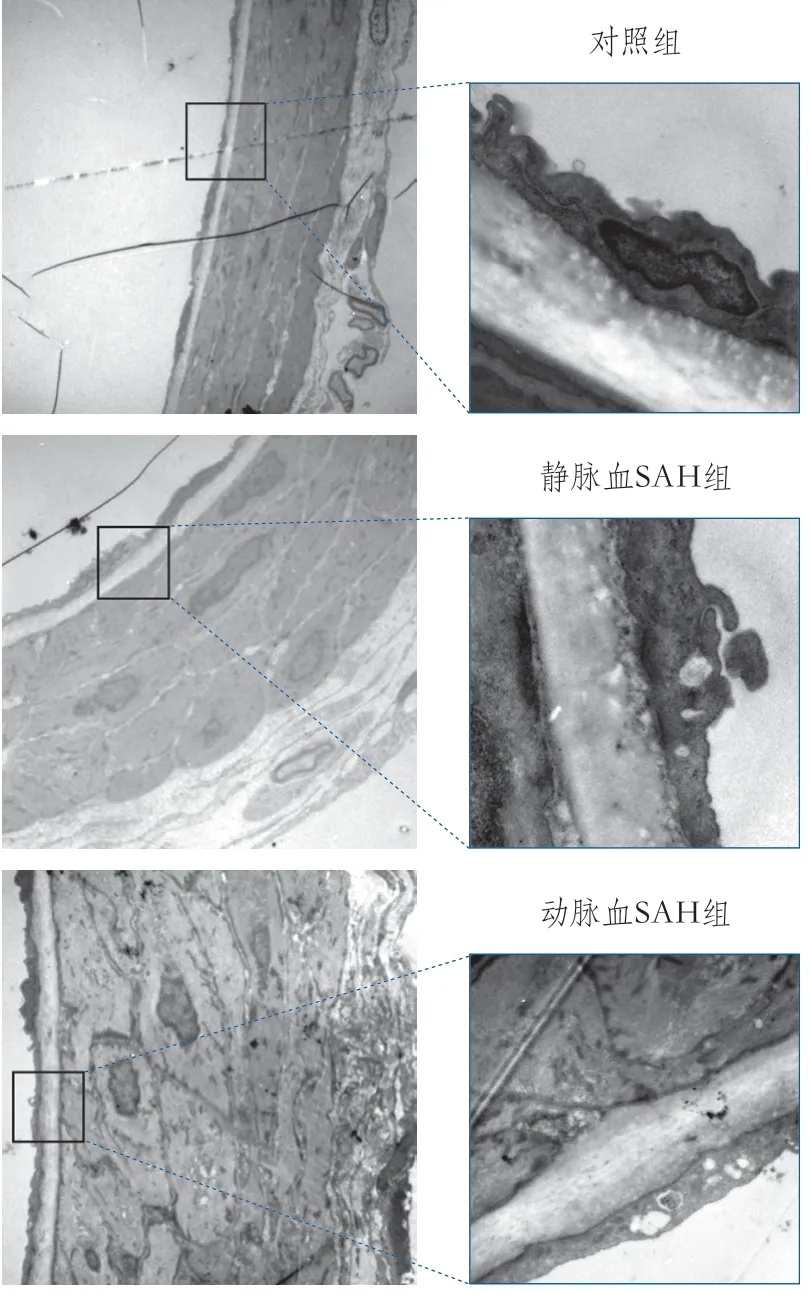
图5 三组大鼠基底动脉的超微结构图像(电子显微镜×20万,×40万)
一项动物研究探索了随SAH进展氧合血红蛋白与基底动脉挛缩程度的关系,该研究发现基底动脉直径在SAH后3 d、5 d和7 d分别挛缩了20%、35%和45%;同时,随着病程进展氧合血红蛋白含量也逐渐增加[14],此研究证实了氧合血红蛋白的含量与脑血管痉挛之间有密切的关系。2008年,一项体外试验将基底动脉分离,暴露在氧合血红蛋白培养基内,发现氧合血红蛋白能够引起脑血管痉挛,可能的原因是R型电压依赖性Ca2+通道的表达,也间接证明了氧合血红蛋白是DCV的一个重要因素[8]。然而,这些研究均在体外进行,或是间接证明了氧合血红蛋白在DCV发生中的重要作用。动、静脉血最主要的区别为氧合不同,即氧合血红蛋白浓度不同,也有研究显示静脉血中的氧含量约为动脉血的40%,氧合血红蛋白含量仅为动脉血的35%~40%[15],因此,本研究采用自体动、静脉血模拟不同浓度的氧合血红蛋白,同时也对动、静脉血进行了血气分析,发现动脉血和静脉血的氧饱和度分别为96.6%±1.7%和72.4%±8.9%,即血液中被氧结合的氧合血红蛋白占全部可结合血红蛋白的百分比。采用自体动、静脉血可以避免异体排斥反应,更好地模拟由动脉瘤破裂引起的SAH,启动炎性反应,血管挛缩、血流量降低导致血管痉挛。
本研究采用枕大池二次注血法模拟SAH,第一天向枕大池注入自体血液,24 h后再次注入自体血,造成比较稳定的SAH。因血管容易受到应激反应的影响,实验结束后采用心脏灌注处死动物,用多聚甲醛将血液全部置换,尽可能地保持血管原有形态,减少应激反应对血管的影响。同时,采用多种方法评估血管挛缩程度,如基底动脉的直径和管壁厚度;采用免疫荧光法观察基底动脉痉挛的程度,电子显微镜观察基底动脉血管损伤的超微结构等,保证实验结果的严谨性。
本研究有一定的局限性,实验中用血气分析中的氧分压和动、静脉血氧饱和度反映氧合血红蛋白浓度,未精确测量氧合血红蛋白和去氧血红蛋白的含量,但动、静脉氧饱和度能够较好地反映氧合血红蛋白浓度。实验性SAH与临床性SAH的特征有很多不同,仍需要进一步研究验证氧合血红蛋白在临床中对DCV的影响。研究中观察到低浓度的氧合血红蛋白能够降低DCV程度,但未进一步研究其病理生理学过程和分子机制。
本研究发现SAH后DCV的发生与氧合血红蛋白浓度密切相关,降低氧合血红蛋白浓度可减轻脑血管痉挛程度。但氧合血红蛋白引起DCV的病理生理学过程和分子机制仍需要进一步研究,明确其根本通路,也许能为DCV的治疗靶点提供依据,从而改善SAH后患者的转归和预后。
【点睛】本研究首次采用动脉血和静脉血模拟不同浓度的氧合血红蛋白,并用枕大池二次注血法模拟了SAH后DCV的模型,发现低浓度的氧合血红蛋白能够减轻SAH后DCV。
