人参皂苷纳米点的制备工艺探索研究
2021-05-28王新宇孙天霞肖利智匡玉兰姜英男
张 阳,王新宇,孙天霞,肖利智,匡玉兰,赵 雨,姜英男
(长春中医药大学,长春 130117)
人参(Panax ginsengC.A.Mey)作为一种植物源性中草药,自古以来享有“百草之王”的美誉。现代临床证明人参有多种治疗功效,主要归因于人参含有大量多种的生物活性物质,如人参皂苷,挥发油,多糖等[1]。其中人参皂苷是人参中最主要生物活性物质,很多研究证明其在抗肿瘤、抗氧化、抗炎、抗衰老、抗心律失常、抑制细胞凋亡和免疫功能等方面均有很好的作用[2-5]。目前研究人员已从各类人参制品中分离出了60 多种人参皂苷,根据化学结构可分为3 种类型:原人参二醇型、原人参三醇型及齐墩果酸型[6]。其中,人参总皂苷是人参根茎提取加工制成的总皂苷,人参皂苷Rb1、Rb2、Rb3、Rc、Rd、Re、Rf和Rg1的含量较高,约占人参总皂苷的70%[7]。
碳纳米点(carbon nanodots,CDs)作为新兴的纳米材料,具有良好的荧光光学特性[8-10]。CDs 制备方式多样,大多研究以水热反应为主,兼有微波反应,超声反应等。制备CDs 的来源也十分广泛:碳纳米管、柠檬酸、葡萄糖、氨基酸、高分子聚合物和富碳的普通食品用品,如圆葱、柠檬汁、废纸等[11-14]。由于制备成本低、尺寸小、水溶性好、生物相容性高等特点,CDs 近年来一直是纳米材料领域内的研究热点,并在生物医疗领域展现了独有的优势和应用前景[15-18]。
在生物界大量碳源中,还没有人将人参作为反应源制备纳米点并对其化学、生物性质进行考察。而我国作为传统中药大国,中药材种类繁多,资源丰富。因此,本实验预以人参有效药用成分为原料,结合水热法对人参皂苷纳米点制备工艺进行探索,结果表明合成的人参皂苷纳米点具有优良的稳定性和荧光特性,并为后续研究奠定基础。
1 材料和方法
1.1 主要试剂 人参总皂苷粉末(上海源叶生物科技有限公司);蒸馏水(四川沃特尔水处理设备有限公司);氯化钠(北京化工厂);氯化钾(北京化工厂);溴化钾(北京化工厂);磷酸氢二钠(北京化工厂);磷酸二氢钠(北京化工厂)。
1.2 主要仪器 ALC2100.2 型电子天平(赛多利斯公司),AL204 型电子天平(梅特勒-托利多公司),WP-UP-JY-40 型超纯水机(四川沃特尔水处理设备有限公司),Centrifuge 5804 R 型离心机(德国Eppendorf 公司),WFO-400W 型送风定温干燥箱(上海爱朗仪器有限公司),Centrifuge-5804r 型台式高速冷冻离心机(德国Eppendorf 公司),C-MAG hS7 型控温磁力搅拌器(德国IKA 公司),碳支持膜(新兴百瑞公司),Shimadzu RF-5301 型荧光光谱仪(日本岛津公司),UV-2550 型紫外分光光度计(日本岛津公司),Spectra S 型透射电子显微镜(赛默飞世尔科技有限公司),Nicolet AVATAR 360 傅里叶红外光谱仪(Thermo 公司)。
1.3 人参皂苷纳米点制备工艺的研究 精密称取人参总皂苷粉末0.5 g,加入10 mL 去离子水中,磁力搅拌使其溶解。将溶液转移至聚四氟乙烯高压反应釜内,控制不同反应温度(140~200 ℃)和不同反应时间(2~10 h)。反应后,静置冷却至室温,过0.22 μm微孔滤膜,除去大的沉淀物和团聚物,得到人参皂苷纳米点溶液,放置于4 ℃保存。
1.4 人参皂苷纳米点的外貌形态、尺寸大小特征 分别取不同反应溶液至样品瓶中,从颜色、气味、黏稠度、透明度及溶液在室温下的稳定状态进行人参皂苷纳米点的观察分析,再利用TEM 观察尺寸大小。
1.5 人参皂苷纳米点的稳定性考察
1.5.1 不同pH 对人参皂苷纳米点荧光强度的影响 取不同pH(5.8、6.4、7.0、7.4、8.0)的磷酸盐缓冲溶液,分别加入到170 ℃,10 h 水热反应后的纳米点溶液中,混合均匀后,进行荧光强度测试。
1.5.2 不同盐离子对人参皂苷纳米点溶液稳定性的影响 取不同浓度KCl和NaCl溶液,分别加入到170 ℃,10 h 水热反应后的纳米点溶液中,混合均匀,使最终混合液的盐浓度分别达到0.2 mol/L 和2 mol/L,测试人参皂苷纳米点的荧光光谱。
1.5.3 不同放置时间对人参皂苷纳米点溶液稳定性的影响 170 ℃,10 h 水热反应后的纳米点溶液离心过滤处理完成后,放置于室温环境中,分别在0、30、60、90、120、150、180 min 后测试人参皂苷纳米点的荧光光谱。
1.6 人参皂苷纳米点的基础性质表征
1.6.1 荧光(PL)光谱表征 取不同反应条件合成的人参皂苷纳米点溶液,进行荧光光谱测试。
1.6.2 紫外-可见光(UV-vis)光谱表征 取人参皂苷纳米点溶液(170 ℃,10 h)进行紫外光谱测试。
1.6.3 傅里叶变化红外(FT-IR)光谱表征 取适量人参皂苷纳米点溶液(170 ℃,10 h)加入到被研磨好的KBr 中,烘干后压片,进行红外测试。
2 结果
2.1 不同反应条件下人参皂苷纳米点的形貌表征 如表1,图1,2,3 所示,通过宏观性状观察和TEM 共同对不同反应条件合成的人参皂苷纳米点进行外貌和尺寸大小表征。在检验结果中筛选出合适的人参皂苷纳米点的制备工艺条件:200 ℃-6 h,200 ℃-10 h,180 ℃-3 h,180 ℃-6 h,170 ℃-6 h,170 ℃-10 h。这些条件下制备出的人参皂苷纳米点尺寸在2~30 nm之间,尺寸分布窄,且碳点分散均匀不发生聚集,宏观溶液透明不黏稠,处理后状态稳定。
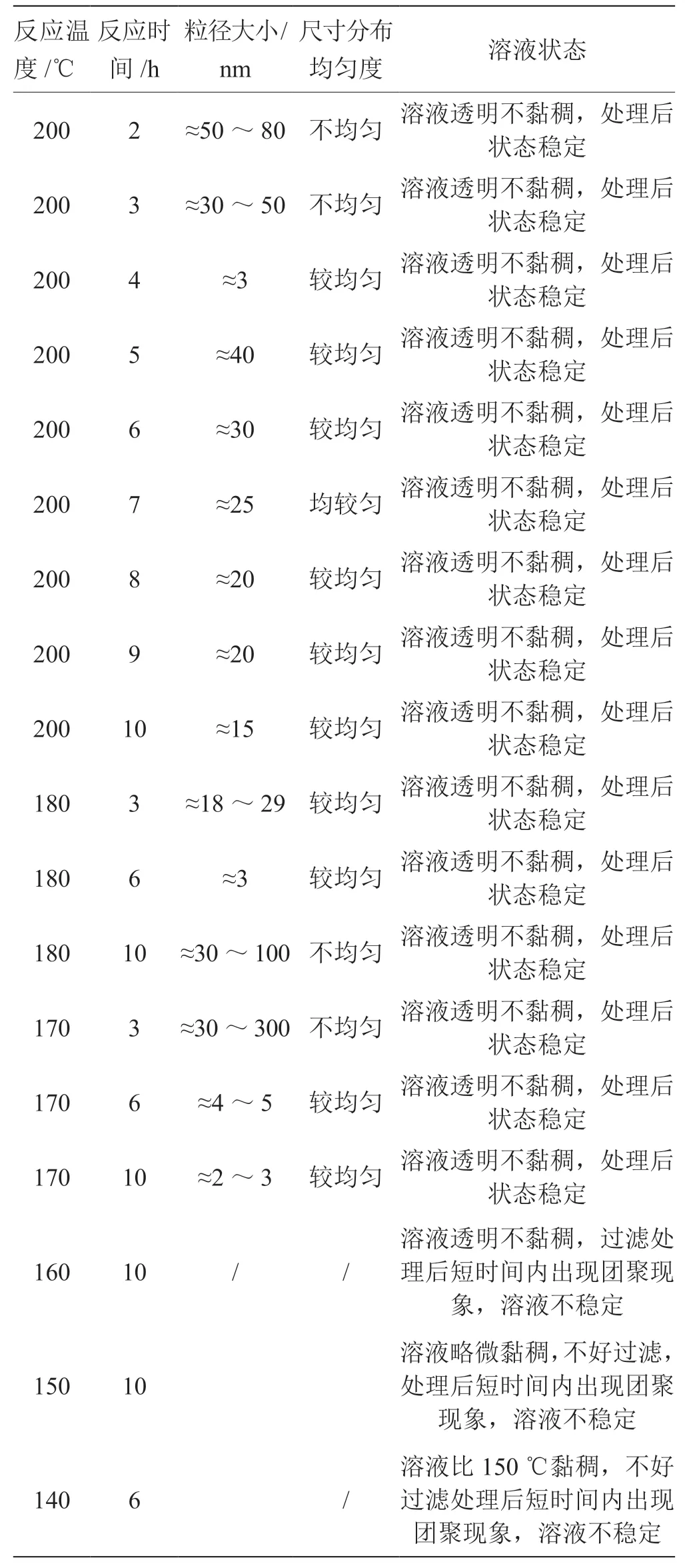
表1 部分不同反应条件下的人参皂苷纳米点的粒径尺寸,分布和溶液状态

图1 200 ℃条件下人参皂苷纳米点TEM 图

图2 180 ℃条件下人参皂苷纳米点TEM 图

图3 170 ℃条件下人参皂苷纳米点TEM 图
2.2 人参皂苷纳米点溶液稳定性测试 对人参皂苷纳米点溶液,进行不同pH、不同盐离子、不同浓度和不同放置时间下的荧光稳定性考察。在不同条件下测得的最佳发射峰强度总结,如图4 所示。纳米点溶液最佳发射峰的荧光强度没有随pH、盐离子浓度和静置时间的改变而发生明显变化。结果表明制备的人参皂苷纳米点性能比较稳定,可以为后续其在生物成像等实验奠定基础。
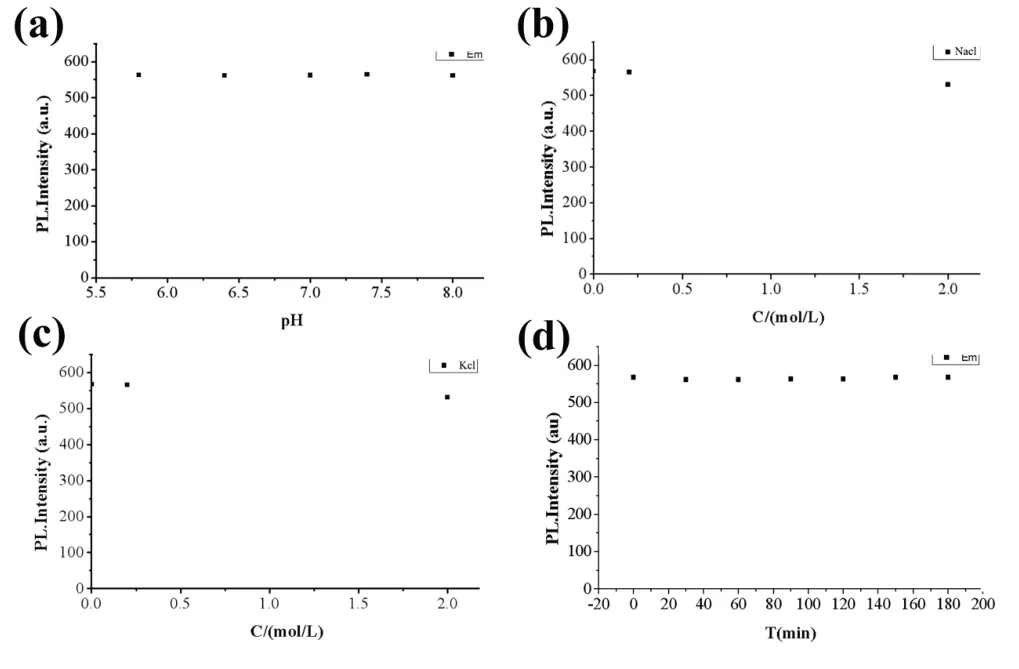
图4 人参皂苷纳米点溶液稳定性测试
2.3 人参皂苷纳米点的基础性质表征
2.3.1 人参皂苷纳米点的荧光光谱分析 对不同反应条件制备的人参皂苷纳米点溶液进行荧光光谱测试,荧光光谱图如图5,人参皂苷纳米点溶液都表现出明显的荧光发射激发依赖性,即随着激发峰增加,发射峰位红移,峰强由最初逐渐增加至最高而后发生下降。(a)-(f)各个谱图荧光变化规律基本相似,荧光发射都是从蓝色向绿色至黄绿色变化,但最佳激发和最佳发射峰位随反应条件不同而有所不同。人参皂苷纳米点激发波长范围在460~495 nm 之间,发射波长范围在550~573 nm 之间。
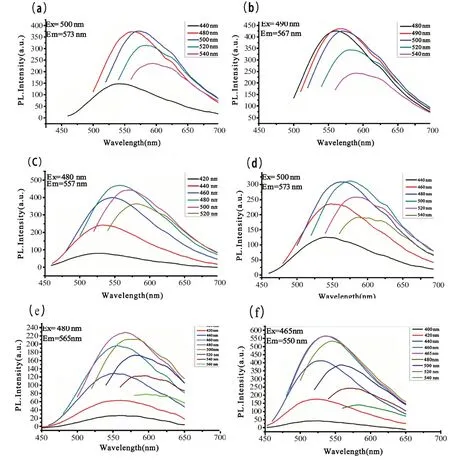
图5 人参皂苷纳米点溶液荧光光谱图
2.3.2 人参皂苷纳米点的UV-vis 光谱分析 反应170 ℃,10 h 时,控制其吸光度值在0.2~0.8 范围内。结果如图6,人参总皂苷溶液图谱中没有明显的紫外吸收峰,皂苷糖苷类分子结构不存在共轭电子对和苯环。而人参皂苷纳米点溶液在280 nm 处有明显的吸收峰,表明其存在活跃电子跃迁。人参皂苷纳米点组吸收峰在280 nm 处,与文献报道的大多数碳点在260~320 nm 有吸收带相吻合,也可以认为是sp2杂化碳引起的n →π*跃迁[19]。
2.3.3 人参皂苷纳米点的FT-IR 光谱解析 由人参皂苷纳米点的红外光谱图,图7 分析可知,3 405 cm-1处出现的峰由O-H 的伸缩振动引起的,2 929 cm-1处出现的峰是C-H 伸缩振动引起,1 653 cm-1处出现的峰是由C=O 拉伸振动引起的;1 397 cm-1处出现的峰是由C-H 弯曲震动引起的,1 078 cm-1处出现的峰的是C-O的吸收峰[20]。FT-IR 红外光谱表明人参皂苷纳米点含有大量的羟基和羧基等多种亲水基团,也说明制备的纳米点具有良好的水溶性和生物相容性。
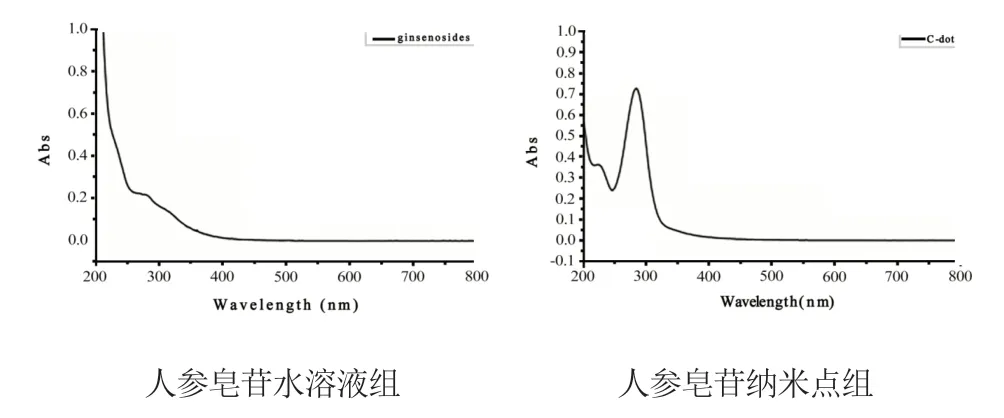
图6 人参皂苷纳米点的UV-vis 光谱分析
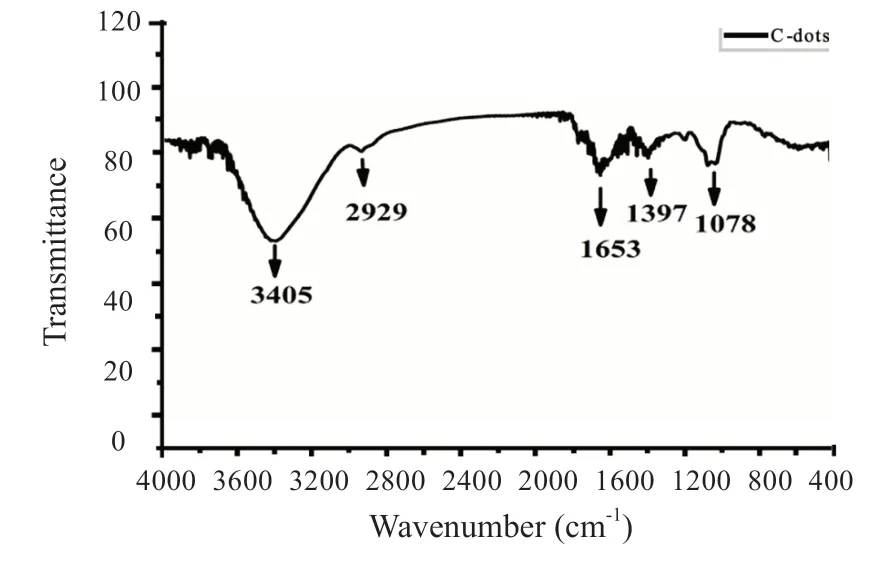
图7 人参皂苷纳米点的FT-IR 红外光谱图
3 讨论
本研究以人参有效活性成分人参总皂苷作为反应源,一步水热法制备出了人参皂苷纳米点。通过对人参皂苷纳米点溶液的状态,粒径大小和分散均匀度等微观形貌,最终筛选出制备人参总皂苷的工艺:反应温度170 ℃,反应6 h、8 h;反应温度180 ℃,反应3 h、6 h;反应温度200 ℃,反应6 h、10 h。制备出的人参皂苷纳米点溶液状态稳定,溶液透明,伴有中药香气。纳米点粒径集中在2~30 nm,粒径分布比较均匀,粒子在水中分散性良好不易发生聚集。实验发现,反应温度越高,人参总皂苷水热反应溶液的状态越稳定,透明度高,越不会发生溶液变色和浑浊,且纳米点的粒径越小越均匀。若要获得性质优良且稳定的人参皂苷纳米点,需要反应温度在170 ℃以上,且时间至少大于3 h,这样才能使得皂苷分子在水热反应中克服能量壁垒,自组装成点。
制备出人参皂苷纳米点对pH(5.8~8.0)、无机盐(浓度在0.2~2 mol/L)均具有较好的荧光稳定性。人参皂苷纳米点溶液都表现出了明显的荧光发射激发依赖性,即随着激发峰增加,发射峰位红移。最佳激发波长范围在460~495 nm 之间,最佳发射波长范围在550~573 nm 之间。对制备溶液的TEM 微观尺寸形貌表征结果,可以确认以人参总皂苷为原料,成功制备出了新型人参皂苷纳米点。紫外光谱、红外光谱测试表明人参皂苷纳米点表面存在大量的亲水基团和丰富的官能团,证明其有良好的水溶性。后序将进行细胞及药理活性研究,为人参皂苷纳米点的生物荧光标记探针开发方面的应用奠定了基础。
