miR-1294靶向TRIM28调控葡萄膜黑色素瘤细胞增殖、迁移和侵袭的分子机制①
2021-05-27王光进何林波冯小梅西南医科大学附属中医医院眼科泸州646000
王光进 何林波 冯小梅(西南医科大学附属中医医院眼科,泸州 646000)
葡萄膜黑色素瘤是眼部疾病中常见恶性肿瘤之一,患者接受手术摘除眼球治疗后仍有大部分患者死亡[1-3]。目前葡萄膜黑色素瘤发病机制尚未完全阐明,因而探讨葡萄膜黑色素瘤发病机制有助于提高该病的治疗效果。微小RNA(microRNA,miR‑NA)是一种非编码单链小RNA分子,并可通过调控细胞增殖、迁移及侵袭过程而参与葡萄膜黑色素瘤等多种肿瘤发生、发展过程[4]。微小RNA-1294(mi‑croRNA-1294,miR-1294)在上皮性卵巢癌中低表达,上调miR-1294的表达可抑制上皮性卵巢癌细胞增殖[5]。miR-1294在口腔鳞状细胞癌组织中表达下调,miR-1294过表达可抑制口腔鳞状细胞癌细胞增殖及迁移[6]。目前尚未见相关文献报道miR-1294与葡萄膜黑色素瘤之间的关系。StarBase预测显示miR-1294与三结构域蛋白28(tripartite motifcontain‑ing protein 28,TRIM28)可能存在靶向调控关系,研究表明TRIM28在胶质瘤组织中表达上调,敲低其表达可抑制胶质瘤细胞的增殖及迁移[7]。但miR-1294是否靶向调控TRIM28而影响葡萄膜黑色素瘤细胞的增殖、迁移及侵袭尚未可知。本研究首次在体外研究miR-1294对葡萄膜黑色素瘤细胞增殖、迁移及侵袭的影响,对探究葡萄膜黑色素瘤的发病机制及提高临床治疗效果、改善患者预后均具有重要意义。
1 材料与方法
1.1 材料 正常葡萄膜上皮细胞系ARPE-19购自南京科佰生物科技有限公司;葡萄膜黑色素瘤细胞系SP6.5、MUM-2B、C918购自中国科学院上海生命科学研究院细胞资源中心。杜氏改良培养基(DMEM)、胰蛋白酶、胎牛血清均购自美国Gibco公司;Lipofectamine2000购自美国Thermo Fisher公司;miR-1294模拟物(mimics)及其阴性对照(miR-NC)、TRIM28小干扰RNA(si-TRIM28)、乱序无意义阴性序列(si-NC)、miR-1294特异性寡核苷酸抑制剂(an‑ti-miR-1294)及其阴性对照(anti-miR-NC)均购自广州锐博生物科技有限公司;Trizol购自美国Invitrogen公司;反转录试剂盒、SYBR Green试剂盒购自大连宝生物工程有限公司;甲基噻唑基四唑(methylthia‑zolyl tetrazolium,MTT)购自重庆普立科生物技术有限公司;Transwell小室购自美国Corning公司;Matri‑gel基质胶购自美国BD公司;蛋白裂解液购自北京全式金生物技术有限公司;二喹啉甲酸(bicincho‑ninicacid,BCA)蛋白定量检测试剂盒购自湖南艾佳生物科技股份有限公司;兔抗人细胞周期蛋白1(Cy‑clinD1)、p21、p27抗体购自美国CST公司;兔抗人基质金属蛋白酶-2(matrix metalloproteinases-2,MMP-2)、基质金属蛋白酶-9(matrix metalloproteinases-9,MMP-9)、基质金属蛋白酶-14(matrix metalloprotein‑ases-14,MMP-14)抗体均购自美国Santa Cruz公司;兔抗人TRIM28多克隆抗体购自北京博蕾德生物科技有限公司;辣根过氧化物酶(HRP)标记的山羊抗兔IgG二抗购自武汉博士德生物工程有限公司。
葡萄膜黑色素瘤组织与癌旁组织来源:选取2017年6月至2018年10月本院收集的26例葡萄膜黑色素瘤患者为研究对象,所有患者均经病理证实为葡萄膜黑色素瘤,其中男15例,女11例,年龄46~70岁,平均年龄(59.74±6.57)岁,术中切除葡萄膜黑色素瘤组织与癌旁组织,本研究经本院伦理委员会批准,所有患者知情并签署同意书。
1.2 方法
1.2.1 细胞转染及实验分组 正常葡萄膜上皮细胞系ARPE-19、葡萄膜黑色素瘤细胞系SP6.5、MUM-2B、C918细胞培养于含有10%胎牛血清的DMEM培养基,培养条件:37℃、5%CO2培养箱,待细胞生长融合度达到80%~90%时进行传代培养,取第3~5代细胞进行后续实验。取对数生长期葡萄膜黑色素瘤SP6.5细胞,实验分组:miR-NC组(miR-NC转染至SP6.5细胞)、miR-1294组(miR-1294 mimics转染至SP6.5细胞)、si-NC组(si-NC转染至SP6.5细胞)、si-TRIM28组(si-TRIM28转染至SP6.5细胞)、miR-1294+pcDNA组(miR-1294 mimics与pcDNA共转染至SP6.5细胞)、miR-1294+pcDNA-TRIM28组(miR-1294 mimics与pcDNA-TRIM28共转染至SP6.5细胞),转染过程均按照Lipofectamine2000试剂盒说明书进行操作,转染前1 h更换为不含胎牛血清的DMEM培养基,转染6 h后更换为含有10%胎牛血清的DMEM培养基,继续培养48 h收集细胞进行功能验证实验。为验证miR-1294是否靶向调控TRIM28的表达,取生长状态良好的SP6.5细胞,实验分组miR-NC组、miR-1294组、anti-miR-NC组(anti-miRNC转染至SP6.5细胞)、anti-miR-1294组(anti-miR-1294转染至SP6.5细胞)。
1.2.2 qRT-PCR检测细胞中miR-1294、TRIM28 mRNA表达水平 采用Trizol法提取葡萄膜黑色素瘤组织与癌旁组织及细胞系总RNA,参照反转录试剂盒合成cDNA,miR-1294正向引物5′-TGTGTGC‑CAAGATCTGTTCA-3′,反向引物:5′-AGTTTCACCTCACTGCGTCCT-3′;GAPDH正向引物5′-GGAGC‑GAGATCCCTCCAAAAT-3′,反向引物:5′-GGCT‑GTTGTCATACTTCTCATGG-3′;TRIM28正向引物5′-AGCGGGTGAAGTACACCAAG-3′,反向引物:5′-ACCCAAAGCCATAGCCTTCC-3′;U6正向引物5′-ATTGGAACGATACAGAGAAGATT-3′,反向引物:5′-GGAACGCTTCACGAATTTG-3′,引物由上海生工生物工程股份有限公司设计合成。以cDNA为模板进行qRT-PCR反应,反应体系:SYBR Premix Ex TaqⅡ(2×)10µl,cDNA 2µl,上下游引物各0.8µl,ROX Reference Dye(50×)0.4µl,ddH2O 6µl;反应条件:95℃2 min(循环1次),95℃30 s,60℃30 s,72℃30 s(循环40次)。TRIM28以GAPDH为内参,miR-1294以U6为内参,采用2-ΔΔCt法 计 算miR-1294、TRIM28 mRNA相对表达量。
1.2.3 MTT检测细胞增殖 取各组葡萄膜黑色素瘤SP6.5细胞,采用0.25%胰蛋白酶消化细胞,制备单细胞悬液后接种于96孔板,分别于转染24 h、48 h、72 h时每孔加入20µl MTT溶液,室温孵育4 h,弃旧培养基,每孔加入150µl二甲基亚砜(di‑methylsulfoxide,DMSO),充分混匀,应用酶标仪检测波长490 nm处各孔吸光度值(OD),实验重复3次。
1.2.4 Transwell实验检测细胞迁移 取对数生长期葡萄膜黑色素瘤SP6.5细胞,0.25%胰蛋白酶消化,加入DMEM培养液制备单细胞悬液(5×104个/ml),Transwell小室的上室中每孔加入200µl细胞悬液,Transwell小室的下室每孔加入600µl含有10%胎牛血清的DMEM培养液,置于37℃、5%CO2培养箱内培养24 h,PBS洗涤后采用多聚甲醛固定10 min,0.1%结晶紫染液染色10 min,采用棉签擦拭未迁移细胞,置于显微镜下观察迁移细胞数。
1.2.5 Transwell实验检测细胞侵袭 采用预冷培养液按照9:1比例稀释Matrigel基质胶,Transwell小室上室中每孔加入40µl Matrigel稀释液,室温孵育5 h。取对数生长期葡萄膜黑色素瘤SP6.5细胞,预冷PBS洗涤,0.25%胰蛋白酶消化细胞后加入不含胎牛血清的培养液制备单细胞悬液(5×104个/ml),Transwell小室的上室中每孔加入200µl单细胞悬液,Transwell小室的下室中每孔加入600µl含有10%胎牛血清的培养液,37℃、5%CO2培养箱培养24 h,PBS洗涤,多聚甲醛固定10 min,0.1%结晶紫染液染色10 min,使用棉签擦拭未侵袭细胞,显微镜下观察侵袭细胞数。
1.2.6 双荧光素酶报告基因检测StarBase预测显示TRIM28的3′UTR中含有与miR-1294互补的核苷酸序列,利用基因突变技术将结合位点进行突变,分别将含有TRIM28的3′UTR结合位点序列及突变位点序列载入荧光素酶报告基因载体构建野生型载体WT-TRIM28与突变型载体MUT-TRIM28,取生长状态良好的葡萄膜黑色素瘤SP6.5细胞,分别 将WT-TRIM28、MUT-TRIM28与miR-NC、miR-1294 mimics共转染至SP6.5细胞,继续培养24 h,收集细胞后检测各组细胞荧光素酶活性。
1.2.7 Western blot检测TRIM28、CyclinD1、p21、p27、MMP-2、MMP-9、MMP-14蛋白表达 取各组对数生长期葡萄膜黑色素瘤SP6.5细胞,加入适量的蛋白裂解液,冰上裂解30 min后提取细胞总蛋白,应用BCA蛋白定量检测试剂盒测定蛋白浓度,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAG-E)分离蛋白,反应结束后将其转移至PVDF膜,5%脱脂奶粉封闭2 h,室温条件下孵育一抗稀释液(TRIM28 1:500,CyclinD1 1:1 000,p21、p27 1:500,MMP-2、MMP-9、MMP-14 1:1 000),4℃孵育过夜,TBST洗涤,孵育二抗稀释液(1:2 000),室温孵育1 h,TBST洗涤,显影,应用凝胶成像分析系统及Im‑age J软件分析各条带灰度值。
1.3 统计学处理 采用SPSS21.0统计学软件分析数据,计量资料以±s表示且均符合正态分布,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 miR-1294和TRIM28在葡萄膜黑色素瘤中的表达 与正常葡萄膜上皮细胞系ARPE-19相比,葡萄膜黑色素瘤细胞系SP6.5、MUM-2B、C918中miR-1294的表达水平显著降低(P<0.05),TRIM28 mRNA及蛋白的表达水平显著升高(P<0.05),其中miR-1294在葡萄膜黑色素瘤SP6.5细胞中的表达水平明显降低,见图1、表1。与瘤旁组织比较,葡萄膜黑色素瘤组织中miR-1294的表达水平显著降低(P<0.05),TRIM28mRNA及蛋白的表达水平显著升高(P<0.05),见表2。因而选用葡萄膜黑色素瘤SP6.5细胞进行后续研究。

图1 TRIM28蛋白表达Fig.1 Protein expression of TRIM28
表1 miR-1294和TRIM28在葡萄膜黑色素瘤细胞中的表达(±s,n=9)Tab.1 Expression of miR-1294 and TRIM28 in uveal mel-anoma cells(±s,n=9)
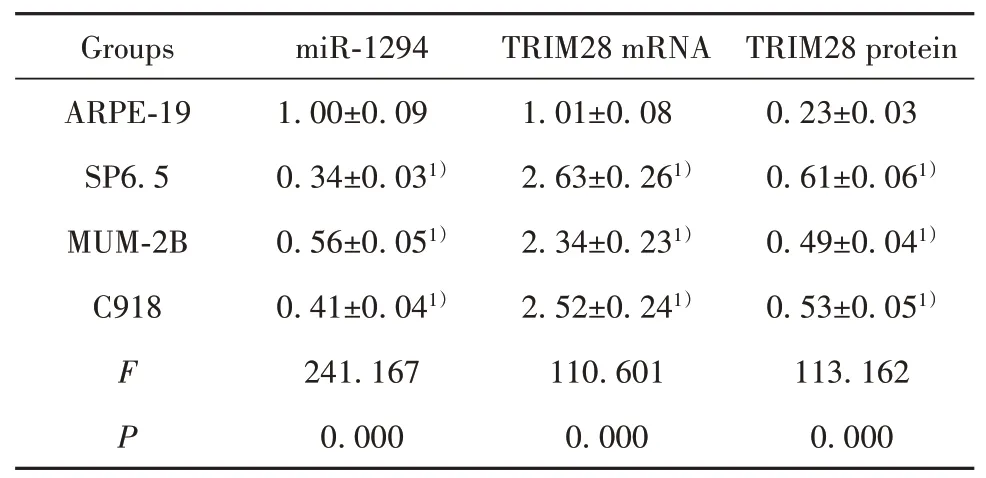
表1 miR-1294和TRIM28在葡萄膜黑色素瘤细胞中的表达(±s,n=9)Tab.1 Expression of miR-1294 and TRIM28 in uveal mel-anoma cells(±s,n=9)
Note:Compared with ARPE-19 group,1)P<0.05.
TRIM28 protein 0.23±0.03 0.61±0.061)0.49±0.041)0.53±0.051)113.162 0.000 Groups ARPE-19 SP6.5 MUM-2B C918 F P miR-1294 1.00±0.09 0.34±0.031)0.56±0.051)0.41±0.041)241.167 0.000 TRIM28 mRNA 1.01±0.08 2.63±0.261)2.34±0.231)2.52±0.241)110.601 0.000
表2 miR-1294和TRIM28在葡萄膜黑色素瘤组织及瘤旁组织中的表达(±s,n=26)Tab.2 Expression of miR-1294 and TRIM28 in uveal mel-anoma and peritumoral tissues(±s,n=26)
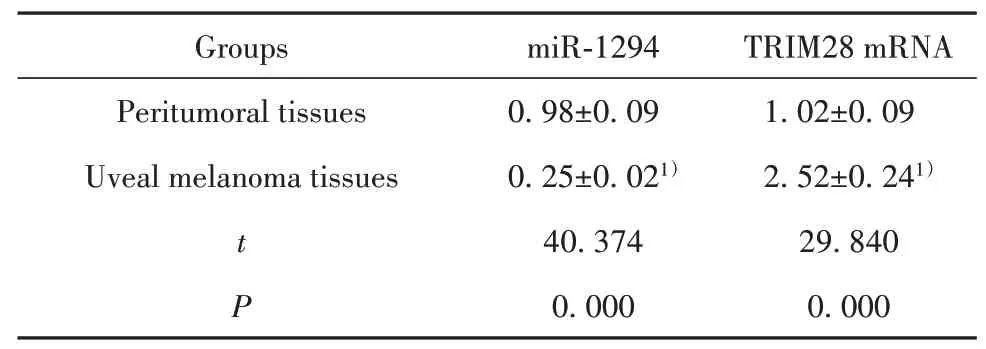
表2 miR-1294和TRIM28在葡萄膜黑色素瘤组织及瘤旁组织中的表达(±s,n=26)Tab.2 Expression of miR-1294 and TRIM28 in uveal mel-anoma and peritumoral tissues(±s,n=26)
Note:Compared with peritumoral tissues group,1)P<0.05.
TRIM28 mRNA 1.02±0.09 2.52±0.241)29.840 0.000 Groups Peritumoral tissues Uveal melanoma tissues t P miR-1294 0.98±0.09 0.25±0.021)40.374 0.000
2.2 miR-1294过表达对葡萄膜黑色素瘤细胞SP6.5增殖的影响 与miR-NC组比较,miR-1294组葡萄膜黑色素瘤SP6.5细胞中miR-1294的表达水平显著升高(P<0.05),细胞活力显著降低(P<0.05),CyclinD1蛋白相对表达量显著降低(P<0.05),p21、p27蛋白相对表达量均显著升高(P<0.05),见图2、表3。
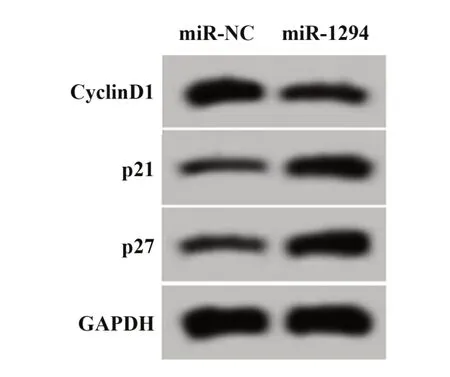
图2 增殖相关蛋白表达Fig.2 Proliferation-related proteins expressions
表3 miR-1294过表达对葡萄膜黑色素瘤细胞SP6.5增殖的影响(±s,n=9)Tab.3 Effects of miR-1294 overexpression on proliferation of uveal melanoma cells SP6.5(±s,n=9)

表3 miR-1294过表达对葡萄膜黑色素瘤细胞SP6.5增殖的影响(±s,n=9)Tab.3 Effects of miR-1294 overexpression on proliferation of uveal melanoma cells SP6.5(±s,n=9)
Note:Compared with miR-NC group,1)P<0.05.
OD(490 nm)Groups miR-1294 CyclinD1 p27 p21 0.29±0.03 0.68±0.051)20.065 0.000 24 h 0.39±0.04 0.36±0.03 1.800 0.090 48 h 0.73±0.06 0.45±0.041)11.648 0.000 72 h 1.14±0.09 0.58±0.051)16.317 0.000 miR-NC miR-1294 t P 1.00±0.08 2.36±0.231)16.754 0.000 0.76±0.07 0.31±0.031)17.726 0.000 0.25±0.03 0.63±0.061)16.994 0.000
2.3 miR-1294过表达对葡萄膜黑色素瘤细胞SP6.5迁移、侵袭的影响 与miR-NC组比较,miR-1294组葡萄膜黑色素瘤SP6.5细胞迁移细胞数与侵袭细胞数均显著减少(P<0.05),MMP-2、MMP-9、MMP-14蛋白相对表达量显著降低(P<0.05),见表4、图3。
表4 miR-1294过表达对葡萄膜黑色素瘤细胞SP6.5迁移、侵袭的影响(±s,n=9)Tab.4 Effect of miR-1294 overexpression on migration and invasion of uveal melanoma cells SP6.5(±s,n=9)

表4 miR-1294过表达对葡萄膜黑色素瘤细胞SP6.5迁移、侵袭的影响(±s,n=9)Tab.4 Effect of miR-1294 overexpression on migration and invasion of uveal melanoma cells SP6.5(±s,n=9)
Note:Compared with miR-NC group,1)P<0.05.
MMP-14 protein 0.74±0.07 0.32±0.031)16.544 0.000 Groups miR-NC miR-1294 t P Number of migrating cells 106.54±9.36 49.87±4.581)16.315 0.000 Number of invasion cells 83.45±8.31 37.65±4.241)13.431 0.000 MMP-2 protein 0.67±0.03 0.25±0.031)29.698 0.000 MMP-9 protein 0.83±0.07 0.39±0.041)16.372 0.000

图3 miR-1294过表达对葡萄膜黑色素瘤细胞SP6.5迁移、侵袭的影响Fig.3 Effects of miR-1294 overexpression on migration and invasion of uveal melanoma cells SP6.5Note:A.Transferring and invasion-related protein expression;B.Migra‑tion and invasion of uveal melanoma cell SP6.5.
2.4 干扰TRIM28表达对葡萄膜黑色素瘤细胞SP6.5增殖、迁移、侵袭的影响 与si-NC组比较,si-TRIM28组葡萄膜黑色素瘤SP6.5细胞活力显著降低(P<0.05),迁移细胞数与侵袭细胞数均显著减少(P<0.05),CyclinD1、MMP-2、MMP-9蛋白相对表达量均显著降低(P<0.05),p21蛋白相对表达量显著升高(P<0.05),见图4、表5。
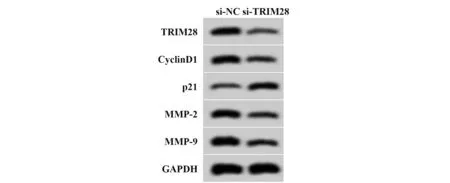
图4 干扰TRIM28表达对葡萄膜黑色素瘤细胞SP6.5增殖、迁移、侵袭的影响Fig.4 Effect of interference with TRIM28 expression on proliferation,migration and invasion of uveal mela-noma cells SP6.5
2.5 miR-1294靶向调控TRIM28的表达starBase预测显示TRIM28的3′UTR中含有与miR-1294互补的核苷酸序列,见图5A。双荧光素酶报告实验结果显示,转染克隆有TRIM28-3′UTR突变型载体质粒实验中,miR-1294组与miR-NC组比较,荧光素酶活性差异无显著性(P>0.05);转染克隆有TRIM28-3′UTR载体质粒实验中,miR-1294组荧光素酶活性明显低于miR-NC组(P<0.05),见表6。Western blot检测结果显示,与miR-NC组相比,miR-1294组葡萄膜黑色素瘤SP6.5细胞中TRIM28蛋白相对表达量显著降低(P<0.05);与anti-miR-NC组比较,antimiR-1294组葡萄膜黑色素瘤SP6.5细胞中TRIM28蛋白相对表达量显著升高(P<0.05),见图5B、表7。
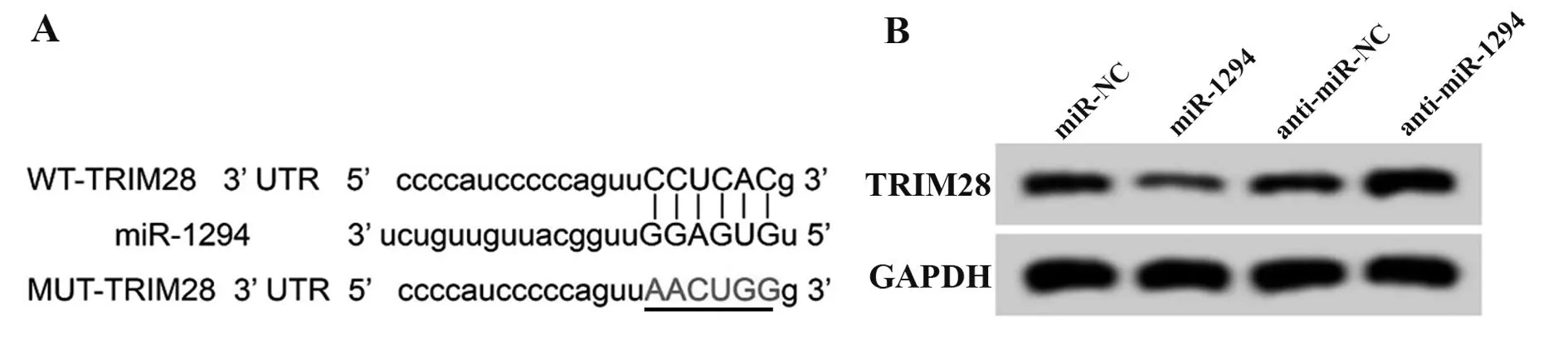
图5 miR-1294靶向调控TRIM28的表达Fig.5 miR-1294 regulates expression of TRIM28
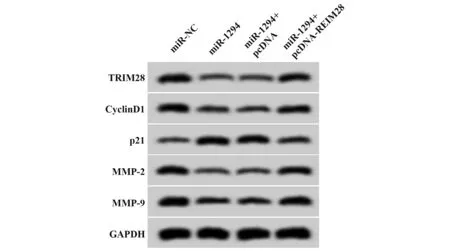
图6 TRIM28过表达逆转miR-1294过表达对葡萄膜黑色素瘤细胞SP6.5增殖、迁移侵袭的作用Fig.6 TRIM28 overexpression reversed effect of miR-1294 overexpression
2.6 TRIM28过表达逆转了miR-1294过表达对葡萄膜黑色素瘤细胞SP6.5增殖、迁移和侵袭的作用 实验结果显示,与miR-1294+pcDNA组比较,miR-1294+pcDNA-TRIM28组葡萄膜黑色素瘤SP6.5细胞活力显著升高(P<0.05),迁移细胞数与侵袭细胞数均明显增多(P<0.05),CyclinD1、MMP-2、MMP-9蛋白相对表达量均显著升高(P<0.05),p21蛋白相对表达量显著降低(P<0.05),见图6、表8。
表5 干扰TRIM28表达对葡萄膜黑色素瘤细胞SP6.5增殖、迁移、侵袭的影响(±s,n=9)Tab.5 Effect of interference with TRIM28 expression on proliferation,migration and invasion of uveal melanoma cells SP6.5(±s,n=9)

表5 干扰TRIM28表达对葡萄膜黑色素瘤细胞SP6.5增殖、迁移、侵袭的影响(±s,n=9)Tab.5 Effect of interference with TRIM28 expression on proliferation,migration and invasion of uveal melanoma cells SP6.5(±s,n=9)
Note:Compared with si-NC group,1)P<0.05.
OD(490 nm)Groups TRIM28 protein CyclinD1 protein p21 protein MMP-2 protein MMP-9 protein 24 h 48 h 72 h Number of migrating cells 0.40±0.04 0.38±0.03 1.200 0.247 si-NC si-TRIM28 t P 0.62±0.06 0.27±0.031)15.625 0.000 0.72±0.07 0.54±0.051)6.277 0.000 1.13±0.09 0.66±0.061)13.035 0.000 108.87±9.63 53.64±5.311)15.066 0.000 Number of in‑vasion cells CyclinD1 protein 88.31±8.36 47.69±4.481)12.848 0.000 0.77±0.06 0.39±0.031)16.994 0.000 0.23±0.03 0.59±0.051)18.521 0.000 0.68±0.06 0.29±0.031)17.441 0.000 0.84±0.07 0.43±0.041)15.256 0.000
表6 双荧光素酶报告实验(±s,n=9)Tab.6 Dual luciferase reporter experiment(±s,n=9)

表6 双荧光素酶报告实验(±s,n=9)Tab.6 Dual luciferase reporter experiment(±s,n=9)
Note:Compared with miR-NC,1)P<0.05.
MUT-TRIM28 1.00±0.08 0.98±0.09 0.498 0.625 Groups miR-NC miR-1294 WT-TRIM28 1.02±0.09 0.41±0.041)18.580 0.000 t P
表7 miR-1294调控TRIM28蛋白的表达(±s,n=9)Tab.7 miR-1294 regulates expression of TRIM28 protein(±s,n=9)

表7 miR-1294调控TRIM28蛋白的表达(±s,n=9)Tab.7 miR-1294 regulates expression of TRIM28 protein(±s,n=9)
Note:Compared with miR-NC,1)P<0.05;Compared with anti-miR-NC,2)P<0.05.
TRIM28 protein 0.58±0.05 0.23±0.031)0.56±0.05 0.94±0.082)246.317 0.000 Groups miR-NC miR-1294 anti-miR-NC anti-miR-1294 FP
表8 TRIM28过表达逆转miR-1294过表达对葡萄膜黑色素瘤细胞SP6.5增殖、迁移侵袭的作用(±s,n=9)Tab.8 TRIM28 overexpression reversed effects of miR-1294 overexpression on proliferation,migration and invasion of uveal melanoma cells SP6.5(±s,n=9)

表8 TRIM28过表达逆转miR-1294过表达对葡萄膜黑色素瘤细胞SP6.5增殖、迁移侵袭的作用(±s,n=9)Tab.8 TRIM28 overexpression reversed effects of miR-1294 overexpression on proliferation,migration and invasion of uveal melanoma cells SP6.5(±s,n=9)
Note:Compared with miR-NC,1)P<0.05;compared with miR-1294+pcDNA,2)P<0.05.
OD490 nm Groups TRIM28 protein p21 protein 24 h 48 h 72 h Number of migrating cells 109.32±9.64 48.69±4.851)46.87±4.66 Number of invasion cells 85.36±8.41 39.62±3.911)37.66±3.82 CyclinD1 protein MMP-2 protein MMP-9 protein miR-NC miR-1294 miR-1294+pcDNA miR-1294+pcDNATRIM28 0.63±0.05 0.21±0.031)0.22±0.02 0.41±0.04 0.37±0.03 0.35±0.03 0.74±0.07 0.49±0.041)0.47±0.04 1.15±0.09 0.69±0.061)0.64±0.05 0.79±0.06 0.33±0.031)0.31±0.03 0.24±0.03 0.64±0.061)0.65±0.06 0.69±0.06 0.27±0.031)0.26±0.03 0.82±0.07 0.38±0.031)0.37±0.04 0.51±0.052)0.39±0.04 0.61±0.052)0.93±0.08 89.36±8.252)71.45±7.132)0.67±0.062)0.36±0.032)0.57±0.052)0.69±0.06 166.800 0.000 F P 253.857 0.000 4.800 0.007 52.839 0.000 96.742 0.000 166.374 0.000 133.110 0.000 234.000 0.000 168.366 0.000 213.379 0.000
3 讨论
葡萄膜黑色素瘤可严重影响患者视功能,针对原发性葡萄膜黑色素瘤的治疗方法主要包括手术与放疗,但针对转移性葡萄膜黑色素瘤尚无有效治疗方法[8]。既往研究证实部分miRNA的异常表达在葡萄膜黑色素瘤发生及发展过程中发挥重要作用,并可通过调控下游靶基因表达而发挥抑癌或致癌作用[9-10]。目前仍有部分miRNA在葡萄膜黑色素瘤发生及发展中的作用机制尚未阐明,因而本研究积极探寻新型miRNA并分析其在葡萄膜黑色素瘤中可能的分子机制,为葡萄膜黑色素瘤治疗提供新方向。
miR-1294在透明细胞肾细胞癌中表达下调,并可能通过靶向调控HOXA6的表达而发挥抑癌作用[11]。研究表明miR-1294的表达下调预示胃癌患者的预后不良[12]。相关报道指出miR-1294的表达下调可促使C-MYC表达水平升高进而促进食管鳞状细胞癌发生及发展[13]。与上述报道结果相似,本研究结果显示miR-1294在葡萄膜黑色素瘤细胞系中的表达水平低于正常葡萄膜上皮细胞系,提示miR-1294的表达水平降低可能促进葡萄膜黑色素瘤的发生。本研究进一步观察miR-1294过表达对葡萄膜黑色素瘤细胞增殖、迁移及侵袭的影响,结果显示miR-1294过表达后葡萄膜黑色素瘤细胞增殖能力明显降低,迁移与侵袭细胞数均显著减少,提示miR-1294过表达可降低葡萄膜黑色素瘤细胞增殖、迁移及侵袭能力。为进一步验证miR-1294影响葡萄膜黑色素瘤细胞增殖、迁移及侵袭能力的分子机制,本研究检测细胞增殖、迁移及侵袭相关蛋白表达,结果显示miR-1294过表达后葡萄膜黑色素瘤细胞中CyclinD1、MMP-2、MMP-9、MMP-14蛋白表达水平均显著降低,p21、p27蛋白表达水平均显著升高,相关研究表明,CyclinD1与细胞蛋白依赖性激酶可结合形成复合物从而正向调控细胞周期进程,p21、p27作为细胞周期蛋白依赖性激酶抑制剂的一员,其可通过抑制细胞蛋白依赖性激酶活性而负向调控细胞周期进程[14-15]。细胞外基质降解是肿瘤发生侵袭及浸润的先决条件,其中基质金属蛋白酶类可通过降解细胞外基质中的大分子蛋白从而促进肿瘤浸润及转移,研究表明MMP-2、MMP-9、MMP-14等基质金属蛋白酶类在多种肿瘤组织及其细胞中均呈高表达,并可增强肿瘤细胞侵袭及转移能力从而促进肿瘤进展[16]。本研究结果提示miR-1294过表达可能通过降低CyclinD1、MMP-2、MMP-9、MMP-14的表达水平及提高p21、p27的表达水平从而减弱葡萄膜黑色素瘤细胞增殖、迁移及侵袭能力。
TRIM28在结直肠癌、食管鳞癌等肿瘤组织中表达水平升高,并可参与肿瘤发生发展过程[17-18]。研究表明miR-140-3p可通过直接下调TRIM28的表达而抑制乳腺癌细胞增殖及迁移[19]。相关报道指出抑制TRIM28的表达可抑制非小细胞肺癌裸鼠移植瘤的生长并可促进细胞凋亡[20]。本研究结果显示TRIM28在葡萄膜黑色素瘤细胞中呈高表达,通过抑制TRIM28的表达,结果发现葡萄膜黑色素瘤细胞活力显著降低,迁移与侵袭细胞数均明显减少,CyclinD1、MMP-2、MMP-9蛋白表达水平显著降低,p21蛋白表达水平显著升高,提示干扰TRIM28的表达可能通过调控细胞增殖、迁移及侵袭相关蛋白表达从而降低葡萄膜黑色素瘤细胞增殖、迁移及侵袭能力。本研究通过双荧光素酶报告实验与Western blot实验证实miR-1294能够特异性结合TRIM28,并可负向调控TRIM28的表达。进一步实验结果显示,miR-1294过表达联合TRIM28过表达后,葡萄膜黑色素瘤细胞活力明显增强,迁移与侵袭细胞数明显增多,CyclinD1、MMP-2、MMP-9蛋白表达水平明显升高,p21蛋白表达水平明显降低,提示miR-1294过表达可通过下调TRIM28的表达从而抑制葡萄膜黑色素瘤细胞增殖、迁移及侵袭。
综上所述,miR-1294在葡萄膜黑色素瘤细胞中表达下调,而TRIM28的表达上调,miR-1294可能通过靶向TRIM28而调控葡萄膜黑色素瘤细胞增殖、迁移及侵袭,miR-1294在葡萄膜黑色素瘤发生及发展过程中发挥抑癌基因作用,可能成为葡萄膜黑色素瘤治疗的潜在靶点。
