TLR2、IL-10 mRNA的表达及树突状细胞分布在外阴硬化性苔藓中的临床意义①
2021-05-27王楠楠刘嗣同中国医科大学附属第一医院妇科沈阳110000
王楠楠 王 婧 刘嗣同 武 昕(中国医科大学附属第一医院妇科,沈阳 110000)
外阴硬化性苔藓(vulvar sclerosing lichen,VLS)是妇科常见的一种慢性难治性疾病,表现为女性外阴瘙痒、皮肤色素脱失、萎缩,严重者出现尿道口和阴道口狭窄,恶变率为2%~4%[1]。目前病因和发病机制尚不清楚,可能与自身免疫、感染、性激素和遗传有关,也没有较好的治疗方法。因此,探讨VLS发病机制是临床上亟待解决的问题。因其真皮内可见大量的淋巴细胞和浆细胞浸润,故多数学者认为它是一种与自身免疫有关的疾病[1]。前期研究发现VLS中促炎因子干扰素-γ、肿瘤坏死因子-α和白介素-1,2等明显增多,而抗炎因子研究较少(IL-10)在VLS中表达情况尚未见报道[2-3]。Toll样受体(TLR)是连接固有免疫与适应性免疫的桥梁,TLR广泛分布于多种细胞表面,其中TLR-2表达范围最广,TLR-2主要存在淋巴细胞、浆细胞和树突状细胞表面,TLR-2通过影响T辅助细胞1(T helper cell1,Th1)和T辅助细胞2(T helper cell 2,Th2)的平衡,引起IFN-γ分泌降低,IL-10分泌相对升高,来抑制免疫反应[4-5]。前期本课题组检测到淋巴细胞CD4、CD8在VLS中真皮层明显增多,而树突状细胞在VLS形成和发展作用如何?TLR2和IL-10是否表达异常,与病变关系如何?目前尚不清楚,因此,本研究探讨TLR2、IL-10 mRNA和树突状细胞在VLS病变形成中作用。
1 资料与方法
1.1 资料
1.1.1 一般资料 选取2016至2018年在中国医科大学附属第一医院妇科手术或活检的VLS标本50例(早期和进展期各25例),外阴正常皮肤(源于外阴整形手术切除的正常组织)15例。部分福尔马林溶液固定用于免疫组化实验;部分新鲜标本-80℃保存,用于PCR实验。所有标本诊断均经2位病理医生证实。本研究已通过中国医科大学附属第一医院伦理委员会审查。
1.1.2 主要试剂 鼠抗人CD1α单克隆抗体、通用S-P超敏试剂盒(福州迈新生物技术有限公司);miRNeasy Mini Kit试剂盒(德国Qiagen公司);β-actin、IL-10、TLR2引物(美国Invitrogen公司);A5001反转录试剂盒及A6001 Real Time PCR试剂盒(美国Pro‑mega公司)。
1.2 方法
1.2.1 免疫组化检测4µm石蜡切片,脱蜡至水,枸橼酸缓冲液热抗原修复,采用免疫组织化学S-P法对CD1α细胞进行染色。滴加过氧化物酶阻断溶液(试剂A)室温下孵育10 min,正常非免疫动物血清(试剂B)室温下孵育20 min,再加一抗(CD1α单抗1∶100),37℃孵育1 h,生物素标记的二抗(试剂C)室温下孵育30 min,链霉菌抗生物素-过氧化物酶溶液(试剂D)室温下孵育30 min,DAB呈色后苏木素复染。以PBS代替一抗作阴性对照。切片脱水后封片保存。
1.2.2 PCR检测
1.2.2.1 总RNA的提取 使用miRneasy Mini Kit试剂盒抽提全部30例标本组织RNA,操作按说明书进行,RNA样品保存于-80℃冰箱。
1.2.2.2 RNA的逆转录 ①取一定量模板RNA加入引物。②模板RNA与引物的混合物,70℃、5 min预变性,完成后取出置于冰上。③配置RT-Mix,向每个样品管加入10µl RT-Mix,见表1。④设置反转录程序,包括退火(25℃,5 min)、延伸(42℃,60 min)、逆转录酶失活(70℃,15 min)三步。程序完成后得到cDNA,并存于-20℃冰箱,(按照promega A5001试剂说明书操作)。
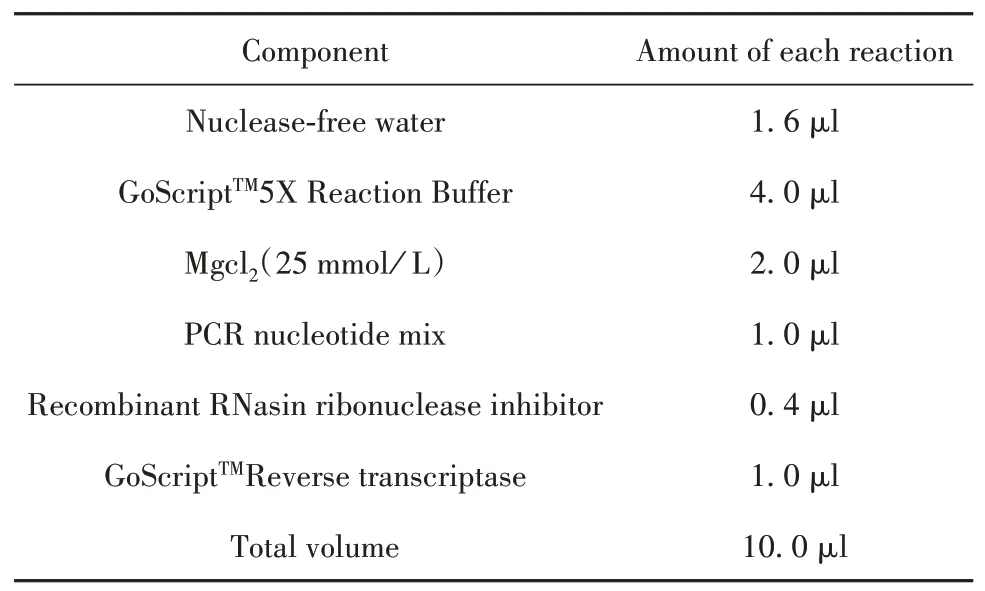
表1 RT-Mix具体配置方法Tab.1 Specific configuration method of RT-Mix
1.2.2.3 RT-PCR(按照promega A6001试剂说明书操作)①按表2配置PCR反应混合液,并分至各反应管,然后加入2µl模板。②反应体系加入96孔板,加盖光学封口膜,离心后放入ABI 7900HT荧光定量PCR仪,PCR反应条件为:95℃2 min,95℃15 s,60℃60 s,40个循环,实验重复3次。③完成RTPCR后对其溶解曲线进行分析,并结合琼脂糖分析PCR产物是否特异。分析PCR反应曲线,所得出的数据按2-ΔΔCT法计算出基因表达的相对量。本实验涉及的引物,β-actin由Invitrogen公司设计,具体引物如下,见表3。

表2 PCR反应混合液具体配置方法Tab.2 Specific configuration method of PCR reaction mixture
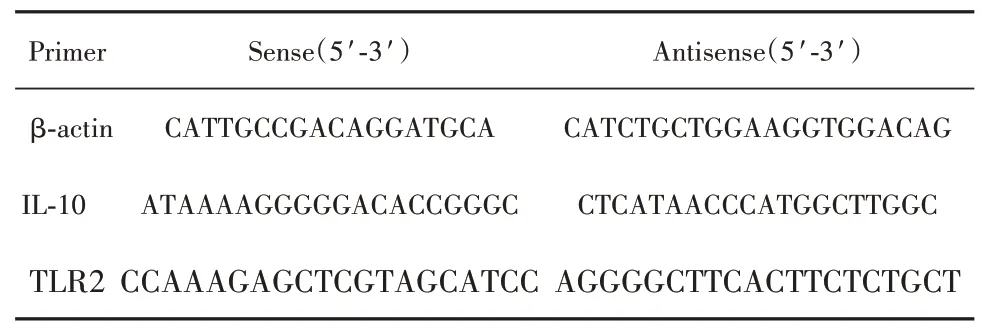
表3 引物列表Tab.3 List of primers
1.3 统计学方法 采用SPSS17.0版软件进行统计数据的分析,实验数据用±s表示,统计学方法采用t检验,P<0.05有统计学意义。
2 结果
2.1 CD1α阳性细胞在VLS中的表达CD1α阳性细胞光镜下:在正常皮肤中平均(14.0±5.8)个,在早期VLS中平均(18.4±7.7)个,两者无统计学上差异(P>0.05)。在进展期VLS中平均(28.6±3.2)个,与正常相比有统计学意义(P<0.05)。见表4、图1。
表4 CD1α阳性细胞在VLS中的表达(±s)Tab.4 Expression of CD1αpositive cells in VLS(±s)
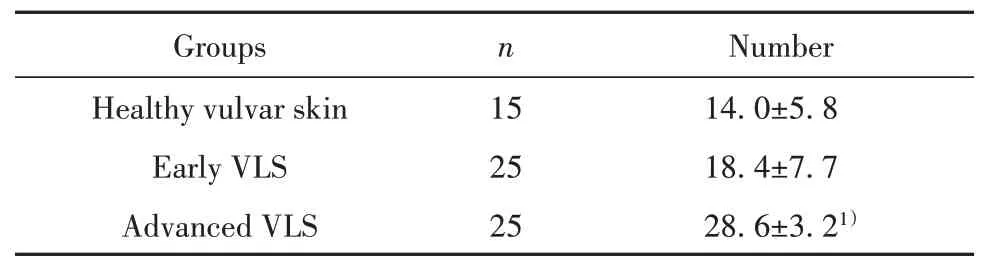
表4 CD1α阳性细胞在VLS中的表达(±s)Tab.4 Expression of CD1αpositive cells in VLS(±s)
Note:Compared with healthy vulvar skin,1)P<0.05.
Number 14.0±5.8 18.4±7.7 28.6±3.21)Groups Healthy vulvar skin Early VLS Advanced VLS n 15 25 25
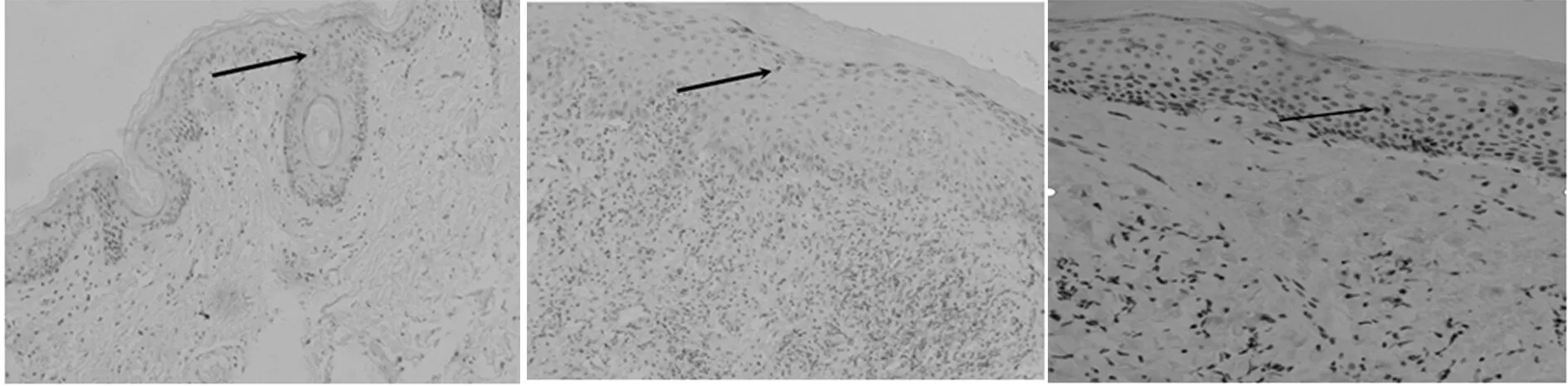
图1 CD1α阳性细胞在VLS中的表达Fig.1 Expression of CD1α-positive cells in VLS
2.2 TLR2、IL-10 mRNA在VLS中的表达TLR2的mRNA表达量在早期VLS为1.34±1.27,与正常皮肤(1.65±0.84)相比无统计学上差异(P>0.05)。但在进展期为3.97±0.79,与正常相比有统计学意义上的差异(P<0.05)。IL-10的mRNA表达量在早期VLS中为1.09±0.89,与正常皮肤(1.08±0.36)相比无统计学上差异(P>0.05)。在进展期VLS为2.93±1.04,与正常相比有统计学意义上的差异(P<0.05,见表5)。
表5 TLR2和IL-10 mRNA的相对表达量(±s)Tab.5 Relative expressions levels of TLR2 and IL-10 mRNA(±s)
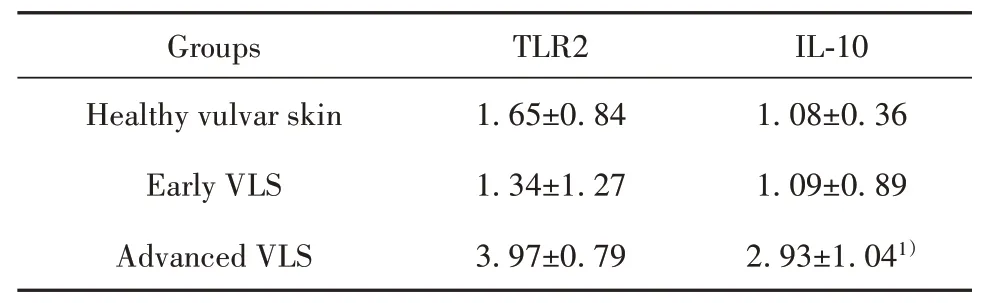
表5 TLR2和IL-10 mRNA的相对表达量(±s)Tab.5 Relative expressions levels of TLR2 and IL-10 mRNA(±s)
Note:Compared with healthy vulvar skin,1)P<0.05.
IL-10 1.08±0.36 1.09±0.89 2.93±1.041)Groups Healthy vulvar skin Early VLS Advanced VLS TLR2 1.65±0.84 1.34±1.27 3.97±0.79
3 讨论
目前病理学上将VLS分为两种类型:早期和进展期。早期可见棘层轻度不规则的增厚,真皮浅层水肿,大量的淋巴细胞浸润,无明显的均质带;进展期可见表皮角质层增厚,棘层细胞减少,基底细胞液化,真皮浅层胶原纤维变性形成均质带,其下伴有大量的淋巴细胞和浆细胞浸润[6]。两种病理改变是否存在一个演变的过程,形成机制是否相同,尚不清楚。TLR属于广泛模式识别受体,是连接固有免疫与适应性免疫的桥梁。TLR广泛分布于多种细胞表面,但主要表达于和宿主防御功能有关的细胞,如单核巨噬细胞、粒细胞、树突状细胞、淋巴细胞等。TLR识别内外源性配体后可激活多种信号转导途径,促进细胞因子产生,调节机体免疫应答[7]。TLR中TLR2表达范围最广,其胞外段可识别病原危险相关分子模式(PAMPS/DAMPS)分子。通过跨膜结构将信号转入细胞内,经由髓样分化因子88(myeloid differentiation factor 88,MyD88)依赖信号传导途径和MyD88非依赖信号转导途径产生复杂的级联信号反应导致核因子κB(nuclear factorκB,NF-κB)等转录因子活化,介导细胞因子的分泌,参与免疫调节和诱导后天免疫功能的启动。TLR2通过影响Th1和Th2的平衡,引起INFγ分泌的降低,IL-10分泌的相对升高,来抑制免疫反应[4]。激活TLR-2可以促进T细胞产生TLR-2依赖的IL-10,并促进Treg细胞生成[8]。文献报道TLR2/TLR1异质二聚体是CD4+T细胞上的一种协同调控受体,在本课题组前期实验中已检测出CD45RO+T细胞(记忆性CD4+T细胞)在VLS中表达增加,且进展期增加更明显[7]。提示增多的CD4+T细胞表面的TLR2可能也增加,导致IL-10分泌增多。本研究的结果显示VLS早期TLR2和IL-10 mRNA表达略增加,与正常外阴皮肤相比无统计学上的差异;而进展期TLR2和IL-10 mRNA表达明显高于正常,有统计学上差异。提示进展期TLR2和IL-10 mRNA增加与CD4+T细胞增加有一定相关性。树突状细胞是皮肤中一种抗原提呈细胞,是启动、调控和维持免疫应答的中心环节,可通过TLR-2通路被激活,从而释放一些细胞因子如IL-10和TGF-β等。活化的树突状细胞极化Th0细胞至Treg细胞,显示树突状细胞中TLR-2依赖的免疫调节功能[9]。本研究发现CD1α标记的树突状细胞在VLS中表达增加,早期没有统计学上差异,进展期增加明显,有统计学意义。与TLR2和IL-10 mRNA在VLS中表达增加呈正相关,进一步证实进展期TLR2和IL-10 mRNA增加与树突状细胞增多有一定的相关性。还有文献报道:TLR2与巨噬细胞的结合被发现可以介导IL-10的产生[9]。本课题组前期实验中还检测到VLS中CD68+细胞(巨噬细胞)增多,进展期增加更明显,与早期相比有统计学上的差异[8]。本研究中TLR2和IL-10 mRNA在进展期也增高,进一步提示TLR2和IL-10 mRNA增加与巨噬细胞增多有一定相关性。综上所述,在VLS进展期CD4淋巴细胞、树突状细胞和巨噬细胞的增加,可能促使其表面活化的TLR2增多,因此,以上细胞产生的IL-10增加。IL-10是体内重要的炎症反应抑制因子,通过下调TNF-α、IL-1、IL-6、IL-12、IFN-γ等细胞因子及单核巨噬细胞上MHCⅡ类分子的表达,控制炎症反应的强度及抑制免疫反应[10-11]。IL-10是CD4+CD25+Treg细胞的重要免疫调节因子,诱导CD4+CD25+Treg细胞增多,抑制免疫反应,在VLS的早期IL-10无明显增加,而进展期IL-10明显增多,与TLR2及其相关细胞增多有相关性[12]。进一步提示在VLS进展期存在免疫抑制现象。
