山莨菪碱抑制JAK2/STAT3的磷酸化缓解博莱霉素诱导的大鼠肺纤维化及病理损伤①
2021-05-27罗静莉易建梅彭夏莹四川省医学科学院四川省人民医院呼吸与内科危重症科成都610072
罗静莉 袁 利 明 玥 易建梅 张 静 彭夏莹四川省医学科学院四川省人民医院呼吸与内科危重症科成都610072
肺纤维化(pulmonary fibrosis,PF)是多种肺疾病的终末期改变,主要表现为进行性呼吸困难、肺换气功能障碍、炎症损伤、肺实质结构破坏等[1]。大部分PF患者病因未明,被称为特发性肺纤维化(idiopathic pulmonary fibrosis,IPF),预后较差,其发病率和死亡率呈逐年增加的趋势[2]。目前,IPF患者主要采用药物治疗、机械通气、肺移植等手段来治疗,但其治疗效果并不十分理想[3]。因此,寻找更加安全有效的药物改善患者的肺纤维化,成为了当前的研究热点。山莨菪碱(anisodamine,ADM)是从山莨菪中提取的一种生物碱,具有明显的外周抗胆碱作用,对胃肠道痉挛、血管痉挛、各种神经痛、眩晕等均有良好的治疗效果[4]。近年来研究显示,ADM还可以调节血流动力学、抗氧化、抑制细胞凋亡和细胞内钙超载等作用,能抑制肝组织纤维化,但其在IPF中的作用及机制尚不清楚[5-6]。因此,本研究探讨了ADM对IPF的作用及机制,旨在为临床IPF的治疗提供一定的参考依据。
1 材料与方法
1.1 材料
1.1 仪器与试剂 多功能酶标检测仪(iMark680)购自Bio-Rad公司;小动物肺功能测定仪购自北京悦宏达责任有限公司;ADM购自杭州民生药业有限公司,国药准字H33021706;博莱霉素(bleomycin,BLM)购自日本化药株式会社高崎工厂,注册证号H20090885;AG490(JAK2抑制剂)购自上海恒斐生物科技有限公司;TUNEL检测试剂盒购自上海嵘崴达实业有限公司;超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)和乳酸脱氢酶(lactic dehydrogenase,LDH)检测试剂盒购自南京建成生物工程有限公司;转化生长因子β(transforming growth factor,TGF-β)、α肌动蛋白(αsmooth muscle aorta, α-SMA)、 纤连蛋 白(Fibronectin)、Ki67、裂解的半胱氨酸天冬氨酸蛋白酶3(cleaved Caspase-3)、Caspase-3、原癌基因c-Myc、p-JAK2、JAK2、p-STAT3和STAT3单克隆抗体,均购于美国Santa Cruz公司;β-actin和辣根过氧化酶(horseradish peroxidase,HRP)标记羊抗兔IgG购于DAKO公司。
1.1.2 实验动物 SPF级SD雄性大鼠60只,体重均为180~200 g,由北京维通利华实验动物技术有限公司提供,动物许可证号SCXK(京)2015-0001,饲养于本院动物中心实验室,保持室温恒定为25℃,模拟昼夜,自由摄食与饮水。
1.2 方法
1.2.1 动物造模及给药 60只大鼠预饲养1周后,将其随机分为对照组,BLM组,ADM高、中、低剂量组和AG490组各10只。除对照组外,所有大鼠均采用气管内注射BLM诱导IPF模型[7]。腹腔注射2%的戊巴比妥钠(0.2 ml/100 g)麻醉,常规消毒颈部皮肤,于颈部正中行一切口,暴露气管,气管内注射100μl BLM溶液(5 mg/kg),注入后将大鼠直立并旋转数圈,使药液均匀分布,对照组注入等体积生理盐水。造模后经听诊器可听到造模大鼠喉中哮鸣音,则为造模成功。造模后,ADM高、中、低剂量组腹腔注射ADM(剂量依次为1 mg/kg、0.5 mg/kg、0.25 mg/kg),1次/d,连续注射4周,AG490组腹腔注射5 mg/kg的AG490,1次/2 d,连续注射4周,对照组和BLM组腹腔注射等体积生理盐水。
1.2.2 各组大鼠肺功能检测 分别于造模前、造模后1周和造模后4周,采用肺功能检测仪检测大鼠第0.3 s用力呼气量(forced expiratory volume in 0.3 second,FEV0.3)与用力肺活量(forcedvital capacity,FVC)及其FEV0.3/FVC比值和最大呼气流量(peak expiratory flow,PEF)。检测后立即处死大鼠,分离血液,离心(3 500 r/min,10 min),取上清,置于-20℃冰箱暂存,分离肺组织,置于-80℃冰箱暂存。
1.2.3 HE染色及MASSON染色观察大鼠肺组织病理学 取大鼠肺组织,采用4%多聚甲醛固定,进行常规的脱水、透明、包埋和切片,分别进行HE染色和MASSON染色,在光镜下观察组织的病理变化,每张切片随机取5个视野拍照。
1.2.4 Western blot检测各组大鼠肺组织纤维化相关蛋白表达 取大鼠肺组织匀浆,使用细胞裂解液提取组织总蛋白,采用BCA法进行蛋白定量,取50μg总蛋白进行SDS-PAGE凝胶电泳,电转膜至PVDF膜,室温密封2 h,洗膜并加一抗(TGF-β、α-SMA和Fibronectin蛋白,稀释比例均为1∶1 000),4℃孵育过夜,洗膜加HRP标记的二抗(稀释比例均为1∶5 000)室温孵育2 h,选用β-actin作为内参,电化学发光显像,凝胶图像处理系统分析对比条带强弱。
1.2.5 TUNEL检测大鼠肺组织细胞凋亡 取大鼠肺组织切片,进行TUNEL染色,严格按照试剂盒说明进行操作,显微镜下观察组织细胞的凋亡情况。采用Western blot检测肺组织Ki67、cleaved Caspase-3、Caspase-3和c-Myc蛋白的表达。
1.2.6 各组大鼠血清氧化应激因子的检测 取各组大鼠血清,采用试剂盒检测SOD、MDA和LDH水平,严格按照试剂盒说明进行操作。
1.2.7 Western blot检测各组大鼠肺组织JAK/STAT信号通路的表达 取大鼠肺组织,采用Western blot检测各组大鼠肺组织p-JAK2、JAK2、p-STAT3和STAT3信号通路的表达。
1.3 统计学分析 采用SPSS17.0软件对所得数据进行分析,满足正态的计量资料均以表示,采用单因素方差分析比较组间差异性,若组间比较有差异,采用SNK-q比较多组内两两组间差异性,且均以P<0.05表示差异具有统计学意义。
2 结果
2.1 ADM对各组大鼠肺功能的影响 与对照组相比,BLM组大鼠FEV0.3、FEV0.3/FVC和PEF水平明显下降(P<0.05);与BLM组相比,ADM中、高剂量组和AG490组大鼠FEV0.3、FEV0.3/FVC和PEF明显升高(P<0.05),且随着剂量升高,其作用更为明显(P<0.05),见表1。
2.2 ADM对各组大鼠肺组织病理变化的影响HE染色和MASSON结果显示,对照组大鼠肺组织细胞结构完整,排列整齐;BLM组和ADM低剂量组大鼠肺组织肺泡结构紊乱,伴大量炎症细胞浸润,胶原蛋白大量沉积;ADM中、高剂量组和AG490组大鼠肺组织细胞结构较紊乱,炎症细胞浸润和胶原蛋白沉积明显减少。见图1。
2.3 ADM对各组大鼠肺组织纤维化相关蛋白表达的影响 与对照组相比,BLM组大鼠肺组织TGFβ、α-SMA和Fibronectin蛋白表达均明显升高(P<0.05);与BLM组相比,ADM中、高剂量组和AG490组大鼠肺组织TGF-β、α-SMA和Fibron-ectin蛋白表达均明显下降(P<0.05),且随着剂量升高,其作用更为明显(P<0.05)。见图2。
表1 各组大鼠的肺功能Tab.1 Lung function of rats in each group of rats

表1 各组大鼠的肺功能Tab.1 Lung function of rats in each group of rats
Note:Compared with control group,1)P<0.05;compared with BLM group,2)P<0.05.
Groups Dose(mg/kg) Time FEV0.3(ml/s) FEV0.3/FVC(%) PEF(ml/s)24±9.21 28.65±3.32 1 weeks after modeling 4.69±0.53 81.82±9.13 28.74±3.46 4 weeks after modeling 4.71±0.54 81.59±9.07 28.71±3.37 BLM group 5 Before modeling 4.72±0.56 82.19±9.34 28.69±3.56 1 weeks after modeling 3.64±0.51 68.45±9.27 23.14±3.28 4 weeks after modeling 3.10±0.381) 60.82±7.121) 20.65±2.631)ADM group 0.25 Before modeling 4.71±0.53 81.68±8.94 28.68±3.40 1 weeks after modeling 3.72±0.48 71.50±8.87 24.06±3.27 4 weeks after modeling 3.14±0.29 62.71±7.33 21.22±2.70 0.5 Before modeling 4.70±0.55 82.06±9.21 28.73±3.41 1 weeks after modeling 3.81±0.44 72.12±8.83 24.86±3.28 4 weeks after modeling 3.64±0.452) 69.62±7.852) 24.29±2.852)1 Before modeling 4.72±0.55 81.69±9.12 28.73±3.42 1 weeks after modeling 3.93±0.47 72.82±8.95 25.17±3.36 4 weeks after modeling 4.17±0.482) 74.21±8.522) 26.83±2.172)AG490 group 5 Before modeling 4.72±0.53 81.46±8.98 28.65±3.34 1 weeks after modeling 3.87±0.42 71.68±8.76 25.02±3.27 4 weeks after modeling 4.02±0.462) 73.59±8.472) 25.76±2.232)Control group - Before modeling 4.68±0.52 82.
2.4 ADM对各组大鼠肺组织细胞凋亡的影响 与对照组相比,BLM组大鼠肺组织细胞凋亡率明显升高(P<0.05);与BLM组相比,ADM中、高剂量组和AG490组大鼠肺组织细胞凋亡率明显下降(P<0.05),且随着剂量升高,其作用更为明显(P<0.05)。见图3。
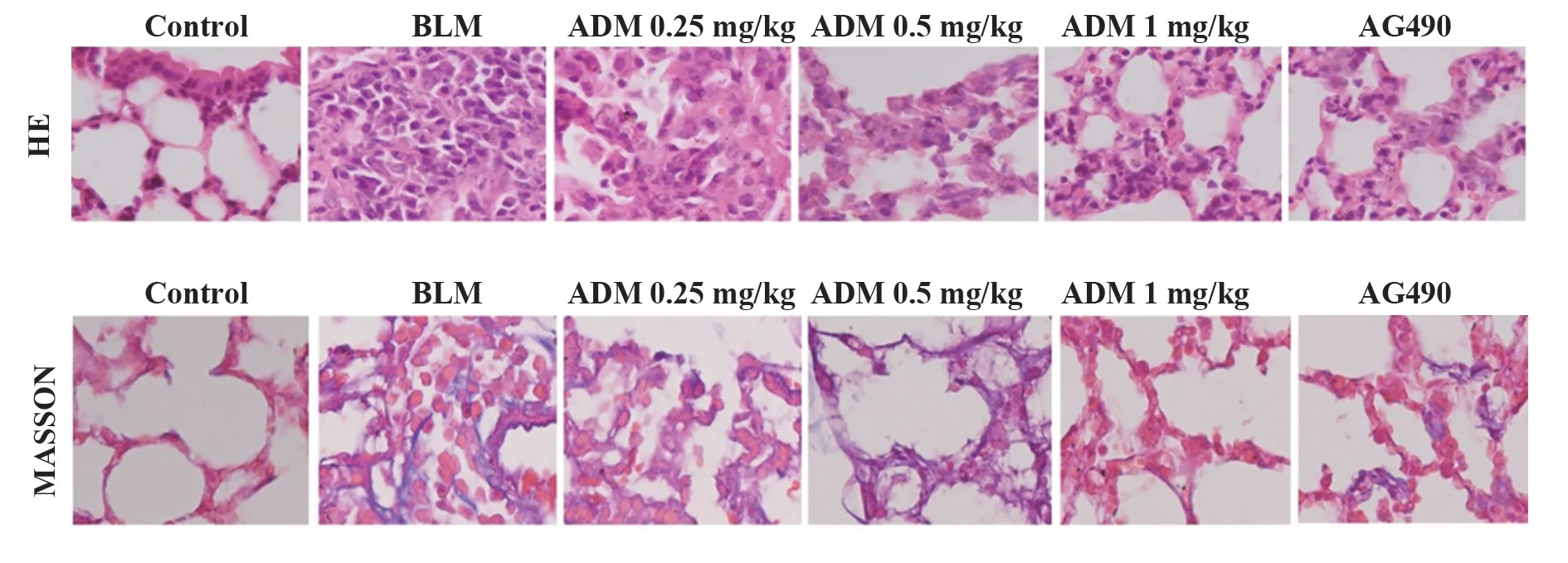
图1 各组大鼠肺组织病理变化(×400)Fig.1 Pathological changes of lung tissues in each group of rats(×400)
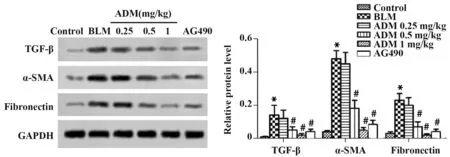
图2 ADM对各组大鼠肺组织纤维化相关蛋白表达的影响Fig.2 Effect of ADM on expression of fibrosis-related proteins in lung tissues of rats in each group
2.5 ADM对各组大鼠肺组织细胞凋亡相关蛋白表达的影响 与对照组相比,BLM组大鼠肺组织Ki67和c-Myc蛋白表达明显下降(P<0.05),cleaved Caspase-3/Caspase-3蛋白表达均明显升高(P<0.05);与BLM组相比,ADM中、高剂量组和AG490组大鼠肺组织Ki67和c-Myc蛋白表达明显升高(P<0.05),cleaved Caspase-3/Caspase-3蛋白表达均明显下降(P<0.05),且随着剂量升高,其作用更为明显(P<0.05)。见图4。

图3 ADM对各组大鼠肺组织细胞凋亡的影响(×400)Fig.3 Effect of ADM on apoptosis of lung tissues in each group of rats(×400)

图4 ADM对各组大鼠肺组织细胞凋亡相关蛋白表达的影响Fig.4 Effects of ADM on expression of apoptosis-related proteins in lung tissues of rats in each group
表2 ADM对各组大鼠血氧化应激水平的影响Tab.2 Effect of ADM on oxidative stress level of rats in each group
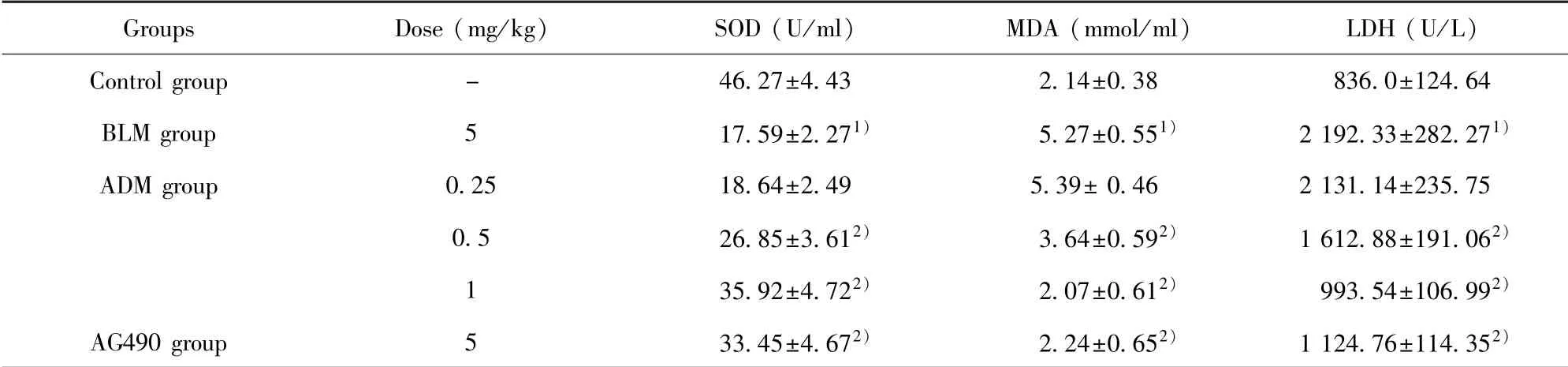
表2 ADM对各组大鼠血氧化应激水平的影响Tab.2 Effect of ADM on oxidative stress level of rats in each group
Note:Compared with control group,1)P<0.05;compared with BLM group,2)P<0.05.
Groups Dose(mg/kg) SOD(U/ml) MDA(mmol/ml) LDH(U/L)24.64 BLM group 5 17.59±2.271) 5.27±0.551) 2 192.33±282.271)ADM group 0.25 18.64±2.49 5.39±0.46 2 131.14±235.75 0.5 26.85±3.612) 3.64±0.592) 1 612.88±191.062)1 35.92±4.722) 2.07±0.612) 993.54±106.992)AG490 group 5 33.45±4.672) 2.24±0.652) 1 124.76±114.352)Control group - 46.27±4.43 2.14±0.38 836.0±1
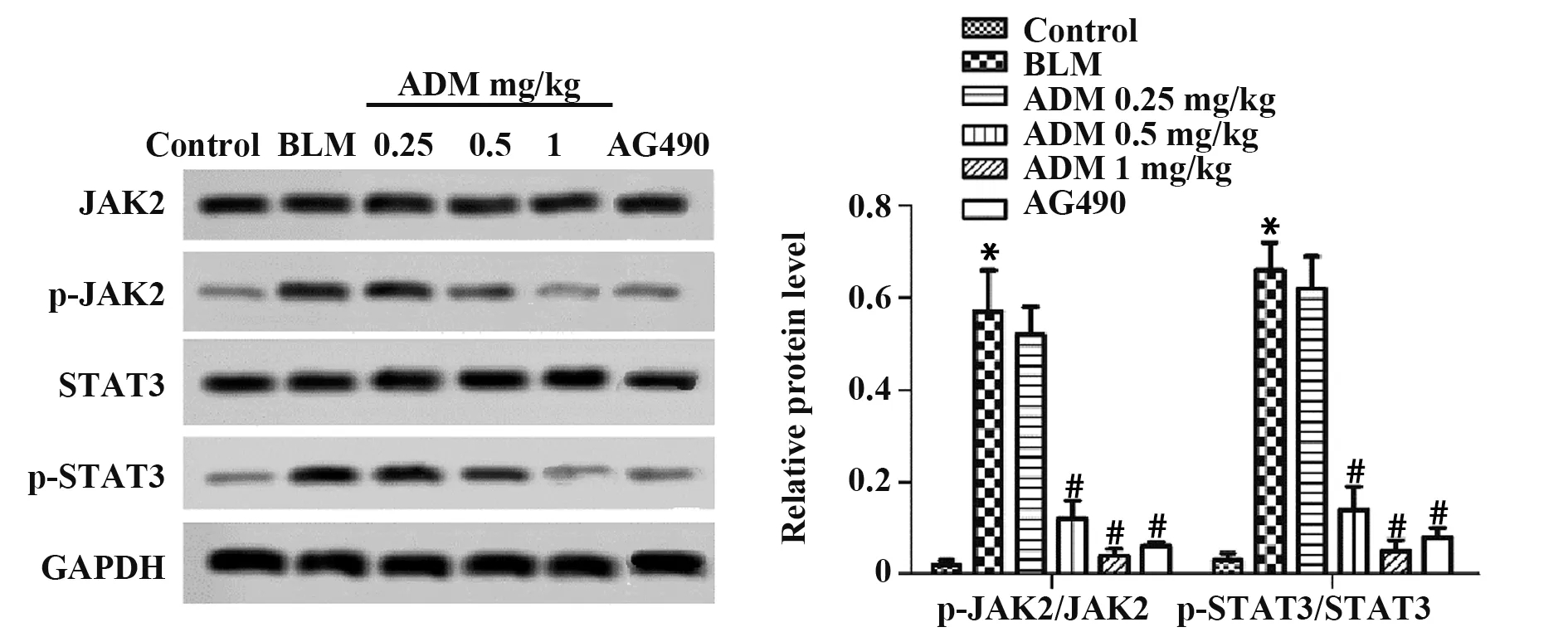
图5 ADM对各组大鼠肺组织JAK/STAT信号通路的影响Fig.5 Effects of ADM on JAK/STAT signaling pathway in lung tissues of rats in each group
2.6 ADM对各组大鼠血氧化应激水平的影响与对照组相比,BLM组大鼠血清SOD水平明显下降(P<0.05),血清MDA和LDH水平明显升高(P<0.05);与BLM组相比,ADM中、高剂量组和AG490组大鼠血SOD水平明显升高(P<0.05),MDA和LDH水平明显下降(P<0.05),且随着剂量升高,其作用更为明显(P<0.05)。见表2。
2.7 ADM对各组大鼠肺组织JAK/STAT信号通路的影响 与对照组相比,BLM组大鼠肺组织p-JAK2/JAK2和p-STAT3/STAT3蛋白表达均明显升高(P<0.05);与BLM组相比,ADM中、高剂量组和AG490组大鼠肺组织p-JAK2/JAK2和p-STAT3/STAT3蛋白表达均明显下降(P<0.05),且随着剂量升高,其作用更为明显(P<0.05)。见图5。
3 讨论
IPF是一种病因不明的进行性肺纤维化间质性疾症,主要病理特征为成纤维细胞增殖、大量细胞外基质聚集、炎症损伤和肺实质结构破坏,临床主要表现为肺功能进行性丧失[8]。目前,临床尚无治疗IPF的特效药物,建立理想的动物模型,研究IPF的发病机制,是药物研发的基础和保障。BLM、胺碘酮、百叶枯、野百合碱均为临床常用的建立IPF动物模型的药物,其中BLM诱导IPF模型方法简单,应用最为广泛[9]。因此,本研究采用BLM诱导大鼠IPF,研究ADM对IPF的作用及机制。ADM是一种抗胆碱药物,具有广泛的生物学作用,对于急性阑尾炎、高血压脑病、肺部疾患、中毒等均有良好的临床疗效,但其对IPF的作用及机制尚不清楚[10]。本研究中,BLM诱导大鼠的FEV0.3、FEV0.3/FVC和PEF均明显下降,肺组织出现明显病理变化,经ADM作用后,FEV0.3、FEV0.3/FVC和PEF均明显升高,肺组织出现病理变化明显减轻,胶原沉积明显减少,且随着剂量增加,其作用逐渐增强,提示ADM可以呈剂量依赖性改善IPF大鼠的肺组织病理变化和肺功能。周映红等[11]的研究显示,ADM可以明显改善重症肺炎婴幼儿的咳嗽、气喘、气促、呼吸困难等临床症状,提示ADM可以改善IPF的肺组织结构和功能障碍,有望应用于临床IPF的治疗。
本研究中,ADM可以明显降低BLM大鼠TGFβ、α-SMA和Fibronectin的蛋白表达。TGF-β是一种强有力的促纤维化生长因子,可以促进细胞外基质的合成,诱导成纤维细胞分化为肌成纤维细胞,在肝、肾、肺等多组织脏器的纤维化过程中均具有重要意义[12]。研究显示,当TGF-β在胞膜与其受体结合后,可磷酸化Smad2和Smad3并形成三聚体,转移到细胞核内,调节下游α-SMA、Fibronectin、基质金属蛋白酶等的表达,诱导肺间质纤维化的产生[13-14]。GUAN等[15]的研究显示,TGF-β是一个多功能的细胞因子,在纤维化疾病的发生发展中具有重要作用,可以诱导细胞上皮间质转化,诱导肺纤维化的发生,提示ADM可以抑制TGF-β信号通路,抑制IPF的发生。本研究中,ADM可以抑制BLM诱导的大鼠肺组织细胞凋亡,促进肺组织Ki67和c-Myc蛋白表达,抑制cleaved Caspase-3/Caspase-3蛋白表达,提示ADM可以调节肺组织细胞增殖和凋亡相关蛋白的表达,抑制肺组织细胞凋亡。本研究中,ADM作用可以明显升高血SOD水平,降低MDA和LDH水平,提示ADM可以降低IPF大鼠的氧化应激水平,清除机体过多的氧自由基。高巧营等[16]的研究显示,ADM可以降低糖尿病大鼠氧化应激水平,调节凋亡相关蛋白Bcl-2/Bax的表达,保护肾组织损伤,提示ADM可以降低IPF大鼠氧化应激水平,清除体内过多的过氧化物,抑制肺组织细胞凋亡,保护肺组织损伤。
本研究中,AG490干预可以明显改善BLM诱导大鼠的肺组织纤维化,降低肺组织中TGF-β、α-SMA和Fibronectin蛋白表达,抑制肺组织细胞凋亡。AG490是JAK2/STAT3信号通路的特异性抑制剂,提示BLM诱导大鼠的肺组织纤维化可能与JAK2/STAT3信号通路被阻断有关。本研究中,ADM可以明显降低肺组织JAK2和STAT3的磷酸化水平,提示ADM可能通过抑制JAK2/STAT3信号通路,抑制肺组织的纤维化。JAK2为JAK蛋白家族中的一员,是一种非跨膜型酪氨酸激酶,当细胞因子与细胞受体结合后可磷酸化JAK2,进而磷酸化下游的STAT3,参与机体细胞增殖、分化、凋亡等多种生物学过程[17]。已有研究显示,JAK2/STAT3信号通路是细胞信号由胞膜向核内传递的主要途径,TGF-β、干扰素家族等多种细胞因子均可以与膜上受体结合,激活JAK2/STAT3信号通路,将信号传递至核内,调控下游靶基因的表达[18-19]。TANG等[20]的研究显示,TGF-β可以激活JAK2/STAT3信号通路,促进肝纤维化的形成,提示ADM可能通过阻断JAK2/STAT3信号通路,抑制TGF-β的表达,抑制TGF-β诱导的纤维化,保护肺组织结构和功能障碍。
综上所述,ADM可能通过阻断JAK2/STAT3信号通路,抑制TGF-β信号通路,清除机体过多的氧自由基,抑制肺组织细胞凋亡和肺纤维化的形成,保护肺组织结构和功能障碍,为ADM的临床应用提供了一定的理论依据。但本研究只是初步探讨了ADM对IPF的作用及其可能的机制,具体的调节机制尚需进一步研究探索。
