miR-202-5p靶向下调SOX6表达对缺氧复氧诱导的心肌细胞氧化应激的影响研究①
2021-05-27秦少强梁惠清王晓元张占帅李会贤张鹏祥李方江河北北方学院附属第一医院心内科张家口075000
秦少强 梁惠清 王晓元 张占帅 李会贤 张鹏祥 王 蕊 李方江河北北方学院附属第一医院心内科张家口075000
急性心肌梗死(acute myocardial infarction,AMI)是最常见、最严重的心脏病,是导致心血管疾病死亡的主要原因。心肌缺血再灌注(ischemiareperfusion,I/R)损伤是AMI后冠状动脉恢复血液供应加重心肌损伤的重要病理过程[1]。氧化应激在I/R损伤的发病机制中起着至关重要的作用[2]。此外,在I/R损伤后心肌细胞凋亡明显增加[3]。因此,如何有效降低氧化应激和凋亡水平对减少I/R后的心肌损伤具有重要意义。miRNA是一类通过与靶mRNA的3′端非翻译区结合调控靶基因表达的短链非编码RNA,其表达异常与人类的多种心血管疾病有关,包括心肌损伤[4]。最近研究显示,I/R大鼠模型和缺氧诱导的乳鼠原代心肌细胞中miR-202-5p表达下调,过表达miR-202-5p可减少心肌梗死面积,缓解心肌酶失调,对大鼠心肌缺血再灌注损伤具有保护作用[5]。SOX6基因是Y染色体的性别决定基因相关高迁移率蛋白(SRY related HMG box gene,SOX)基因家族SOX D亚族成员,研究发现SOX6可调控晚期心脏分化过程中的心肌细胞增殖和凋亡[6]。此外,下调SOX6表达还可改善心梗后心肌功能[7]。生物信息学分析显示,SOX6是miR-202-5p的潜在靶基因,但miR-202-5p能否靶向SOX6参与对I/R损伤后心肌细胞氧化应激和凋亡的调控尚未可知。因此,本研究构建缺氧复氧模型模拟心肌细胞I/R损伤过程,初步探讨miR-202-5p对缺氧复氧诱导的心肌细胞氧化应激和凋亡的影响和机制,以期为预防I/R损伤提供新的思路。
1 材料与方法
1.1 材料 大鼠胚胎心肌细胞H9C2(上海酶联生物科技有限公司);DMEM培养基和胎牛血清(美国Gibco公司);LipofectamineTM2000转染试剂和TRIzol试剂(美国Invitrogen公司);细胞计数(cell counting kit-8,CCK-8)试剂盒(美国APExBIO公司);荧光素酶报告基因检测系统(美国Promega公司);活性氧簇(reactive oxygen species,ROS)检测试剂盒、丙二醛(malondialdehyde,MDA)检测试剂盒、谷胱甘肽过氧化物酶(glutathion peroxidase,GSH-Px)检测试剂盒(北京索莱宝生物科技有限公司);cDNA第一链合成试剂盒(武汉爱博泰克生物科技有限公司);qPCR SYBR®Green Master Mix(上海翊圣生物科技有限公司);膜联蛋白V异硫氰酸荧光素(Annexin V fluorescein isothiocyanate,Annexin V-FITC)/碘化丙啶(propidium iodide,PI)试剂盒(美国Sigma公司);miR-con、miR-202-5p mimics、anti-miR-con、anti-miR-202-5p、pcDNA、pcDNA-SOX6、WT-SOX6、MUT-SOX6的构建和测序(上海吉玛制药有限公司);RIPA裂解液(北京百泰克生物技术有限公司);兔源SOX6多克隆抗体、兔源Cyclin D1单克隆抗体、兔源Cleaved Caspase-3多克隆抗体以及辣根过氧化物酶标记的Ⅱ抗(美国Abcam公司);紫外分光光度计(德国Eppendorf公司)。
1.2 方法
1.2.1 构建心肌细胞缺氧复氧模型 采用高糖DMEM培养基(10%胎牛血清和1%青链霉素双抗)培养H9C2心肌细胞,培养条件:37℃、5%CO2培养箱。取对数生长期心肌细胞,采用无糖DMEM培养基于37℃缺氧培养心肌细胞6 h,然后将心肌细胞用新鲜高糖DMEM培养基常规培养6 h,记为缺氧复氧组。
1.2.2 细胞转染和实验分组 细胞转染采用脂质体转染法利用LipofectamineTM2000进行转染,转染48 h时进行缺氧复氧处理。将H9C2心肌细胞随机分为以下几组:空白组(正常培养的H9C2细胞)、缺氧复氧组(缺氧6 h,复氧6 h)、缺氧复氧+miR-con组(转染miR-con后,缺氧复氧处理)、缺氧复氧+miR-202-5p组(转染miR-202-5p mimics后,缺氧复氧处理)、缺氧复氧+miR-202-5p+pcDNA组(共转染miR-202-5p mimics和pcDNA后,缺氧复氧处理)、缺氧复氧+miR-202-5p+pcDNA-SOX6组(共转染miR-202-5p mimics和pcDNA-SOX6后,缺氧复氧处理)。
1.2.3 qRT-PCR检测 利用TRIzol法提取各组H9C2细胞总RNA,采用紫外分光光度计测定RNA浓度,采用cDNA第一链合成试剂盒合成cDNA,按照qPCR SYBR Green Master Mix试剂盒说明书配置反应体系,利用ABI 7500实时荧光定量PCR仪检测miR-202-5p和SOX6 mRNA的相对表达量。
1.2.4 荧光素酶报告基因实验 利用TargetScan预测miR-202-5p靶基因,发现miR-202-5p与SOX6存在部分特异性合位点。构建含有SOX6 3′-UTR的野生型WT-SOX6和突变型MUT-SOX6荧光素酶报告基因载体,分别将WT-SOX6、MUT-SOX6与miR-202-5p mimics共转染至H9C2心肌细胞,转染48 h后,收集细胞并检测各组细胞中荧光素酶活性。
1.2.5 CCK-8试剂盒检测细胞增殖 取对数期H9C2心肌细胞按照2×103个/孔细胞密度接种于96孔板,按照实验分组进行相应处理后,每个孔中加入10μl的CCK8溶液,培养箱孵育4 h,用酶标仪测定在450 nm处的吸光度值(A),计算细胞存活率。细胞存活率(%)=(A处理组/A对照组)×100%。
1.2.6 检测ROS、MDA、GSH-Px水平 收集进行相应处理的各组H9C2心肌细胞,加入RIPA裂解液,冰上裂解30 min,4℃12 000 r/min离心15 min,收集上清液,按照试剂盒说明书检测ROS、MDA、GSHPx水平。
1.2.7 流式细胞术检测细胞凋亡 收集进行相应处理的各组H9C2心肌细胞,用预冷的PBS洗涤3次,离心后弃上清液。用1×binding buffer重悬细胞,调整细胞浓度为1×105个/ml。取100μl的细胞悬液加入流式管内,分别加入5μl的Annexin VFITC和10μl的PI溶液,混匀后,避光孵育15 min,补加PBS至500μl后,流式细胞仪检测心肌细胞凋亡情况。
1.2.8 Western blot检测 收集进行相应处理的各组H9C2心肌细胞,加入RIPA裂解液提取细胞总蛋白,BCA试剂盒检测蛋白浓度,取30μg蛋白样品进行SDS-PAGE电泳分离细胞蛋白,经湿法转膜、封闭后,加入各蛋白已稀释的Ⅰ抗,洗膜后,分别加入稀释的Ⅱ抗,ECL显影后,放入自动凝胶成像系统拍照,Image J软件分析各蛋白条带灰度值。
1.3 数据处理 用SPSS18.0进行统计学分析,所有数据均用表示,采用t检验进行组间比较,采用单因素方差分析进行多组间比较,以P<0.05表示差异具有统计学意义。
2 结果
2.1 缺氧复氧处理对心肌细胞miR-202-5p和SOX6表达的影响 与空白组相比,缺氧复氧组心肌细胞miR-202-5p的表达水平显著降低,SOX6 mRNA和SOX6蛋白的表达水平显著升高(P<0.05),见图1。

图1 缺氧复氧处理心肌细胞影响miR-202-5p和SOX6表达Fig.1 Hypoxia-reoxygenation treatment affects miR-202-5p and SOX6 expression in cardiomyocytes
2.2 上调miR-202-5p表达促进缺氧复氧处理心肌细胞增殖 与空白组相比,缺氧复氧组心肌细胞miR-202-5p的表达水平显著降低,Cyclin D1的表达水平显著降低,细胞存活率显著降低;与缺氧复氧+miR-con组比较,缺氧复氧+miR-202-5p组心肌细胞miR-202-5p的表达水平显著升高,Cyclin D1的表达水平显著升高,细胞存活率显著升高(P<0.05),见图2。
2.3 上调miR-202-5p表达抑制缺氧复氧处理心肌细胞凋亡 与空白组相比,缺氧复氧组心肌细胞Cleaved Caspase-3蛋白的表达水平显著升高,细胞凋亡率显著增加;与缺氧复氧+miR-con组比较,缺氧复氧+miR-202-5p组心肌细胞Cleaved Caspase-3蛋白的表达水平显著降低,细胞凋亡率显著降低(P<0.05),见图3。
2.4 上调miR-202-5p表达抑制缺氧复氧处理心肌细胞氧化应激 与空白组相比,缺氧复氧组心肌细胞ROS水平显著升高,MDA的含量显著升高,GSHPx的含量显著降低;与缺氧复氧+miR-con组比较,缺氧复氧+miR-202-5p组心肌细胞ROS水平显著降低,MDA的含量显著降低,GSH-Px的含量显著升高(P<0.05),见图4。

图2 上调miR-202-5p促进缺氧复氧处理心肌细胞存活率和Cyclin D1蛋白表达Fig.2 Up-regulation of miR-202-5p promotes the survival rate and Cyclin D1 protein expression of cardiomyocytes treated with hypoxia and reoxygenation
2.5 miR-202-5p靶向调控SOX6的表达 生物信息学软件在线预测显示,miR-202-5p和SOX6存在部分连续互补的核苷酸序列,见图5A。与miR-con和WT-SOX6共转染组比较,miR-202-5p和WT-SOX6共转染组心肌细胞的荧光素酶活性显著降低(P<0.05);与miR-con和MUT-SOX6共转染组比较,miR-202-5p和MUT-SOX6共转染组心肌细胞的荧光素酶活性无显著变化,见图5B。与miR-con组比较,miR-202-5p组心肌细胞SOX6蛋白表达水平显著降低;与anti-miR-con组比较,anti-miR-202-5p组心肌细胞SOX6蛋白表达水平显著升高(P<0.05),见图5C。
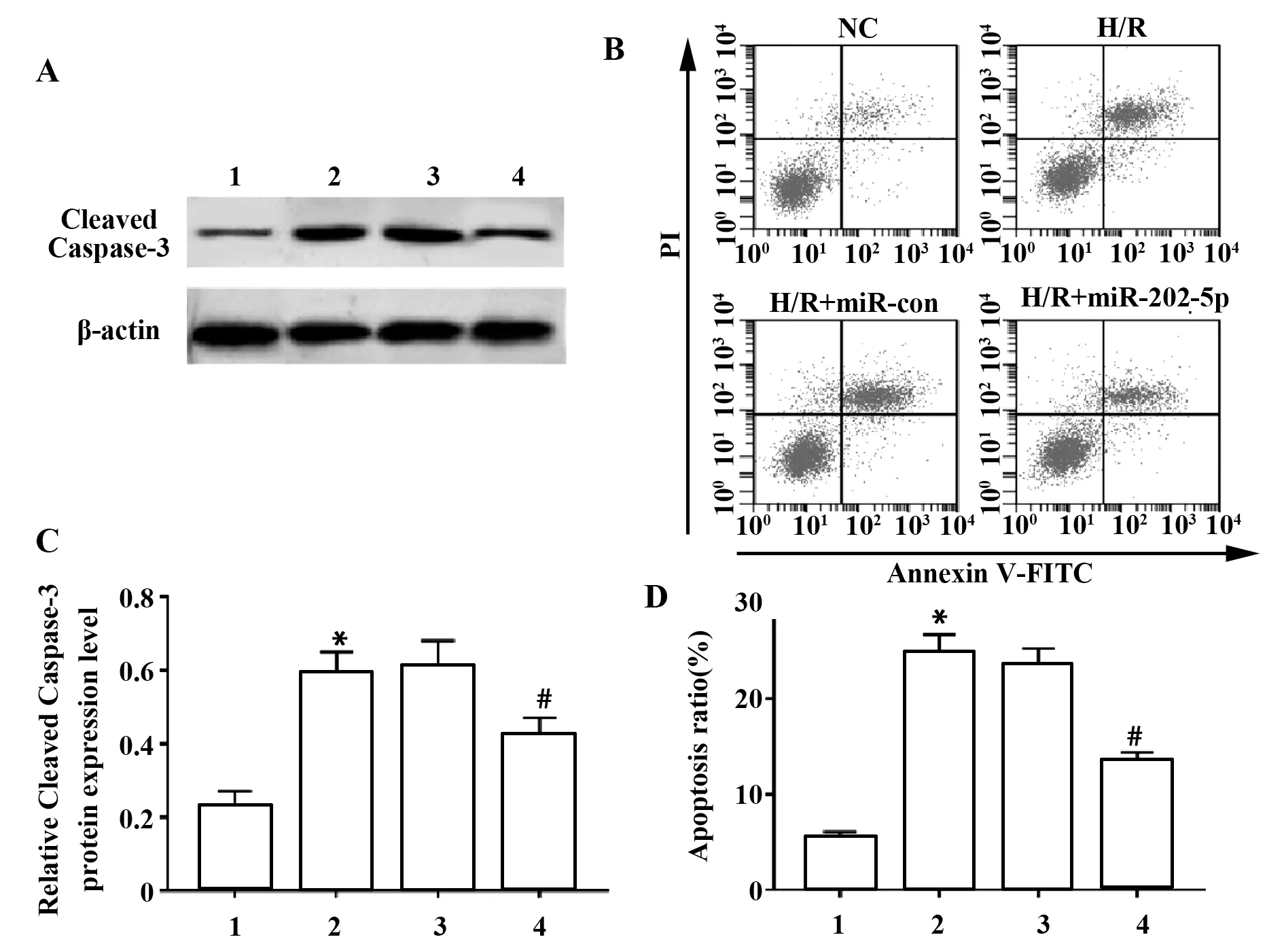
图3 上调miR-202-5p抑制心肌细胞中Cleaved Caspase-3蛋白表达和心肌细胞凋亡Fig.3 Up-regulation of miR-202-5p inhibits Cleaved Caspase-3 protein expression and cardiomyocyte apoptosis in cardiomyocytes
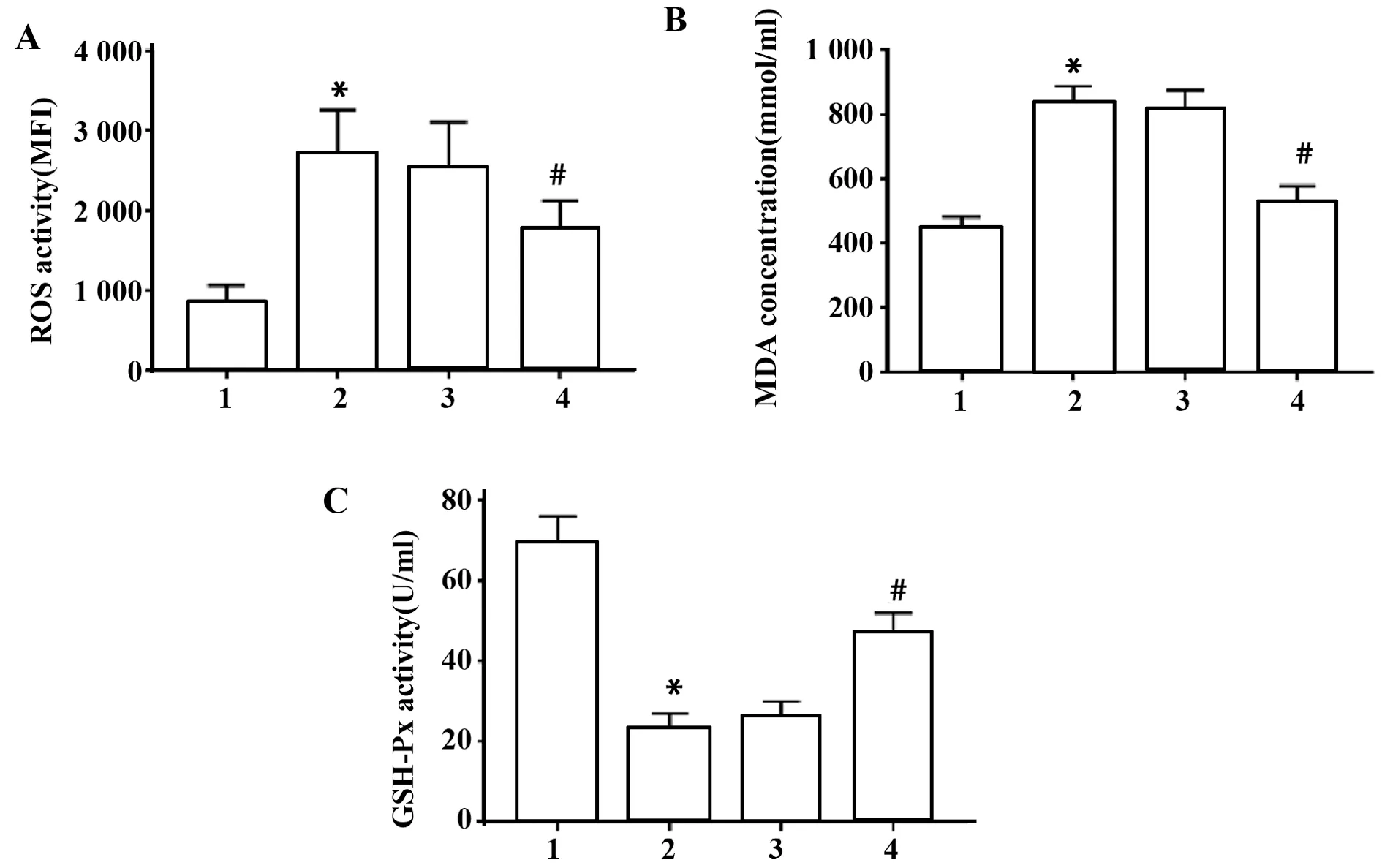
图4 上调miR-202-5p对缺氧复氧处理心肌细胞ROS水平、GSH-Px和MDA的含量的影响Fig.4 Up-regulation of miR-202-5p on ROS level,GSHPx and MDA content in myocardial cells treated with hypoxia and reoxygenation
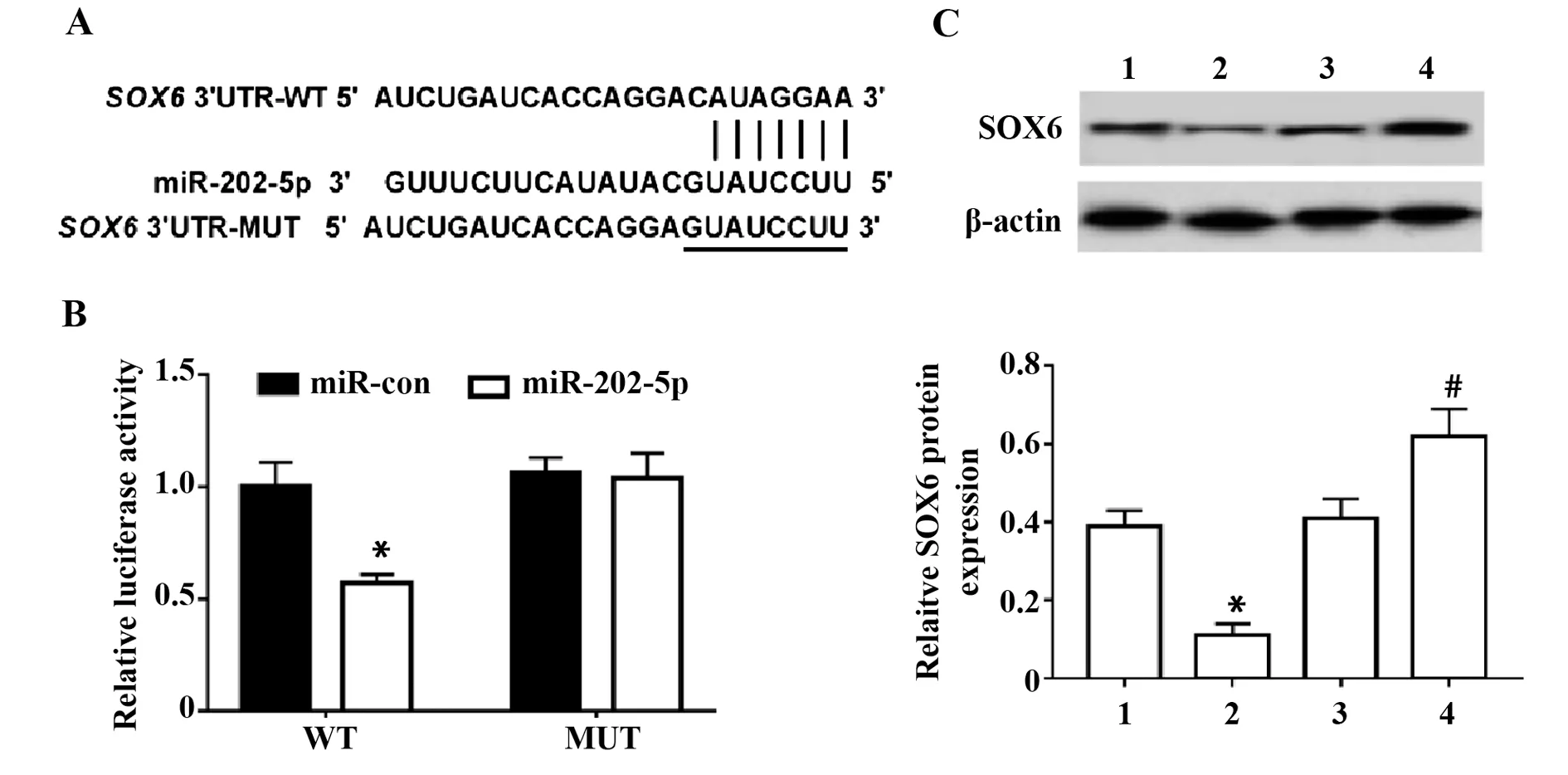
图5 miR-202-5p靶向调控SOX6表达Fig.5 miR-202-5p targets and regulates SOX6 expression
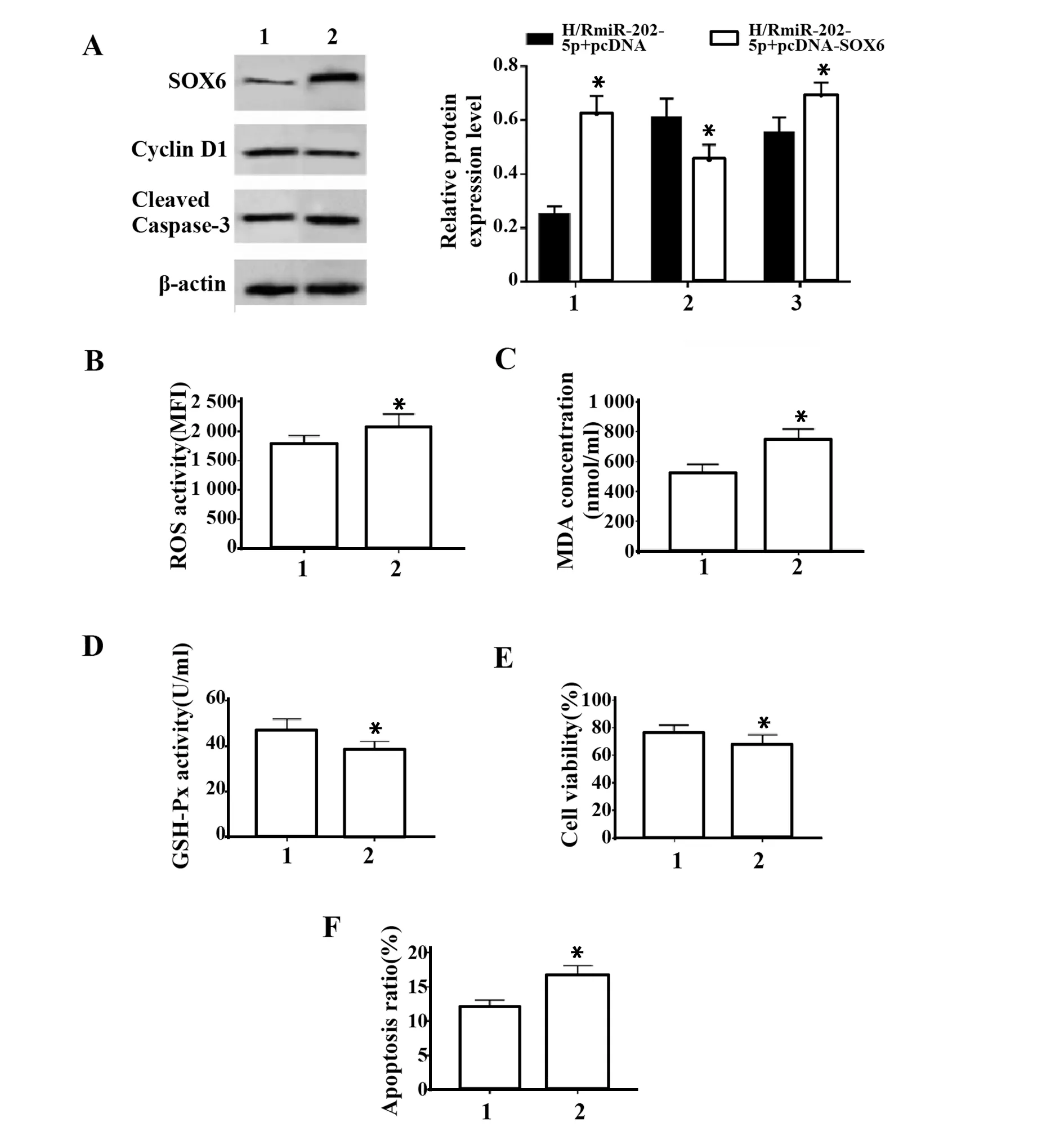
图6 上调SOX6部分逆转miR-202-5p对缺氧复氧处理心肌细胞的保护作用Fig.6 Up-regulation of SOX6 partially reverses protective effect of miR-202-5p on myocardial cells treated with hypoxia and reoxygenation
2.6 上调SOX6部分逆转miR-202-5p对缺氧复氧处理心肌细胞的保护作用 与缺氧复氧+miR-202-5p+pcDNA组比较,缺氧复氧+miR-202-5p+pcDNASOX6组心肌细胞SOX6和Cleaved Caspase-3蛋白的表达水平显著升高,Cyclin D1蛋白的表达水平显著降低,ROS水平显著升高,MDA含量显著增加,GSH-Px的含量显著降低,细胞存活率显著降低,凋亡率显著增加(P<0.05),见图6。
3 讨论
经皮冠状动脉介入治疗能在最短时间内重新打开闭塞的冠状动脉,显著降低急性心肌梗死的死亡率,是AMI最重要的治疗手段[8]。然而,AMI再灌注治疗后引起的I/R问题也变得越来越突出。心肌细胞氧化应激和凋亡在I/R损伤中起着至关重要作用。本研究以大鼠心肌细胞缺氧复氧模型模拟心肌I/R损伤,探索与心肌细胞氧化应激和凋亡有关的基因,以期为治疗心肌I/R损伤提供理论依据。
miR-202-5p在I/R大鼠模型模型和缺氧复氧诱导的乳鼠原代心肌细胞中表达水平显著降低,上调miR-202-5p可降低血清中心肌酶浓度,降低心肌细胞ROS水平,减少减轻心肌细胞钙超载,减少心肌梗死面积,减轻大鼠I/R损伤[5]。miR-202-5p在氨诱导的鸡心肌细胞损伤中表达下调,并通过调控PTEN/AKT/mTOR途径影响心脏氧化应激和自噬[9]。本研究表明在缺氧复氧条件下,心肌细胞的存活率显著降低,细胞凋亡率显著增加,miR-202-5p的表达水平显著降低,上调miR-202-5p表达可显著促进心肌细胞存活,抑制心肌细胞凋亡。进一步研究发现缺氧复氧条件下心肌细胞上清液中ROS和MDA的水平显著升高,而GSH-Px水平显著降低。氧化应激是ROS生成与抗氧化系统清除ROS能力之间的平衡失调引起的机体一系列适应性反应,过量的ROS可引起细胞不可逆损伤,导致MDA的积累,MDA含量是反应细胞氧化应激损伤程度的重要指标[10]。GSH-Px是机体重要的抗氧化酶,GSH-PX可有效清除自由基,减轻ROS对机体的进一步损伤[11]。本研究结果显示上调miR-202-5p可显著降低心肌细胞ROS和MDA的水平,升高GSH-Px水平。提示上调miR-202-5p可减轻缺氧复氧诱导的心肌细胞氧化应激和凋亡。此外,本研究结果显示缺氧复氧条件下心肌细胞中Cyclin D1的表达水平显著降低,Cleaved Caspase-3蛋白的表达水平显著升高,而上调miR-202-5p表达后Cyclin D1表达水平升高,Cleaved Caspase-3蛋白的表达水平降低,与功能实验结果相一致。提示上调miR-202-5p可通过减轻缺氧复氧诱导的心肌细胞氧化应激和凋亡发挥保护作用。
SOX基因家族是一种转录因子编码基因,具有高度保守的HMG盒序列。SOX基因家族可分为10个亚族(A-J),SOX6是SOX D亚组的重要成员[12]。SOX6最初是从成年小鼠睾丸cDNA文库中分离出来,在心肌细胞发育和心脏分化过程中发挥着重要作用[13-14]。在心肌细胞P19CL6分化晚期,SOX6可促进心肌细胞凋亡,miR-19b通过靶向干扰SOX6基因表达,促进P19CL6细胞的增殖抑制细胞凋亡[6,15]。脂多糖刺激可促进心肌细胞中SOX6表达,miR-499通过调控SOX6表达激活Bcl-2通路促进脂多糖诱导的心肌细胞凋亡[16]。miR-499-5p通过抑制SOX6表达还可减轻缺氧复氧诱导的心肌细胞损伤[17]。本研究结果显示,在缺氧复氧条件下心肌细胞中SOX6的表达水平显著降低,与SHI等[17]研究发现一致。同时本研究通过双荧光素酶报告基因实验证实SOX6是miR-202-5p的靶基因,且Western blot显示miR-202-5p可负性调控SOX6的表达。此外,进一步研究发现上调SOX6可部分逆转miR-202-5p对心肌细胞增殖、凋亡和氧化应激水平的影响。提示过表达miR-202-5p通过靶向下调SOX6对缺氧复氧诱导的心肌细胞氧化应激和凋亡发挥保护作用。
综上所述,缺氧复氧诱导的心肌细胞中miR-202-5p表达下调,SOX6表达上调。上调miR-202-5p通过靶向SOX6抑制心肌细胞氧化应激水平和缺氧复氧诱导的心肌细胞凋亡。本研究发现为心肌I/R损伤治疗提供了新的思路。
