高脂饮食诱导肥胖小鼠白色脂肪组织中IL-33的表达及意义①
2021-05-27王文茜宋苗苗王玉冰马艺源宋向凤新乡医学院免疫学教研室新乡453003
开 悦 刘 虎 王文茜 宋苗苗 王玉冰 谢 赟 马艺源 唐 颖 宋向凤新乡医学院免疫学教研室新乡453003
肥胖是由遗传、饮食、生活方式和环境等多种因素相互作用而引起的一种综合征[1]。近年来肥胖人数在全球范围内逐年升高,免疫平衡失调是其发病机制之一[2]。脂肪是人体的重要组成部分,按分布部位的不同可将其分为皮下脂肪和内脏脂肪,它们的作用不完全一样,一般认为内脏脂肪的含量与代谢性疾病的关系更为密切[3-4]。IL-33是新发现的IL-1家族的细胞因子,诱导Th2细胞、ILC2细胞、Treg细胞、M2型巨噬细胞和嗜酸性粒细胞分泌IL-4、IL-5和IL-13[5-6]。近年来一些研究报道IL-33与肥胖发生的关系,但结果并不完全一致,而不同类型的白色脂肪组织内IL-33的表达情况还未见报道。本研究探讨在肥胖发生发展中IL-33的表达水平和意义。
1 材料与方法
1.1 材料
1.1.1 细胞株 小鼠胚胎成纤维细胞(前脂肪细胞)3T3-L1细胞株购于北京协和细胞资源中心。
1.1.2 实验动物 6~8周龄的C57BL/6雄性小鼠(22~25 g)购于北京维通利华实验动物技术有限公司。在恒定的环境条件下,12 h的明暗交替周期饲养,动物自由摄食及饮水。
1.1.3 试剂与仪器 高糖DMEM培养基购于美国Gibco公司,胰岛素购于江苏万邦生化医药股份有限公司,IL-33 ELISA试剂盒购于美国Biolegend公司,小鼠高脂饲料购于美国Research diets公司,Western blot所用抗体购于美国Abways公司和Proteintech公司,RT-PCR所用试剂盒购于日本TaKaRa公司。倒置显微镜购于日本Nikom公司,化学发光成像仪购于法国Vilber lourmat公司,实时荧光定量PCR仪(Thermo Fisher Scientific,Quant-Studio5)购于美国Thermo Fisher Scientific公司,酶标仪(SpectraMax iD3)购于美国Molecdar Devices公司。
1.1.4 基因引物序列 RT-PCR所用的引物碱基序列由上海生工合成,序列如下:β-actin:上游:5′-GAAATAGTGCGTGACATCAAAG-3′,下游:5′-TGTAGTTTCATGGATGCCACAG-3′;IL-33:上游:5′-CGGATCCACTTCACTTTTAACACAGTC-3′,下游:5′-GAGATCTTTAGATTTTCGAGAGCTTA-3′。
1.2 方法
1.2.1 细胞培养及诱导分化 3T3-L1前脂肪细胞按常规方法培养在含10%胎牛血清的高糖DMEM培养基中。诱导分化的诱导剂为含地塞米松、IBMX、胰岛素和10%胎牛血清的高糖DMEM。细胞培养和诱导分化条件均为5%CO2和37℃。
1.2.2 实验动物及造模 6~8周龄的C57BL/6雄性小鼠在SPF级别的动物饲养室中正常饮食适应性饲养1周后随机分为对照组(ND)和高脂组(HFD),每组5只小鼠,分别给予充足的正常饲料和高脂饲料饲养10周。在此期间每隔1周称重,记录2组小鼠的体重变化。高脂饮食诱导的肥胖小鼠造模成功的标志为HFD组小鼠体重为ND组体重的130%以上。
1.2.3 全自动生化分析仪测血糖血脂 小鼠禁食10 h,麻醉后眼球取血,室温静置1 h,待血液自然凝固,分离血清,用全自动生化分析仪检测小鼠空腹血糖和血脂。
1.2.4 ELISA 按1.2.3方法分离小鼠血清,取2倍稀释后的血清50μl,按说明书检测小鼠血清中的IL-33,用双波长法测定OD值,再根据标准曲线换算出浓度。
1.2.5 Western blot 小鼠禁食10 h,麻醉后颈椎脱臼法处死小鼠,20 min内解剖腹部取出皮下和内脏脂肪组织,分别取0.1 g组织在液氮中研磨,用含1%蛋白酶抑制剂的RIPA裂解液裂解组织中的总蛋白,总蛋白变性后电泳、电转,封闭后用稀释1 000倍的一抗孵育过夜,再用5 000倍稀释后的HRP标记的二抗孵育1 h,化学发光成像仪检测总蛋白中目的蛋白的含量。
1.2.6 RT-PCR 按1.2.5方法取出皮下和内脏脂肪组织,分别取0.1 g组织在液氮中研磨,TRIzol法提取出组织中的总RNA,进行逆转录和RT-PCR,检测出扩增基因片段的Ct值,用2-ΔΔCt法计算出其相对表达量。
1.3 统计学方法 实验结果均采用Graphpad Prism Version 8.1软件分析,结果用3次独立实验的描述,用Student′st-test比较差异,P<0.05认为差异具有统计学意义。
2 结果
2.1 3T3-L1细胞诱导分化后IL-33的自我调节3T3-L1细胞加诱导剂诱导分化10 d后,细胞内的IL-33含量明显升高(图1A,P<0.05),但ELISA检测的细胞培养上清中IL-33含量无显著变化(图1B,P>0.05),与蛋白水平相反的是,细胞在诱导分化后IL-33 mRNA表达下调(图1C,P<0.05)。
2.2 高脂饮食对小鼠脂肪组织的影响 C57BL/6小鼠7周龄开始高脂饮食诱导肥胖模型,高脂饮食HFD小鼠从高脂饮食2周时体重就明显高于ND小鼠,10周后,HFD小鼠体重远远超过ND小鼠(图2A,P<0.05)。两组小鼠的皮下脂肪组织(subcutaneous adipose tissue,SAT)和内脏脂肪组织(visceral adipose tissue,VAT)重量也都存在显著的统计学差异(图2B,P<0.05)。
2.3 高脂饮食促使小鼠糖代谢及脂代谢紊乱 高脂饮食10周后,取小鼠血清用比色法检测空腹血糖和血清脂代谢指标,结果显示与ND组的小鼠相比,NFD组的肥胖小鼠空腹血糖水平明显升高,血清中胆固醇(TC)和高密度脂蛋白(HDL)含量升高(图3,P<0.05),但血清中三酰甘油(TG)和低密度脂蛋白(LDL)无显著变化。
2.4 高脂饮食诱导的小鼠血清中IL-33水平升高ELISA测定结果显示,与ND组的小鼠相比,NFD组肥胖小鼠血清中IL-33含量显著升高(图4,P<0.05)。
2.5 高脂饮食诱导的肥胖小鼠不同类型的白色脂肪组织中IL-33的水平 Western blot的结果证明,与ND组的小鼠相比,NFD组的肥胖小鼠SAT组织中IL-33的蛋白表达水平升高(图5A,P<0.05),而RT-PCR的结果显示,HFD小鼠的SAT中IL-33 mRNA的表达反而降低(图5B,P<0.05)。与SAT组织相反,HFD小鼠的内脏脂肪组织中IL-33的蛋白表达水平比ND小鼠显著降低(图5C,P<0.05),而RT-PCR的结果显示,HFD小鼠的VAT中IL-33 mRNA的表达升高(图5D,P<0.05)。
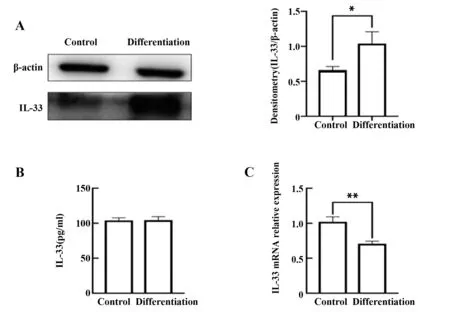
图1 3T3-L1细胞诱导分化对IL-33的影响Fig.1 Effect of 3T3-L1 cells induced differentiation on IL-33
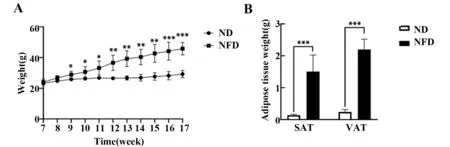
图2 高脂饮食诱导对小鼠体重和白色脂肪组织的影响Fig.2 Effects of high-fat diet on body weight and white adipose tissue in mice
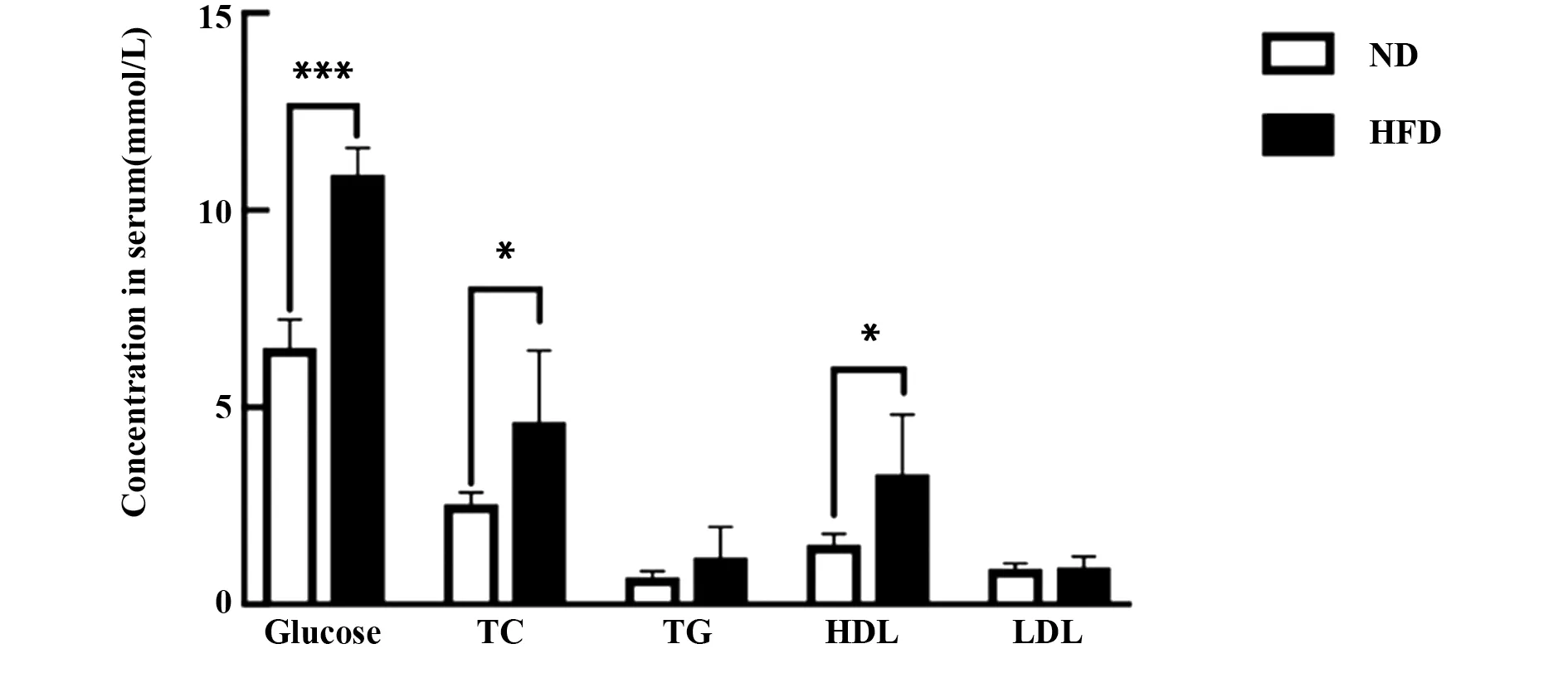
图3 高脂饮食诱导的小鼠空腹血糖、血清脂代谢指标的变化Fig.3 Changes of fasting blood glucose and serum lipid metabolism in high-fat diet induced mice
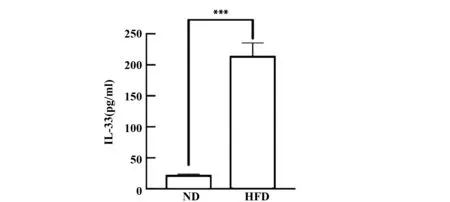
图4 高脂饮食诱导的小鼠血清中IL-33的水平Fig.4 Serum IL-33 concentrations in high-fat diet induced mice
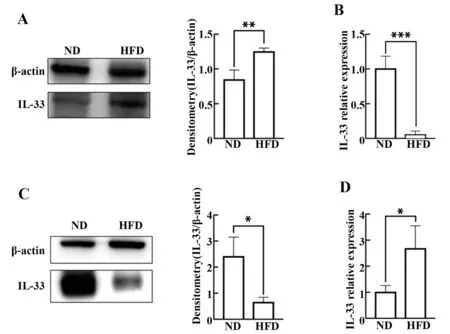
图5 高脂饮食诱导的肥胖小鼠不同白色脂肪组织中IL-33的水平Fig.5 IL-33 expression in different white adipose tissue of mice induced by high-fat diet
3 讨论
肥胖及其相关疾病的发病率在世界各地不断上升。根据世界卫生组织和经济合作与发展组织的流行病学报告,肥胖是全球第五大死亡原因之一[1]。肥胖及其相关的代谢性疾病已经成为目前科学研究的热点。现在人们已经认识到肥胖的心血管风险更多的与身体脂肪分布有关,而不是全身脂肪总量。据报道中心型肥胖的人比妇臀大肌、外周或女性肥胖的人患肥胖相关疾病的风险更大[3]。与皮下区域的脂肪不同,出现在胸腔、腹腔、盆腔脏器周围的脂肪称为内脏脂肪,性腺、肾脏、肠系膜等周围的脂肪组织均属VAT。SAT与VAT的脂肪细胞类型、内分泌功能、脂解活性和对胰岛素及其他激素的反应不同。与SAT相比,VAT具有更多的细胞性、血管性、神经支配性,脂肪细胞代谢活性更强,对胰岛素更有抵抗力,比SAT更能预测死亡率[3]。所以更多的研究者把目光聚焦在VAT中炎症与肥胖及其相关代谢性疾病的关系上[4-8]。前期研究也发现了肥胖可以使VAT内的炎症持续存在[2]。与VAT不同,SAT表现出一些保护内分泌和炎症的特性,这也许可以解释为什么有些人长期肥胖却仍然代谢健康[9]。由此可见,不同部位脂肪组织对肥胖所致慢性炎症的影响是截然不同的。
IL-33(又称IL-1F11)是新发现的IL-1家族的第11位成员,是具有双效型的炎症早期诱导剂。IL-33表达在多种细胞类型中,当细胞受应激或炎症刺激后,会被动释放或主动分泌IL-33,通过NF-κB和MAPK途径,可刺激包括Th2细胞、Treg细胞、ILC2细胞、肥大细胞和嗜酸性粒细胞在内的多种免疫细胞分泌IL-4、IL-5、IL-13[10-13]。IL-33在肥胖过程中对脂肪组织炎症的发生起保护作用[6]。据报道,在肥胖Wistar大鼠和高脂饮食诱导的C57BL/6J肥胖小鼠脂肪组织中IL-33 mRNA表达升高[14-15]。在肥胖小鼠脂肪组织中,IL-33的表达并没有升高,而肥胖Zucker大鼠脂肪组织中IL-33的mRNA水平反而降低[15-16]。从以上研究可以看出,IL-33在肥胖状态下的表达有着不同的结果,推测这些不同结果的原因可能是小鼠品系的差别和脂肪组织的类型不同。
本研究探讨了IL-33在肥胖发生中的变化。前脂肪细胞诱导分化后的成熟脂肪细胞IL-33蛋白水平升高,细胞培养上清中IL-33含量无明显变化,所以细胞在诱导成熟过程中合成的IL-33并没有分泌至胞外,而是贮存在细胞内,待细胞应激或损伤后作为警报素释放出来[8,17]。3T3-L1细胞内组成性表达的IL-33随着脂质的增多不断积累,其mRNA的表达反而下降,这说明IL-33在细胞储存脂质的过程中,存在自身基因水平的负反馈调节。利用高脂饮食诱导C57BL/6成年雄性小鼠10周,建立小鼠肥胖模型,与同周龄正常饮食的小鼠相比,肥胖小鼠的体重、SAT和VAT的重量均明显升高,代谢指标紊乱。实验数据表明IL-33在肥胖小鼠血清和皮下脂肪组织中含量增多,这与细胞实验结果一致,说明肥胖时机体能通过上调IL-33来纠正其带来的炎症代谢紊乱。VAT中的IL-33含量下降,证明了VAT在肥胖的炎症中起到与SAT正好相反的促进作用[3,9]。另外,皮下和内脏脂肪组织中IL-33的mRNA相对表达水平与其蛋白水平的趋势相反,这与细胞实验结果正好吻合,说明脂肪组织内部也存在负反馈机制,以调节IL-33蛋白水平的表达失衡。
总之,在肥胖状态下IL-33在不同类型的白色脂肪组织内表达是不同的,这与脂肪沉积的部位有关,而且在脂肪组织中存在的负反馈机制可能对肥胖及其相关疾病的发生起到抑制的作用。
