LPS对天然免疫细胞能量代谢影响的研究进展①
2021-05-27龙全梅张天琦王建发帅黑龙江八一农垦大学动物科技学院黑龙江省牛病防制重点实验室大庆163319
龙全梅 张天琦 王建发 武 瑞 连 帅黑龙江八一农垦大学动物科技学院黑龙江省牛病防制重点实验室大庆163319
天然免疫应答是机体最早也是发生最快的免疫应答,在机体抗感染中具有重要作用。抗原穿越皮肤、黏膜等第一道防线进入组织后,首先激活天然免疫细胞,启动非特异免疫反应,之后引发由淋巴细胞介导的特异性免疫应答。能量代谢可塑性对免疫细胞功能起重要作用,免疫细胞依赖氧化磷酸化代谢和糖酵解代谢以及磷酸戊糖途径代谢等代谢平衡维持生理状态下细胞免疫稳态。癌症、肥胖、高血脂、细菌感染等代谢性疾病中,细菌细胞壁降解,其主要成分LPS大量进入血液循环,激活免疫细胞,刺激机体启动免疫反应[1]。血液循环中LPS浓度过高时,则诱导过度的免疫效应导致机体损伤[2-3]。LPS可引发天然免疫细胞代谢重编程从而激活细胞,免疫细胞氧化磷酸化水平降低而选择糖酵解、磷酸戊糖途径及脂肪酸代谢。糖酵解途径仅能产生2分子ATP,而氧化磷酸化可产生至少32分子ATP,LPS刺激下免疫细胞选择利用低产能的糖酵解途径[4]。LPS刺激下天然免疫细胞选择不同的能量代谢途径从而发挥不同的免疫作用,能量代谢途径的可塑性与免疫功能的可塑性密切相关。本文对LPS刺激下天然免疫细胞和能量代谢之间的关系进行梳理,选择更合理的免疫代谢调控方案以维持人和动物的天然免疫稳态。
1 LPS抑制天然免疫细胞氧化磷酸化过程
LPS可识别天然免疫细胞表面Toll样受体4(TLR4),通过TLR4信号通路抑制呼吸酶活性,损伤细胞呼吸链,导致催化三羧酸(tricarboxylic acid,TCA)循环的酶活性降低[5-6]。TCA循环与呼吸链偶联,影响NADH、FADH2生成,无法通过呼吸链将电子传递给氧原子,线粒体膜两侧质子梯度被破坏,从而抑制氧化磷酸化合成ATP。由于氧化磷酸化代谢为底物水平磷酸化和呼吸链电子传递链偶联生成ATP的过程,是机体供能的主要方式,因此TCA循环物蓄积及呼吸链抑制均可影响免疫细胞功能[7]。
体外培养单核细胞经LPS刺激,TCA循环中异柠檬酸裂解酶和琥珀酸脱氢酶活性降低,柠檬酸盐和琥珀酸盐蓄积,蓄积的柠檬酸盐在免疫应答基因1(IRG1)作用下衍生为代谢产物衣康酸,起直接杀菌作用[8]。琥珀酸盐则通过抑制脯氨酰羟化酶(proline hydroxylose,PHO)诱导缺氧诱导因子-1α(hypoxia-in ducible faction-1α,HIF-1α)及核因子-κB(NF-κB)产生IL-1β和TNF-α引发炎症反应[9-10]。HIF-1α是糖酵解途径的关键激酶,氧正常条件下由PHO催化降解,PHO活性降低则减少HIF-1α降解[3]。LPS刺激下,单核细胞耗氧率下降,电子传递、H+传递受阻,氧利用率下降。电子传递链中的NADH-Q还原酶复合体Ⅰ、琥珀酸-Q还原酶复合体Ⅱ及细胞色素还原酶复合体、细胞色素氧化酶复合体等酶活性降低,细胞氧化磷酸化途径受到抑制。糖酵解生成的丙酮酸无法进入TCA循环彻底氧化生成ATP,由于细胞对能量的需求导致糖酵解代谢代偿性增强。低浓度LPS并不会导致氧化磷酸化减少[7,11-12]。
LPS刺激树突状细胞(DC)后,其代谢状态发生改变。DC中丙酮酸无法彻底氧化,而是生成乳酸分泌到体外或进入脂肪酸的β氧化途径或导致柠檬酸盐蓄积,柠檬酸盐经穿梭作用从线粒体运出,进入胞液用于脂肪酸合成。脂肪酸可用于DC中高尔基体和内质网合成和蛋白分泌,对DC的抗原呈递起重要作用[13]。BUCK等[14]研究表明LPS刺激T细胞代谢重塑过程可能导致线粒体大小改变,线粒体嵴紧缩有利于氧化磷酸化和脂肪酸氧化,而线粒体嵴松动,线粒体形态膨胀,影响电子传递链的传输效率,影响TCA循环并导致ATP产生减少(图1)。
2 LPS促进天然免疫细胞糖酵解
天然免疫细胞激活需要大量的生物能量及合成细胞分泌物所需的底物,能量和底物对于天然免疫细胞合成免疫相关分子、发挥免疫作用不可或缺。LPS刺激下氧化磷酸化途径受到抑制,代偿性糖酵解途径可快速产生ATP和免疫细胞激活所需底物。因此,免疫细胞通过迅速增强糖酵解代谢,部分补偿氧化磷酸化抑制所缺失的能量和底物[7-9]。
体外培养单核细胞经LPS刺激后可激活PI3KAkt-mTORC2信号通路,细胞膜上的磷脂酰肌醇激酶(PI3K)募集蛋白激酶B(Akt),促进雷帕霉素靶蛋白复合体(mTORC2)磷酸化[15-16]。Akt在调控免疫细胞功能方面发挥重要作用,包括细胞代谢、生长、增殖、转录及蛋白质合成等。Akt促进诱导型一氧化氮(iNOs)生成,iNOs从精氨酸中快速产生一氧化氮(NO)促进糖酵解途径活化。缺氧依赖的mTOR磷酸化通过减少HIF-1α降解促进糖酵解[17]。缺乏HIF-1α的细胞中LPS仍能诱导糖酵解的关键激酶磷酸果糖激酶-2,提示除HIF-1α外,其他分子也参与促进糖酵解。LPS刺激下,DC以HIF非依赖的方式激活TANK结合激酶1(TBK1)或导致NF-κB激酶ε(IKKε)的抑制剂降解,而非通过PI3K/mTORC2信号通路直接激活Akt促进糖酵解代谢发挥抗原呈递功能。
LPS刺激巨噬细胞可降低丙酮酸激酶同工酶M2(PKM2)活性,低活性的PKM2可促进乳酸生成,以二聚体形式与HIF-1α作用,促进HIF-1α依赖基因表达进而增强糖酵解代谢[18]。当HIF被抑制时,高活性PKM2以四聚体形式诱导M1型巨噬细胞转化为M2型[9,19]。因此,代谢控制免疫细胞表型并进一步影响其炎症调节功能。甘油醛-3-磷酸脱氢酶(GAPDH)是糖酵解酶,与IFN-γmRNA结合并抑制其翻译。LPS刺激下,IFN-γmRNA与GAPDH解离,进入翻译过程,GAPDH促进糖酵解产生ATP,因此,GAPDH可控制免疫细胞IFN-γ产生,进一步证明细胞代谢与炎症作用密切相关[20-21]。
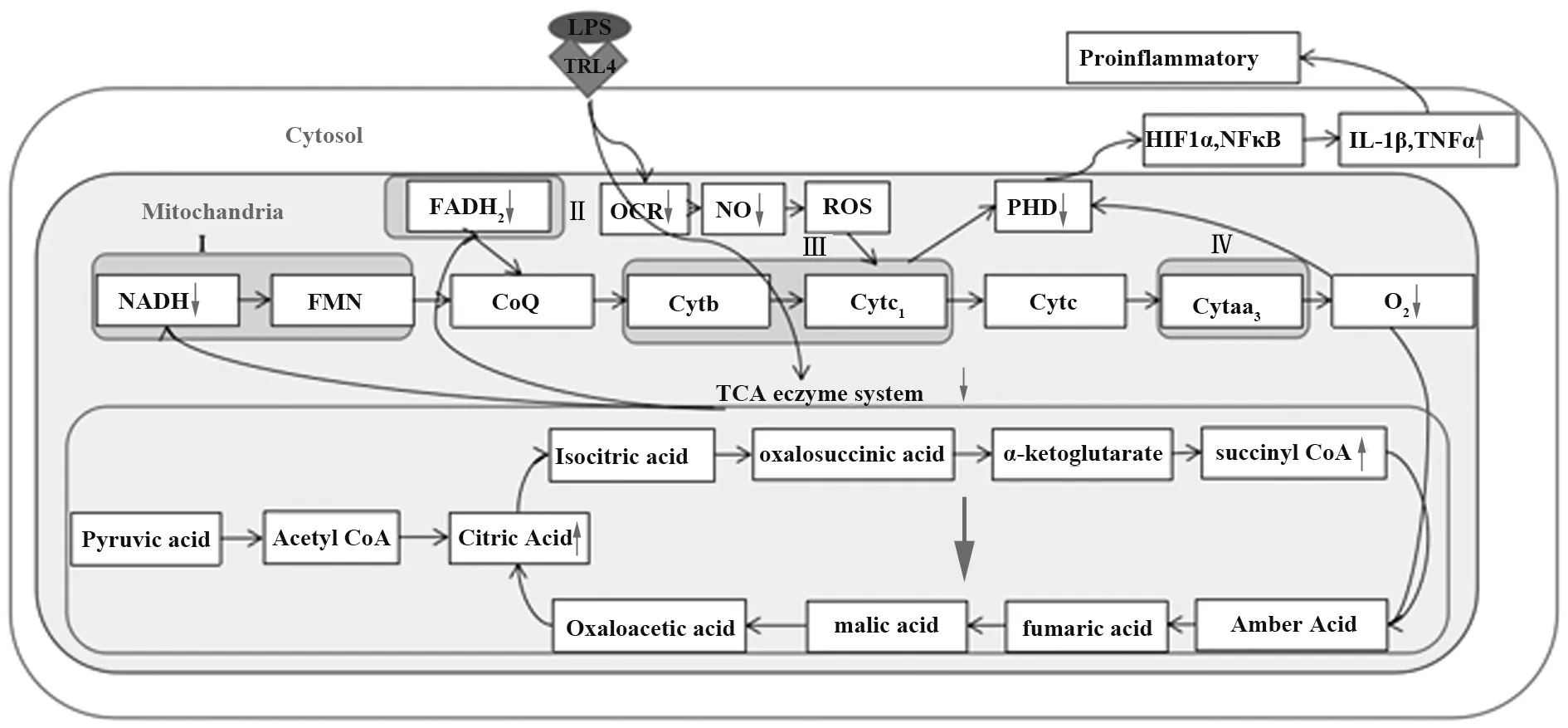
图1 LPS刺激天然免疫细胞后的氧化磷酸化代谢机制图Fig.1 Oxidative phosphorylation metabolic mechanism diagram after LPS stimulates natural immune cells
3 LPS调控天然免疫细胞脂肪酸代谢途径
脂肪酸代谢对免疫应激和免疫防御具有重要作用。由脂肪酸氧化所产生的ATP数量高于上述2种糖氧化途径[22]。LPS刺激下,免疫细胞氧化磷酸化受抑制、糖酵解增强。但在某些疾病中,如化脓性脑膜炎、胸腔积液或肿瘤等,通常伴有葡萄糖浓度下降,葡萄糖供给量处于负平衡,导致免疫反应无法充分进行[23]。
细胞过度糖酵解,会导致底物耗尽而加快凋亡,LPS刺激下,低糖供应使单核细胞代谢过程转向脂肪酸氧化[23]。因此,细胞对脂肪酸代谢的依赖性增加,总AMP数增加,AMP/ATP值上升,激活腺苷酸活化的蛋白激酶(AMPK),启动多种分解代谢途径,如促进葡萄糖和脂肪酸摄取、氧化、糖酵解和细胞自噬、抑制脂肪合成等[24-25]。AMPK能够促进AMP分解代谢,且在促进糖酵解、脂肪酸氧化等ATP产生的代谢同时抑制ATP消耗,但AMPK持续激活导致细胞能量代谢过程紊乱发生自噬[26]。LPS刺激下氧化磷酸化抑制导致蓄积的柠檬酸进入胞液,胞液中的柠檬酸裂解酶催化裂解为乙酰辅酶A和草酰乙酸。乙酰辅酶A进入脂肪酸合成途径,而草酰乙酸在苹果酸脱氢酶作用下生成苹果酸重新进入线粒体,或在苹果酸酶作用下生成丙酮酸,产生少量NADPH用于脂肪酸合成。LPS刺激下,糖酵解受限,免疫细胞选择脂肪酸代谢维持免疫功能。但AMPK持续激活表明细胞转向脂肪酸代谢是缺糖保护机制,但并不能完全弥补细胞能量代谢。
效应T细胞在LPS刺激下通过促进脂肪酸合成用于生长及炎症因子分泌,而记忆性T细胞生长则由于脂肪酸氧化抑制而长期滞留于机体[27-28]。LPS刺激下,由于氧化磷酸化受限,效应T细胞促进糖酵解快速产生ATP发挥促炎作用。记忆T细胞由于其免疫效应发生在效应T细胞之后,故其在被LPS激活时不需要依靠高速率的糖酵解产生ATP,而是促进脂肪酸代谢维持其长期促炎作用,与DC中的代谢选择类似。由于DC为非增殖性细胞,LPS刺激下,由糖酵解快速产生ATP支持DC激活,而后期(9 h后)DC持续激活产生ATP和底物依赖于脂肪酸氧化和脂肪酸于合成[29]。LPS刺激下,M1型巨噬细胞氧化磷酸化受抑制,使其依赖于糖酵解快速发挥作用,而M2型巨噬细胞并不产生ROS,呼吸链完整,且磷酸戊糖途径也受限,使M2型巨噬细胞能够更好地发挥炎症抑制作用,阻断氧化磷酸化促使M2型向M1型转化[30]。此外,过氧化物酶体增殖剂激活受体(PPARs)是核激素受体家族中的配体激活受体,LPS刺激下PPARs活性升高,正向调节脂肪酸转运蛋白和肉毒碱棕榈酰转移酶1β表达,促进脂肪酸β氧化抑制脂质合成[27]。
4 LPS调控天然免疫细胞磷酸戊糖代谢途径
磷酸戊糖途径是糖代谢的支路,LPS刺激下,磷酸戊糖代谢增强,生成的中间体可进入TCA循环等生成能量,核糖-5-磷酸可合成核苷酸辅酶、核糖核苷酸及脱氧核苷酸用于细胞DNA及RNA合成。磷酸戊糖途径的中间代谢产物还原型辅酶Ⅱ(NADPH)可作为氢供体参与脂肪酸、胆固醇和类固醇激素、核苷酸及脂类的生物合成,可作为谷胱甘肽还原酶辅酶[31]。
LPS刺激下M1型巨噬细胞依赖NADPH在呼吸爆发期间产生ROS发挥杀菌作用,促发磷酸戊糖途径[11]。但同时磷酸戊糖途径产生还原型谷胱甘肽(GSH)等抗氧化物与过氧化物及自由基结合防止组织过度损伤。碳水化合物激酶样蛋白酶(SHK)是磷酸戊糖途径的限制酶,LPS刺激下M2型巨噬细胞SHK增多,而M1型巨噬细胞SHK含量较低。M1型巨噬细胞增殖能力较弱,LPS刺激下磷酸戊糖代谢途径的中间产物支持快速生成mRNA,以基因调控蛋白合成的途径产生促炎细胞因子[13]。此外,单核细胞的吞噬作用、DC的抗原呈递作用都需要磷酸戊糖途径生成的NADPH及其中间代谢产物。可见,LPS刺激下磷酸戊糖途径增强对维持免疫细胞功能具有重要作用(图2)。
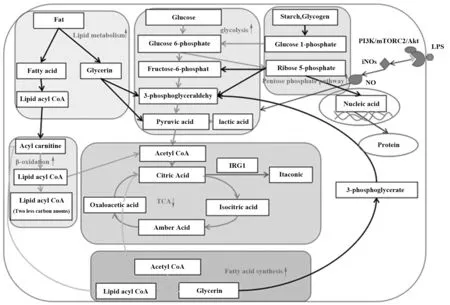
图2 LPS刺激天然免疫细胞后的糖脂代谢机制图Fig.2 Glucose and lipid metabolism mechanism diagram after LPSstimulates natural immune cell
5 LPS通过免疫与代谢相互调节影响疾病发生发展
LPS可刺激多种免疫细胞发生代谢重编程,免疫细胞的激活似乎必须经过代谢重编程。代谢重编程下,脂肪酸代谢、糖酵解代谢、磷酸戊糖代谢可补偿氧化磷酸化受抑制时的生物能量及物质需求,且免疫细胞发挥免疫功能也受代谢重编程调控。单核/巨噬细胞在LPS刺激下,氧化磷酸化受抑制,免疫细胞通过代谢重编程增强糖酵解及脂肪酸代谢产生能量维持吞噬细胞吞噬作用,并通过激活多种信号转导通路诱导产生IL-1β、IL-8等促炎细胞因子及TNF-α发挥促炎作用[32-33]。LPS引起的代谢综合征是多种疾病的病理基础,代谢紊乱可导致机体免疫功能紊乱。多种代谢性疾病,如肥胖、Ⅱ型糖尿病、内毒素血症等外周血液循环中都可见LPS浓度升高[34-35]。因此,生物能量转化使代谢与炎症及免疫功能密切相关。慢性代谢性疾病导致机体患其他疾病的可能性更高,代谢与免疫反应的联系对机体健康至关重要。
6 小结
LPS可使天然免疫细胞发生代谢重编程,并通过代谢调控天然免疫细胞功能。深入理解代谢途径,研究代谢途径对细胞信号传导和细胞增殖分化的调控,研究不同细胞群如何响应代谢重编程,将为细菌感染、糖尿病、脂肪肝甚至癌症等疾病防治提供新思路。
