基于点击反应合成双生物活性分子的研究
2021-05-27朱乾贵王天然于博然
朱乾贵,王天然,于博然,肖 猱
(首都医科大学 药学院化学生物学系,北京100069)
点击化学(click chemistry)是由2001年的诺贝尔化学奖获得者美国化学家SHARPLESS首次提出的[1]。应用最普遍的一类是由Cu(I)催化叠氮化物与端炔化物的加成反应(CuAAC),可生成1,2,3-三唑五元环化合物[2-4]。由于点击反应自身具备着很多优点,如操作简单、产物杂质少、反应条件温和、具有高度专一性、反应过程受到的干扰小和能在水或各种有机溶剂中发生等,因此得到了越来越广泛的关注[5-7]。
钌(II)配合物可作为DNA探针或是作为抗肿瘤药物使用,其结构直接影响应用效果[6-9]。钌(II)配合物的配体多为二吡啶和三吡啶衍生物,但二吡啶或三吡啶相连的功能基团种类有限。FLOOD等[10]曾报道2-(4-取代-1,2,3-三唑)亚甲基吡啶(tapy)可取代二吡啶,2,6-二(4-取代-1,2,3-三唑)亚甲基吡啶(bitapy)可取代三吡啶,ULRICH和他的合作者以及一些科研工作这也证实了这一发现[11]。同时,含有bitapy结构的化合物分子已在活性酶抑制剂、抗肿瘤药物、生物活性物质荧光探针等领域发挥积极作用[12-14]。这一发现使得钌(II)配体的种类得到了极大的丰富和拓展[15]。
本研究结合之前的研究成果[16-19],应用点击化学反应,采用温和的合成路线,成功合成了两类结构可控的bitapy配体分子。选取两种结构明显有差异
的叠氮化物四乙酰基-β-D-叠氮代葡萄糖和齐多夫定(3′-叠氮-3′-脱氧胸苷)为原料,与2,6-二乙炔基吡啶(DEP)发生点击反应后制备了含生物活性的配体分子。
1 实验部分
1.1 仪器与试剂
1.1.1 仪器
附带DL-400型循环冷却器的R-1001-VN型旋转蒸发仪:郑州长城科工贸有限公司,WFH-204B型手提式紫外灯:上海精科实业有限公司,核磁共振波谱仪(300 MHz):美国布鲁克公司,三重四级杆液质联用仪:美国沃特世公司。
1.1.2 试剂
三甲基乙炔基硅,2,6-二溴吡啶,抗坏血酸,五水硫酸铜,无水硫酸钠,乙二胺四乙酸(EDTA),氨水,2,3,4,6-四乙酰氧基-α-D-吡喃葡萄糖溴化物(TAGP-Br),齐多夫定(AZT),氘代试剂等试剂购自上海阿拉丁生化科技股份有限公司;N,N-二甲基甲酰胺(DMF)、吡啶、甲醇、二氯甲烷等试剂购自北京伊诺凯科技有限公司;实验过程所用水为去离子水。
1.2 化合物的合成
1.2.1 合成2,6-二((三甲基硅基)乙炔基)吡啶(2,6-bis((trimethylsilyl)ethynyl)pyridine, BTEP)

1.2.2 合成2,6-二乙炔基吡啶(2,6-diethynylpyridine, DEP)
向一个300 mL的烧瓶中加入2,6-二((三甲基硅基)乙炔基)吡啶(2.7 g, 10.0 mmol),TBAF/四氢呋喃(1 mol·L-1, 10.0 mL, 10.0 mmol),THF (120 mL)和甲醇(4 mL)。将所得混合物在室温下搅拌30 min后倒入蒸馏水停止反应。经二氯甲烷萃取后的有机层以盐水洗涤,用无水硫酸钠(Na2SO4)干燥后过滤。旋蒸除去溶剂,粗产物经填有硅胶的柱色谱洗脱(正己烷/二氯甲烷,体积比为1/1)得2,6-二乙炔基吡啶,除去洗脱液后产物为乳白色固体。产量:1.01 g,产率:79.4%。1H NMR (CDCl3, 300 MHz)δ: 7.66 (t, 1H,J= 15.62 Hz), 7.45 (d, 2H,J= 7.80 Hz), 3.17 (s, 2H)。ESI-MS (m/z): 128.0 [DEP + H+]+(C9H6N+的理论值: 128.0)。
1.2.3 合成叠氮化物2, 3, 4, 6-tetra-O-acetyl-α-D-glucopyranosyl azide (TAGP-N3)
TAGP-N3可根据前期报道的操作步骤合成得到[20-21]。在无水DMF (25 mL)中加入2,3,4,6-tetra-O-acetyl-β-D-glucopyranosyl bromide (TAGP-Br) (5.0 g, 12.2 mmol)和NaN3(1.2 g, 18.5 mmol),室温下搅拌反应8 h,反应通过TLC监测(二氯甲烷/乙酸乙酯, 体积比为3/1),直到原料完全消失。待反应完全后,用蒸馏水(50 mL)稀释,并用乙酸乙酯进行萃取。将有机相经无水Na2SO4干燥、过滤并旋蒸至干燥,所得白色固体产物待下一步反应。产量:4.1 g,产率:90.1%。1H NMR (DMSO-d6, 300 MHz)δ: 5.23 (t, 1H,J= 18.85 Hz), 5.11 (t, 1H,J= 19.34 Hz), 4.99 (t, 1H,J= 18.30 Hz), 4.65 (d, 1H,J= 8.84 Hz), 4.31~4.15 (m, 2H), 3.83~3.78 (m, 1H), 2.05 (q, 12H,J= 27.87 Hz);13C NMR (75 MHz, CDCl3)δ: 170.69, 170.20, 169.40, 169.29, 88.02, 74.15, 72.73, 70.77, 68.02, 61.78, 20.79, 20.64。
1.2.4 合成2-ethynyl-6-(1-(2,3,4,6-tetra-O-acetyl-α-D-glucopyranosyl)-1H-1,2,3-triazol-4-yl) pyridine (TAGP-etapy)
在烧瓶中加入2,6-二乙炔基吡啶(0.6 g, 4.8 mmol),五水硫酸铜(0.4 g, 0.8 mmol),抗坏血酸(0.7 g, 4.0 mmol),用适量的DMF溶解后加入TAGP-N3(1.2 g, 3.2 mmol)。室温反应5 h TLC检测,待反应结束后,加入少量的EDTA和适量氨水。然后转移到分液漏斗中用乙酸乙酯和蒸馏水萃取,保留有机层。将有机层经无水Na2SO4干燥,过滤,旋干。用柱层析分离纯化(乙酸乙酯/石油醚,体积比为5/1)除去2,6-二乙炔基吡啶,随后以流动相乙酸乙酯/石油醚(体积比为2/1)洗脱可得到纯产物,除去流动相后得白色固体产物。产量:1.2 g,产率:75.0%。1H NMR (300 MHz, DMSO-d6)δ: 9.13 (s, 1H), 8.08 (d, 1H,J= 7.80 Hz), 7.97 (t, 1H,J= 15.62 Hz), 7.57 (d, 1H,J= 7.59 Hz), 6.45 (d, 1H,J= 9.14 Hz), 5.83 (t, 1H,J= 18.67 Hz), 5.63 (t, 1H,J= 19.03 Hz), 5.26 (t, 1H,J= 19.54 Hz); 4.44~4.41 (m, 1H), 4.17~4.14 (m, 3H), 2.05 (q, 12H,J= 28.15 Hz);13C NMR (125 MHz, DMSO-d6)δ: 170.10, 169.62, 169.43, 168.71, 149.81, 147.19, 141.77, 138.15, 126.84, 122.90, 119.67, 84.19, 82.81, 80.62, 73.32, 71.99, 70.38, 67.57, 62.00, 30.69, 20.52, 20.42, 20.28, 19.94。
1.2.5 合成2-(1-(2, 3, 4, 6-tetra-O-acetyl-α-D-glucopyranosyl)-1H-1,2,3-triazol-4-yl)-6-(1-(2, 3, 4, 6-tetra-O-acetyl-α-D-glucopyranosyl)-1H-1,2,3-triazol-4-yl)pyridine (TAGP-bitapy-TAGP)

1.2.6 合成1-((2R,4S,5S)-5-(hydroxymethyl)-4-(4-(6-(1-(2,3,4,6-tetra-O-acetyl-α-D- glucopyranosyl)-1H-1,2,3-triazol-4-yl)pyridin-2-yl)-1H-1,2,3-triazol-1-yl)tetrahydrof-uran-2-yl)-5-methylpyrimidine-2,4(1H,3H)-dione (TAGP-bitapy-AZT)

2 结果与讨论
2.1 双端炔的合成
2-(三甲基硅基乙炔基)吡啶是制备炔基化合物2,6-二乙炔基吡啶的前体,其合成是以2,6-二溴吡啶为原料,采用易于脱去的三甲基硅烷乙炔作保护基团与2,6-二溴吡啶在低温下偶联的方法合成得到。
2,6-二乙炔基吡啶通过四丁基氟化铵(TBAF)的脱保护功能与已制备的2-(三甲基硅基乙炔基)吡啶反应制得(图1)。
2.2 双糖基配体的合成
叠氮化物的制备由相应的卤化物与叠氮化钠在DMSO或DMF中共热生成,反应过程以双分子亲核取代反应反应(SN2)进行,叠氮化反应前的原料为α构型,而反应之后的产物为β构型。
TAGP-bitapy-TAGP分子的合成采用2,6-二乙炔基吡啶(DEP)与叠氮化四乙酰基葡萄糖(TAGP-N3)为原料,利用五水硫酸铜和抗坏血酸钠为催化剂,在室温条件下通过点击反应一步可得(图2)。
2.3 糖基-核苷基分子结构的确定
新型含有双生物活性分子A-B型化合物TAGP-bitapy-AZT可增加分子与生物体结合几率和强度,具备潜在应用价值。反应过程也是应用点击反应条件以2,6-二乙炔基吡啶、叠氮化物为原料合成得到。反应条件与制备TAGP-bitapy-TAGP类似,所不同的是在一价铜离子的催化下依次进行两次点击反应而实现。具体而言,首先使用2,6-二乙炔基吡啶的一个炔基与叠氮化物TAGP-N3反应制备一端含乙炔基的前配体TAGP-etapy,而后以此一端含乙炔基的配体TAGP-etapy继续与另一叠氮化物AZT反应生成最终的配体TAGP-bitapy-AZT(图3)。

图1 2,6-二乙炔基吡啶的合成Fig.1 Synthesis of 2,6-diethynylpyridine

图2 TAGP-N3和TAGP-bitapy-TAGP的合成Fig.2 Synthesis of TAGP-N3 and TAGP-bitapy-TAGP
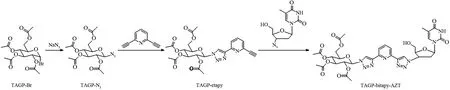
图3 TAGP-etapy和TAGP-bitapy-AZT的合成Fig.3 Synthesis of TAGP-etapy and TAGP-bitapy-AZT
3 结论
主要通过点击反应,采用具备生物活性的葡萄糖及核苷衍生物为原料,与DEP反应合成了具有bitapy结构的两类新型化合物TAGP-bitapy-TAGP和TAGP-bitapy-AZT,为制备均臂型及杂臂型金属配合物提供了条件。
