分子对接法和光谱法研究BRCA1846-871及其 五突变肽与RAD51181-200相互作用
2021-05-27符林娜曹孟杰赵东欣
符林娜, 曹孟杰, 赵东欣,卢 奎,*
(1. 河南工业大学 化学化工学院,河南 郑州 450001; 2. 郑州工程技术学院 化工食品学院,河南 郑州 450044)
乳腺癌易感基因1(BRCA1)的突变与遗传性乳腺癌有关[1]。药物治疗能有效杀死肿瘤细胞,从而治疗癌症。同时,也会损坏正常细胞,使肿瘤细胞产生耐药性,从而降低疗效[2]。RAD51蛋白作为同源重组修复双链DNA断裂的重要蛋白,与肿瘤细胞的耐药性密切相关[3]。研究表明,RAD51在许多肿瘤患者的细胞中过表达[4]。随着体内DNA修复能力的增强,肿瘤细胞的耐受性增加。因此,探索BRCA1突变体和RAD51之间是否有强相互作用具有重要意义。
BRCA1是针对乳腺癌的“抑癌基因”,参与细胞正常生长、DNA损伤修复等过程[5]。从BRCA1的结构特征来看,BRCA1可以与RAD51、p53、BRAD1等多种蛋白结合[6]。BRCA1基因测序结果显示,其与RAD51相互作用的保守序列有2段,氨基酸编码分别为782-786和846-871[7]。有研究发现,乳腺癌患者的保守序列BRCA1846-871的五个特殊结合位点易发生突变,分别是Y856、K862、R866、Q867和P871[8]。在本研究中,选择五个活性位点进行全突变研究。
同源重组修复在维持细胞遗传稳定和正常生命功能中发挥作用,RAD51的过表达会导致体内DNA同源重组修复能力的增强和肿瘤细胞的耐受性[9]。因此,影响RAD51的修复功能,可以有效逆转肿瘤对化疗和放疗的耐药性。实验表明,BRCA1与RAD51相互作用增强RAD51重组酶活性[10]。目前,主要集中于BRCA1与RAD51完整蛋白的相互作用研究,对RAD51关键肽段的研究较少。与天然的蛋白质相比,多肽可通过化学方法合成、分离和纯化。本课题组先前研究发现,RAD51181-200(SGSDVLD NVAYARAFNT DHQ)是RAD51的关键肽片段[11]。本研究中,我们设计并合成BRCA1846-871五突变肽9条,通过荧光光谱法和圆二色光谱法学研究BRCA1846-871及其五突变肽与RAD51181-200的相互作用。
1 材料与方法
1.1 仪器与试剂
Fmoc-Rink Amide-MBHA树脂、Fmoc-AA-OH氨基酸、1-羟基-7-氮杂苯并三氮唑(HOAt)、2-(7-氮杂苯并三氮唑)-N,N,N′,N′-四甲基脲六氟磷酸酯(HATU)、N,N-二异丙基乙胺(DIPEA)、茚三酮均购自上海浙江昂拓有限公司。N,N二甲基甲酰胺(DMF)、二氯甲烷(DCM)、哌啶、苯甲硫醚、三氟乙酸(TFA)、乙二硫醇、苯酚、乙醚均为分析纯,购自阿拉丁试剂(上海)有限公司。甲醇、乙腈均为色谱纯,购自天津科密欧化学试剂有限公司。pH=7.4 50 mmol·L-1Tris-HCl缓冲溶液。HPLC-1260型高效液相色谱仪:美国安捷伦公司。LCQ Fleet型号离子阱质谱仪:美国赛默飞世尔公司。Cary Eclipse型荧光分光光度计:美国安捷伦公司。MOS-500圆二色谱仪:法国Bio-logic公司。
1.2 BRCA1846-871五突变肽的设计和筛选
CABS-dock方法是一种蛋白受体与多肽柔性对接的研究方法,利用该程序构建多肽-蛋白质复合物结构模型(http://biocomp.chem.uw.edu.pl/CABSdock/)。首先从蛋白质数据库下载RAD51蛋白的结构(ID:1N0W),借助CABS-dock获得BRCA1846-871- RAD51复合物结构,BRCA1846-871的结构通过输入其一级结构肽序(表1)得到。参数设置全部默认。受体蛋白和肽序经过CABS-dock柔性对接,按照相应的算法筛选,获得10个最终的模型,并对这10个模型进行全原子重建。根据配体与受体之间结合的吉布斯自由能(ΔGbind)能量越低,结构越稳定的原则,筛选出最理想的复合物模型[12]。结合文献已经报道出的BRCA1846-871片段中五个活性位点(Y856、K862、R866、Q867、P871),使用DS软件计算平台(Discovery Studio 2017 R2)对该复合物模型中的BRCA1846-871片段肽进行五突变设计[13]。
1.3 多肽的合成
本文以Fmoc-Rink-amide-MBHA树脂为载体,以HATU、HOBT为缩合剂,DIPEA为活化剂,使用Fmoc保护固相合成法合成BRCA1846-871及其五突变肽和RAD51181-200。以RAD51181-200为例,合成多肽的步骤如下:称量Fmoc-Rink-Amide-MBHA树脂(1.5 g)加入合成容器中,加入DMF(10 mL)并用氮气鼓吹15 min,再用20% 哌啶/DMF(10 ml)脱除Fmoc保护基20 min,用DMF和甲醇交替洗涤(2×10 mL)。茚三酮溶液检测是否存在游离的氨基。称量Fmoc-AA-OH(4倍于树脂)、HOBt、HBTU,用10 mL DMF溶解,并加入450 μL DIPEA活化3 min。将该溶液加入肽合成容器中氮气鼓吹4 h。茚三酮溶液检测是否偶联成功,配制含有下一个Fmoc-AA-OH氨基酸的偶联溶液。重复循环偶联和脱保护步骤,直到偶联20个氨基酸残基。以三氟乙酸∶硫代乙醇∶硫代异唑∶水∶苯酚=82.5∶5∶5∶5∶2.5比例配制切割试剂,磁力搅拌使肽链从树脂上切割下来。砂芯漏斗过滤至100 mL冰乙醚溶液中使样品析出。以5 000 r·min-1速度离心5 min,弃上清液,重复离心3次,自然晾干得到白色粗品肽。
1.4 目标多肽的分离纯化和质谱表征
1.4.1 目标多肽的分离纯化
用超纯水和乙腈以一定比例溶解粗肽并过滤,使用半制备高效液相色谱(RP-HPLC)等度洗脱分离纯化粗品肽。等度洗脱条件:紫外检测波长为220 nm;色谱柱为 Agilent Zorbax 300 SB-C 18 (9.4 mm×250 mm,5 μm );柱温25 ℃;流速1.0 mL/min;进样量100 μL;流动相:(A)含0.1%三氟乙酸的水、(B)含0.1%三氟乙酸的乙腈;40% B等度洗脱25 min。收集出峰时溶液,冷冻干燥得到纯品肽。
1.4.2 目标多肽的质谱表征
用超纯水和乙腈以一定比例配制2 g/L粗肽溶液,有机系滤膜过滤,150~2 000 (m/z) 范围内使用电喷雾质谱(ESI-MS)检测。检测条件:检测模式为正离子;鞘气流速:20 psi;扫气流速:5 psi;喷雾电压:4.5 kV;套管透镜电压:110 V;毛细管电压:35 V;毛细管温度:275 ℃。
1.5 BRCA1846-871及其五突变肽与RAD51181-200的相互作用研究
1.5.1 荧光光谱法
配制100 mL 0.1 mmol·L-1RAD51181-200溶液,含有不同浓度BRCA1846-871及其五突变肽的测试样品溶液各10 mL,浓度分别为0,3,6,9,12,15 μmol·L-1,静置15 min充分反应。激发波长为275 nm,发射波长范围为280~400 nm,狭缝宽度均为10 nm,采用10 mm光程的石英比色皿。将受体RAD51181-200溶液换作50 mmol·L-1Tris-HCl缓冲溶液(pH=7.4),配制不同浓度配体溶液作为空白对照,其余参数设置不变,重复3次。
1.5.2 圆二色光谱法
配制100 mL 0.1 mmol·L-1RAD51181-200溶液,含有不同浓度BRCA1846-871及其五突变肽的测试溶液各10 mL,浓度分别为0、0.1 mmol·L-1,静置15 min充分反应。狭缝宽度0.5 nm,步长1 nm,光程10 mm,扫描速度60 nm·min-1,波长扫描范围为200~260 nm。同时配制含相同浓度配体的溶液10 mL,用Tris-HCl缓冲溶液溶解,作为空白对照减少配体自身二级结构的影响,所有设置参数不变,重复3次。
2 结果与分析
2.1 BRCA1846-871五突变肽的设计和筛选
本文通过计算机技术对BRCA1846-871片段中的五个活性位点(Y856、K862、R866、Q867、P871)进行突变,根据理论计算结果参数ΔGbind(binding Gibbs free energy)进行排序,筛选出与RAD51181-200相互作用较好的五突变肽,ΔGbind越小,配体与受体的亲和力越强[14]。如表1所示,筛选9条BRCA1846-871五突变肽,肽序中加粗的字母代表发生突变的活性位点。对比发现,P2和P9两条突变肽只有第866位氨基酸不同,该活性位点的氨基酸改变有可能对二者与RAD51181-200的结合自由能和相互作用产生影响。同时,通过计算目标多肽的Pc值和平均亲水性综合判断多肽的水溶性。Pc值代表形成无序卷曲的贡献值,平均亲水性根据多肽序列中残基的亲/疏水值得到。Pc值在1~0.9之间表示肽在DMF、DMSO等极性溶剂中部分溶解,平均亲水性在0~1之间说明多肽水溶性一般,需要添加助溶剂或超声。
2.2 目标多肽的RP-HPLC 纯化、分析和质谱表征
使用Fmoc固相合成法合成11条目标多肽,将其溶解成浓度为10 g/L的样品溶液,有机系滤膜过滤,RP-HPLC纯化和分析,ESI-MS表征[15]。所有目标多肽经过RP-HPLC纯化,纯度均超过93%。
所有的多肽样品的实测质荷比(m/z)均与理论值保持一致。质荷比1 111.42为RAD51181-200(理论相对分子质量为 2 220.02 g·mol-1) [M+2H]2+对应的多电荷离子峰;质荷比1 559.83和1 039.92为BRCA1846-871(理论相对分子质量为 3 115.49 g·mol-1) [M+2H]2+和[M+3H]3+对应的多电荷离子峰;质荷比1 577.58和1 052.00为P1 (理论相对分子质量为 3 152.45 g·mol-1) [M+2H]2+和[M+3H]3+对应的多电荷离子峰;质荷比1 576.25和1 051.67为P2 (理论相对分子质量为 3 149.49 g·mol-1) [M+2H]2+和[M+3H]3+对应的多电荷离子峰;质荷比1 606.17为P3 (理论相对分子质量为 3 209.48 g·mol-1) [M+2H]2+对应的多电荷离子峰;质荷比1 601.92和1 068.58为P4 (理论相对分子质量为 3 200.51 g·mol-1) [M+2H]2+和[M+3H]3+对应的多电荷离子峰;质荷比1 598.92和1 066.33为P5 (理论相对分子质量为 3 193.55 g·mol-1) [M+2H]2+和[M+3H]3+对应的多电荷离子峰;质荷比1 552.42和1 035.50为P6 (理论相对分子质量为 3 101.51 g·mol-1) [M+2H]2+和[M+3H]3+对应的多电荷离子峰;质荷比1 581.42和1 055.00为P7 (理论相对分子质量为 3 159.50 g·mol-1) [M+2H]2+和[M+3H]3+对应的多电荷离子峰;质荷比1 590.92和1 061.25为P8 (理论相对分子质量为 3 178.54 g·mol-1) [M+2H]2+和[M+3H]3+对应的多电荷离子峰;质荷比1 601.00和1 067.75为P9 (理论相对分子质量为 3 198.51 g·mol-1) [M+2H]2+和[M+3H]3+对应的多电荷离子峰。
2.3 BRCA1846-871及其五突变肽与RAD51181-200相互作用的荧光光谱分析
荧光光谱技术广泛应用于配体与主体相互作用的研究中,具有超高的灵敏度,能够直观展现荧光强度的变化,通过计算可提供许多重要参数,例如,猝灭常数、结合常数和结合位点数等[16-17]。配体多肽与受体多肽相互作用,会使受体多肽的荧光增强或猝灭。荧光增强可能是由配体荧光与受体荧光的叠加导致,说明没有发生相互作用。荧光猝灭分为静态猝灭和动态猝灭。
由图1可知,P6对RAD51181-200没有猝灭作用,其余配体随着浓度的增加,303 nm处受体RAD51181-200荧光强度逐渐降低,且配体浓度越大,受体RAD51181-200荧光强度下降越明显。这说明除P6以外的其他配体均与受体相互作用且发生猝灭。另外,P1、P2、P3和P9这四条五突变多肽在350 nm处有强荧光,所以这四条配体加入到受体中后就会存在强干扰荧光,需要扣除配体本身的荧光。猝灭类型可进一步确定。
假设猝灭剂BRCA1846-871及其突变肽与荧光分子RAD51181-200属于动态猝灭,利用Stern-Volmer方程(1)计算双分子猝灭速率常数Kq[18]。
F0/F=1+Ksv[Q]=1+Kqτ0[Q]
(1)
式中,F0和F分别为受体RAD51181-200未加入和加入配体BRCA1846-871及其五突变肽时的荧光强度;Ksv为动态猝灭常数,L·mol-1;Q为配体的浓度,mol·L-1;Kq为猝灭速率常数, L·mol-1·s-1;τ0为猝灭剂不存在时荧光基团的平均寿命,10-8s。以最大吸收波长303 nm处F0/F为纵坐标,Q为横坐标进行线性拟合,如图2所示,斜率即为动态猝灭常数Ksv和Kqτ0,如果Kq值大于最大碰撞猝灭速率常数2×1010L·mol-1·s-1,则说明假设不成立,即属于静态猝灭[19]。
根据荧光数据拟合BRCA1片段配体与RAD51181-200片段受体相互作用的Stern-Volmer 曲线图,如图2所示。通过图2每条拟合线的斜率计算得出Ksv和Kq的值,结果如表2所示,除配体P6以外。9条配体多肽对受体RAD51181-200的猝灭速率常数Kq值都大于2×1010L·mol-1·s-1,说明发生静态猝灭。对于静态猝灭,BRCA1片段配体与RAD51181-200受体间的结合常数K值和结合位点数n通过Lineweaver-Burk方程-双对数方程(2)得出。
lg[(F0-F)/F]=logK+nlg[Q]
(2)
式中,K为配体与受体间的结合常数,L·mol-1;n为每摩尔受体RAD51181-200的结合位点数。以lg[(F0-F)/F]为纵坐标,lg[Q]为横坐标作双对数图,结果如表2所示。由表可知,不同配体与受体RAD51181-200的结合强度存在差异,三条五突变肽即P1 (4.17×104L·mol-1)、P4 (7.61×104L·mol-1)和P5 (1.19×104L·mol-1)与受体RAD51181-200片段的结合常数在104~106L·mol-1范围内,剩余六条五突变配体即BRCA1846-871(1.67×103L·mol-1)、P2 (4.56×101L·mol-1)、P3 (4.76×103L·mol-1)、P7 (3.38×103L·mol-1)、P8 (3.97×103L·mol-1)和P9 (5.19×103L·mol-1)的结合常数均不在104~106L·mol-1范围内。通过对比P2和P9肽序发现,二者只有第866位氨基酸不同,结合常数却有非常大的差别,这说明第866位氨基酸的改变有可能影响整条肽链的结构,从而影响与RAD51181-200片段受体的相互作用。由结合位点n可知,所有的配体BRCA1片段与受体RAD51181-200片段都有1个结合位点。

图1 BRCA1846-871突变肽存在或不存在时RAD51181-200的荧光光谱图Fig.1 Fluorescence spectra of RAD51181-200 in the absence or presence of BRCA1846-871 mutants

图2 RAD51181-200与BRCA1846-871及其五突变肽发生荧光猝灭的Stern-Volmer 曲线Fig.2 Stern-Volmer plots for fuorescence quenching of RAD51181-200 by BRCA1846-871 or mutants
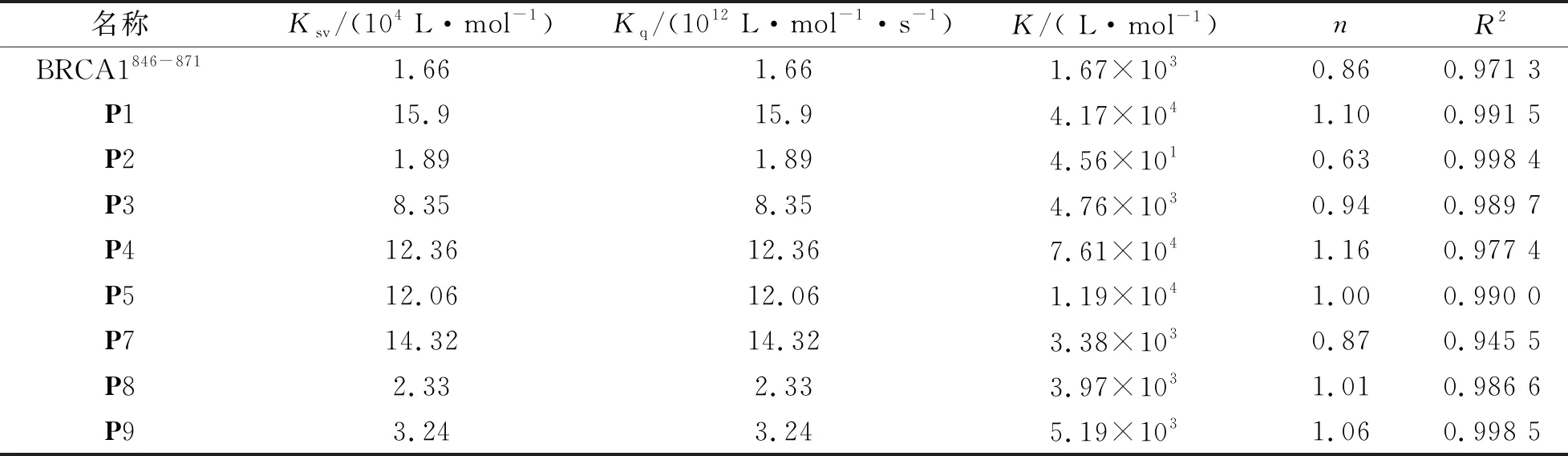
表2 Stern-Volmer动态猝灭常数Ksv,猝灭速率常数Kq,结合常数K及结合位点数n
2.4 BRCA1846-871及其五突变肽与RAD51181-200相互作用的圆二色光谱分析
圆二色光谱是一种特殊的吸收谱,具有灵敏度高、样品需求量低、测试样品相对分子质量范围宽、速度快等优点,主要用于研究多肽、蛋白质、多糖和DNA的二级结构变化[20]。本文通过测定固定浓度的BRCA1片段配体加入后,受体RAD51椭圆度的变化,来研究配体对受体RAD51二级结构的影响。多肽的二级结构多肽的α-螺旋结构的圆二色谱特征是在208 nm和222 nm处有两个负的特征峰,形状为“W”型[18]。β-折叠在195 nm为正峰,在215 nm为负峰。
如图3所示,在220 nm附近存在一个明显的负特征峰,这应该是由RAD51181-200受体同时含有α-螺旋结构和β-折叠或β-转角结构造成的。加入配体BRCA1846-871及其五突变肽后,受体RAD51181-200负吸收峰的峰形和位置发生改变。由图3可知,P2和P8三条五突变肽对RAD51181-200受体的椭圆度几乎没有影响;P1、P3、P5、P6、P7和P9六条五突变肽的加入,使RAD51181-200受体的椭圆度略微的上升;P4对RAD51181-200受体影响最大,不仅使RAD51181-200受体的椭圆度上升,而且使其特征峰发生了红移,这可能是因为P4的加入改变了RAD51181-200受体周围的亲疏水微环境。我们使用CD Pro程序计算RAD51181-200受体的α-螺旋结构含量变化,结果如表3所示。P1、P4和P5三条五突变肽使RAD51181-200受体的α-螺旋结构含量下降最明显,从60.5%分别下降到35.7%、36.3%和36.4%。RAD51181-200受体的α-螺旋结构含量下降说明配体通过非共价作用力与受体产生相互作用。α-螺旋结构含量变化可能是由RAD51181-200受体的氢键网络发生变化造成的,这说明RAD51181-200受体的二级结构发生了改变。结构决定性质,所以RAD51181-200受体的修复功能也可能会受到影响。BRCA1846-871突变成P1后理化性质全部改变(未列出),所以对RAD51181-200受体二级结构影响影响也比较大。其次是BRCA1846-871、P3、P6、和P9四条五突变肽对RAD51181-200受体的α-螺旋结构含量有较大有影响,从60.5%分别下降到56.3%、55.6%、55.6%和54.6%。比较而言,P2、P7和P8三条五突变肽加入后,RAD51181-200受体的α-螺旋结构含量变化不太明显,从60.5%分别下降到58.1%、58.1%和58.3%。

图3 BRCA1846-871及其五突变肽加入前后RAD51181-200的圆二色光谱图Fig.3 Circular dichroism spectra of RAD51181-200 in the presence of the fixed concentration of BRCA1846-871 mutants

表3 BRCA1846-871及其五突变肽配体加入前后 RAD51181-200受体的α-螺旋结构含量
3 结论
采用计算机辅助设计、筛选出理论上与RAD51相互作用较强的9条BRCA1846-871五突变肽,通过固相合成法制备目标多肽,反相高效液相色谱分离、纯化得到纯度大于93%的目标多肽,ESI-MS表征表明各目标多条的相对分子质量正确。利用圆二色光谱法和荧光光谱法研究BRCA1846-871及其9条五突变肽与RAD51181-200的相互作用。圆二色光谱结果显示,P1、P4和P5对RAD51181-200受体的二级结构影响较大。荧光光谱结果显示,P1、P4和P5在室温下与受体RAD51181-200的相互作用较强。综合光谱分析结果可知,五突变肽P4与RAD51181-200相互作用最强。
