PKD2在骨髓间充质干细胞成脂分化过程中的表达变化及作用
2021-05-27单丽英吴晓文师晓丽朱恩东袁海瑞王宝利
单丽英,吴晓文,师晓丽,朱恩东,袁海瑞,王宝利
1天津医科大学朱宪彝纪念医院天津市内分泌研究所 国家卫健委激素与发育重点实验室,天津300134;2天津医科大学基础医学院
骨髓间充质干细胞(BMSCs)在特定条件诱导下可以向脂肪细胞、成骨细胞、软骨细胞、神经细胞、成肌细胞等细胞分化[1]。BMSCs向脂肪细胞和成骨细胞分化的过程中存在一种平衡关系,当此平衡被打破时,将导致相关疾病的发生[2-4]。例如,当成脂分化占优势时会削弱BMSCs向成骨细胞分化的能力,从而引起骨质疏松、与年龄相关的骨丢失等疾病[5-7]。因此,阐明成脂分化和成骨分化之间的平衡关系对骨质疏松等代谢性疾病的治疗有着重要意义。多囊肾致病基因2(PKD2)突变会导致常染色体显性遗传性多囊肾病(ADPKD)的发生。MESNER等[8]发现PKD2可以促进BMSCs向成骨细胞分化,但研究未涉及PKD2调控BMSCs向脂肪细胞分化的作用。2019年6月—2020年6月,本研究以骨髓间充质干细胞系ST2作为实验对象,探讨PKD2对BMSCs成脂分化的作用及可能的调控机制,旨在为骨代谢相关代谢性疾病的治疗提供新的思路。
1 材料与方法
1.1 细胞与主要实验材料 ST2细胞为本实验室保存。无内毒素质粒小提试剂盒购自CWBIO公司;限制性内切酶(NheⅠ、EcoRⅠ)、Opti-MEM、逆转录试剂盒购自Thermo Fisher公司;ClonExpress®Ⅱ重组克隆试剂盒购自Vazyme Biotech公司;引物合成、测序由Sangon Biotech公司完成。α-MEM培养基、胎牛血清(FBS)购自Hyclone公司;转染试剂Attrac⁃tene Transfection Reagent购自QIAGEN公司;总RNA提取试剂盒购自GeneMark公司;胰岛素、地塞米松、3-异丁基-1-甲基黄嘌呤购自Sigma公司;吲哚美辛购自Cyagen公司;油红O染液购自Sigma公司。倒置显微镜购自Olympus公司。
1.2 ST2细胞成脂分化过程中PKD2表达观察 当ST2细胞汇合度达100%时,进行成脂诱导。使用含有α-MEM培养基(含1%双抗、5%胎牛血清)、0.5µmol/L地塞米松、0.25 mmol/L IBMX、5 mg/L胰岛素、50µmol/L吲哚美辛的成脂诱导培养基诱导72 h,之后更换只含5 mg/L胰岛素的α-MEM完全培养基继续诱导。采用qRT-PCR法分别检测成脂分化诱导0、1、2、3、4、5 d时细胞中的PKD2基因。
1.3 PKD2基因过表达质粒的构建 根据NCBI Ge n e b a n k数据库中PKD2基因序列设计PCR扩增引物。PKD2上游引物序列为5'-CTATAGGGAGACCCAAGCTGGCTAGCGCCACCAT⁃GGTTAACTCCAGACGCGT-3',下游引物序列为5'-CACTGTGCTGGATATCTGCAGAATTCTTAG⁃GCATGGACGTTGGCAC-3'。以C57BL/6小鼠肝脏cDNA为模板,按照95℃预变性2 min,95℃变性30 s、56℃退火30 s、72℃延伸150 s共30个循环,72℃延伸10 min进行PCR扩增。将扩增产物和经过NheⅠ/EcoRⅠ双酶切的pcDNA3.1用试剂盒纯化回收,然后将二者通过ClonExpress®Ⅱ重组克隆试剂盒进行重组反应(37℃、30 min),将重组产物转化到DH5α感受态细胞中,用LB培养基培养1 h,之后涂板于LB固体培养基(含有100µg/mL氨苄青霉素)上,37℃培养16 h,次日挑取单菌落,摇菌过夜后提取质粒,用NheⅠ/EcoRⅠ双酶切鉴定,进行一代测序,鉴定正确的菌种即PKD2基因过表达质粒。
1.4 ST2细胞的培养及分组处理 转染前1 d,将ST2细胞接种于24孔细胞培养板,待细胞汇合度达60%~80%时进行转染。将ST2细胞分为对照组和实验组,分别取pcDNA3.1与PKD2过表达质粒稀释于Opti-MEM,静置5 min后加入适量转染试剂Attractene,静置15~20 min。24孔板中每孔滴加转染混合物50µL,于37℃、5%CO2细胞培养箱中培养。转染16~18 h后更换新的α-MEM完全培养基。
1.5 ST2细胞的成脂分化诱导及鉴定 两组细胞汇合度达100%时,进行成脂诱导。待脂滴成熟后,采用油红O染色进行鉴定:用4%多聚甲醛室温固定细胞15 min;1×PBS洗涤1次;加入适量60%异丙醇,1 min后弃去;最后加入适量油红O染液,室温静置5 min后用蒸馏水冲洗干净;倒置显微镜下观察细胞分化情况并拍照;每孔加100%异丙醇200µL萃取油红O,采用多功能酶标仪测定OD520,表示油红O的着色程度,定量分析各组间脂滴差异。
1.6 成脂分化相关基因及蛋白检测 采用qRTPCR法检测成脂分化相关基因[过氧化物酶体增殖物激活受体(PPARγ)、CCAAT增强子结合蛋白α(C/EBPα)、脂 肪 酸 结 合 蛋 白4(FABP4)、adip⁃sin mRNA]。成脂诱导48 h后收集细胞提取总RNA,用Thermo逆转录试剂盒逆转成cDNA,然后进行qRT-PCR反应。反应体系:模板cDNA 2µL,上、下游引物(10µmol/L)各0.5µL,2×SYBR Green PCR Master Mix 5µL,去离子水补充至10µL。反应条件:95℃预变性3 min,95℃5 s、56℃15 s、72℃15 s共35个循环。以β-actin为内参,以2-ΔΔCt表示目的基因相对表达量。采用Western blotting法检测成脂分化相关蛋白(PPARγ、C/EBPα、FABP4)。两组细胞成脂诱导72 h后用RIPA裂解液裂解,在4℃条件下,12 000 r/min离心10 min,取上清液置于新的离心管中,即为总蛋白。配制10%SDS-PAGE凝胶,将获得的总蛋白加到凝胶的孔里进行蛋白电泳,恒压60 V至蛋白进入分离胶,将电压调至120 V至电泳结束。250 mA恒流将蛋白转印至NC膜,用5%脱脂牛奶室温封闭2 h,4℃下加一抗过夜,次日加二抗后曝光,用Image J软件进行灰度值分析,并计算相关蛋白与β-actin的灰度比值作为目的蛋白的相对表达量。
1.7 Wnt信号通路相关蛋白检测 将ST细胞分为对照组和实验组,分别转染pcDNA3.1与PKD2过表达质粒,不进行成脂诱导处理,转染后72 h采用Westeren blotting法检测Wnt信号通路相关蛋白(t-Lrp6、p-Lrp6、t-GSK3β、p-GSK3β、t-β-catenin、活化β-catenin、TCF7L2)。
1.8 统计学方法 采用SPSS17.0统计软件。计量资料以±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 ST2细胞成脂分化过程中PKD2基因表达 成脂分化诱导后0、1、2、3、4、5 d的ST2细胞中PKD2基因相对表达量分别为1.00±0.19、3.04±0.16、3.02±0.10、2.70±0.88、4.57±1.03、4.45±0.90,成脂分化诱导1 d以后PKD2基因相对表达量均显著高于0 d时,以诱导4 d时PKD2基因相对表达量最高(P均<0.05)。
2.2 PKD2对ST2细胞成脂分化的影响 实验组形成的脂滴数目显著减少。实验组、对照组油红定量分别为0.18±0.01、0.42±0.05,实验组低于对照组(P<0.05)。
2.3 PKD2对ST2细胞成脂分化相关基因和蛋白表达的影响 实验组细胞中PPARγ、C/EBPα、FABP4、adipsin mRNA表达低于对照组;PPARγ、C/EBPα、FABP4蛋白表达低于对照组(P均<0.05)。见表1。
表1 实验组和对照组细胞中PPARγ、C/EBPα、FABP4、adipsin mRNA及蛋白表达比较(±s)
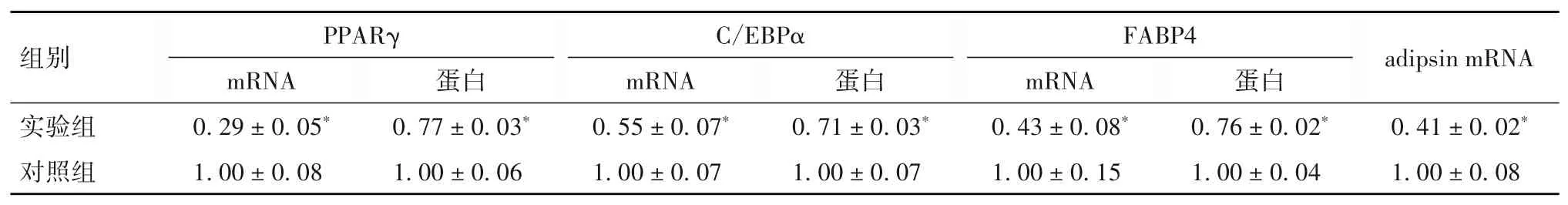
表1 实验组和对照组细胞中PPARγ、C/EBPα、FABP4、adipsin mRNA及蛋白表达比较(±s)
注:与对照组相比,*P<0.05。
?
2.4 PKD2对Wnt信号通路相关蛋白表达的影响实验组细胞中p-Lrp6、p-GSK3β、活化β-catenin、TCF7L2蛋白表达均高于对照组(P均<0.05)。见表2。
表2 实验组与对照组Wnt信号通路相关蛋白表达比较(±s)

表2 实验组与对照组Wnt信号通路相关蛋白表达比较(±s)
注:与对照组相比,*P<0.05。
?
3 讨论
在生理条件下,BMSCs具有向骨、软骨和脂肪等组织分化的潜能,这对于维持骨髓内骨组织及脂肪组织数量的平衡具有重要意义。BMSCs向脂肪细胞或成骨细胞的分化存在一种动态平衡。在衰老过程中,BMSCs向脂肪细胞分化具有偏向性,随着脂肪组织的积累,骨髓中骨的形成减少。而BMSCs向脂肪细胞的分化是一个复杂、高效的调控过程,需要多个信号通路、多种转录因子的参与。研究发现,在基质干细胞脂肪分化过程中,PPARγ和C/EBPα表达较高[9],是脂肪生成的重要早期调节因子,二者协同作用可以激活下游FABP4等脂肪生成基因的转录,从而诱导形成成熟脂肪细胞[10-11]。
PKD2位于人染色体4q21-23,由15个外显子组成,编码一个由968个氨基酸构成的6次跨膜蛋白[12]。有研究证实PKD2基因突变后蛋白的表达缺失会导致ADPKD的发生,主要表现为双侧肾脏形成多个大小不等的圆球形液性囊肿[13],造成肾脏功能不可逆性损伤,最终导致肾衰竭[14-16]。PKD2在成人和胎儿的大多数组织中表达[17],其在心血管系统中的表达水平较高,在血管壁平滑肌细胞和内膜细胞中含量也比较丰富,有助于心血管功能的维持和稳定[18]。有研究发现,PKD2作为双尾基因1的下游基因,可促进BMSCs向成骨细胞分化、增加骨密度[8]。本研究发现,ST2细胞成脂分化过程中PKD2的表达增高,表明PKD2可能在BMSCs向脂肪细胞分化过程中发挥调控作用。然后我们构建了PKD2过表达质粒,在ST2细胞中进行转染。经成脂诱导后,与转染pcDNA3.1质粒的对照组相比,实验组脂滴的数目显著减少,与成脂分化有关的调控因子PPARγ、C/EBPα、FABP4、adipsin mRNA和蛋白表达水平均显著降低,同时发现Wnt/β-catenin信号通路相关蛋白表达水平增加。
Wnt/β-catenin信号通路参与调控多种生命发育过程,包括细胞增殖、分化、凋亡、迁移以及成人干细胞的维持[19-20]。当激活信号传来,Wnt与Frizzled结合成复合物,GSK-3β磷酸化,使得β-catenin不能被降解,从而能够进入胞核与核内转录因子TCF/LEF形成TCF/LEF/β-catenin复合体,特异性激活下游靶基因,发挥调控作用。当前多数学者认为Wnt/β-catenin信号通路在调控脂代谢、骨发育及骨代谢的生理过程中发挥重要作用[21]。Wnt/β-catenin信号通路可以抑制成脂分化[22],促进成骨分化。有研究表明,通过Wnt3a激活的经典Wnt通路可以抑制成脂分化过程中主要转录因子PPARγ和FABP的表达,Wnt10b能抑制PPARγ和C/EBPα的表达,从而抑制成脂分化[19]。因此,结合本研究的发现,我们认为,PKD2可能通过激活Wnt/β-catenin信号通路从而抑制BMSCs向脂肪细胞的定向分化。但关于PKD2调节Wnt/β-catenin信号通路的具体途径仍需要明确。
经典的Wnt/β-catenin信号通路参与了ADPKD的形成[13]。早期研究显示,在体外,PKD1和PKD2的结构域相互关联[23]。小鼠胚胎成纤维细胞分泌的Wnt可作为PKD1/PKD2复合物活化的配体,破坏复合物的形成;减少PKD1的表达或降低PKD2的活性,会抑制Wnt的激活[24-25]。但也有研究表明,在小鼠肾上皮细胞中特异性敲除PKD2后,通过增加自分泌Wnt(例如Wnt7a)的产生激活了Wnt/β-catenin信号转导,导致Wnt信号通路的相关靶基因表达上调[26]。因此,我们推测在不同细胞和组织中PKD2对Wnt信号通路的异常激活有不同的影响,但仍需要进一步验证。
综上所述,BMSCs成脂分化过程中PKD2表达增高;PKD2过表达可抑制BMSCs向脂肪细胞分化,并伴随Wnt通路相关蛋白表达上调。但细胞在不同环境下,PKD2如何调控Wnt/β-catenin信号通路还有待进一步研究。
