缺氧对自然调节性T 细胞的影响
2021-05-27许桐彤徐振健陈丽玲陈秋菊徐安平
许桐彤 徐振健 陈丽玲 陈秋菊 徐安平
调节性T 细胞(regulatory T cells,Tregs)是一类具有负向免疫调节功能的T 细胞亚群,因Tregs能调节机体免疫反应而被应用在众多疾病的研究中,如自身免疫性疾病、炎症性疾病和肿瘤等。根据来源,Tregs 可分为自然调节性T 细胞(natural regulatory T cells,nTregs)和诱导调节性T 细胞(in⁃duced regulatory T cells,iTregs)。nTregs 主要来源于胸腺,iTregs 是由外周幼稚T 细胞在抗原的刺激下转化而来,二者均通过关键转录因子FoxP3 来调节机体免疫反应。在正常的情况下,nTregs 与辅助性T 细胞(helper T cells,Th)协同维持机体正常的免疫反应。然而,在免疫炎症反应情况下,这种平衡可能会被打破,出现Th 数量增多和功能增强,进而可导致nTregs 的功能不稳定[1,2]。另外,多项研究表明在免疫炎症状态下,nTregs 可能表达与辅助性T 细胞(Th17)分化相关的转录因子RORγt(retinoic acid⁃related orphan receptor⁃γt)[3,4],即RORγt+nTregs。RORγt+ nTregs 被认为是处于向促炎型Th17 分化的过渡阶段。这提示我们nTregs 在免疫炎症状态下的功能可能不稳定,甚至可能具有促炎作用。
许多疾病都存在缺氧的病理生理过程。病理性缺氧是引起免疫炎症反应的常见原因[5]。说明缺氧与免疫反应密切相关。在本研究中,我们通过体外缺氧来模拟组织缺氧环境,进而研究缺氧对nTregs 中转录因子的表达情况以及对nTregs 功能的影响。
1 材料与方法
1.1 主要材料 实验所用C57BL/6 小鼠购于广东省实验动物中心;分选nTregs 所用试剂购于德国MiltenyiBiotec;流 式 抗 体FITC anti⁃mouse CD3e、perCP⁃cy5.5 anti⁃mouse CD4、PE anti⁃mouse CD25、BV421 anti⁃mouse FoxP3 以及流式细胞仪均购买自美 国BD 公 司;westernblot 所 用STAT3 抗 体、p⁃STAT3 抗体、RORγt 抗体购自英国Abcam 公司,GAPDH 抗体购自美国Cell Signaling Technology 公司;CFSE 试剂购于美国Biolengend 公司;缺氧模型所需培养箱购自德国Eppendorf 公司;常氧培养箱购于美国Thermo Fisher Scientific 公司。
1.2 实验方法 (1)分选nTregs:取C57BL/6 小鼠的脾脏于细胞筛网中研磨后移至离心管,离心,弃上清,裂红。根据MiltenyiBiotec 的试剂(130⁃091⁃041)说明孵育CD4+CD25+ Regulatory T cell Biotin⁃Antibody Cocktail、Anti⁃BiotinMicroBeads 和CD25⁃PE antibody 后过LS 分选柱得到细胞悬液;在上述悬液中加适量Anti⁃PE MicroBeads 孵育,按说明过MS 分选柱即得到nTregs;(2)建立体外缺氧条件:将得到的nTregs 种于96 孔板中,加入IL⁃2、TGF⁃β和anti⁃mouseCD3 抗体和anti⁃mouse CD28 抗体混匀后置于1%氧浓度的培养箱中进行缺氧处理,同时设立常氧环境细胞培养组作为对照(5%二氧化碳,95%空气);(3)流式细胞术检测细胞:收集细胞于流式管中,加1 mL PBS 离心洗1 次,去掉上清,200 μL PBS 重悬,加细胞表面抗体4℃避光孵育15 分钟,2 mL PBS 离心洗一次,使用transcrip⁃tion factor buffer set 固定后加胞内转录因子抗体4℃避光孵育30 分钟后破膜,加200 μL PBS 重悬上机检测;(4)蛋白质免疫印迹(western blot):提取细胞总蛋白后,将20 μg 的蛋白样品加到SDS⁃PAGE 胶中进行电泳,完成后电转到PVDF 膜上。用5% BSA 室温封闭1 h,随后加入相关一抗在4℃孵育过夜。一抗浓度依据抗体说明书使用;GAPDH 的一抗浓度为1∶5000。室温孵育二抗1 h后,用G:BOX 智能显像系统(英国Syngene 公司)采集条带图片,应用ImageJ 对条带进行半定量分析;(5)Th 细胞增殖:小鼠脾脏研磨后置于尼龙毛柱中37℃孵育30 分钟后除去柱中液体,将尼龙毛浸于PBS 中反复吹打,将悬液移至离心管后离心,弃上清,加丝裂霉素溶液孵育后得到APC 细胞,与上述柱中液体中得到的Th⁃CFSE 共培养3 天后流式细胞仪测Th 增殖。
1.3 统计方法 采用SPSS 20.0 和GraphPad Prism 8 对实验数据进行处理。采用流式分析软件Flow⁃Jo VX 对流式数据进行分析。所有结果以(±s)表示,采用Student's t⁃test 进行两组间数据的比较,采用multiplet⁃test 进行多组间数据的比较,以P<0.05认为差异具有统计学意义。
2 结 果
2.1 缺氧影响FoxP3 在nTregs 中的表达 当体外缺氧处理15 分钟后,nTregs 中的关键转录因子FoxP3 在胞内的表达开始下降。我们通过流式细胞术选定CD3+CD4+的T 细胞亚群(图1A),分析该细胞亚群中CD25 和FoxP3 的表达情况。图1B和图1C 中,基线组(baseline)为新鲜提取的nTregs,0 分钟(0 min)指在常氧条件下培养1 天。与基线组和常氧组(0 min)相比,体外缺氧15 分钟后,FoxP3 在nTregs 中的比例出现明显下降(P<0.05);同时我们发现,在体外缺氧6 小时和12 小时后,FoxP3 的表达仍然呈现下降趋势(P<0.01)。以上结果提示体外缺氧能够持续抑制nTregs 中FoxP3 的 表 达。
2.2 缺 氧 诱 导nTregs 向RORγt+nTregs 转 化因nTregs 中FoxP3 的表达在体外缺氧15 分钟出现明显下降,我们应用蛋白质免疫印迹法(west⁃ern blot)检测了体外缺氧15 分钟后nTregs 中的转录因子RORγt,STAT3 以及磷酸化的STAT3(p⁃STAT3)的表达情况。图2 中,当nTregs 体外缺氧15 分钟后,与常氧组相比,缺氧后转录因子RORγt 的表达增多(P<0.05),同时p⁃STAT3 比例增多(P<0.01),但STAT3 表达无变化,与上述FoxP3 的变化相对应。说明体外缺氧可以诱导nTregs 转化为RORγt+ nTregs,且p⁃STAT3 可能参与其中。

图1 缺氧影响Foxp3 在nTregs 中的表达
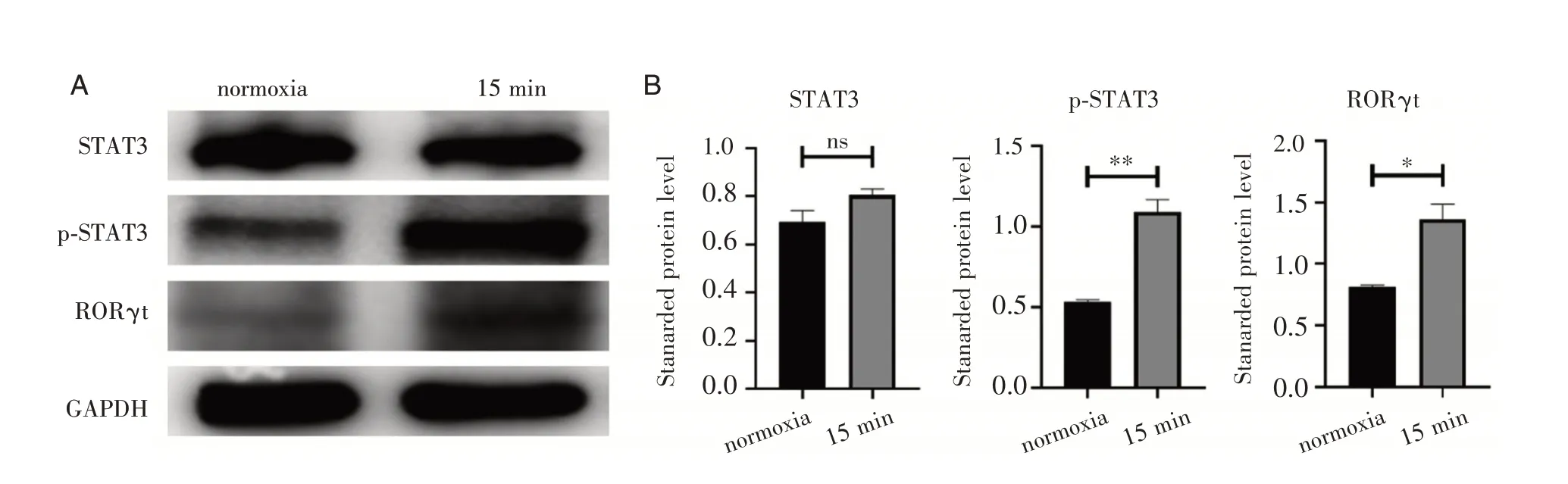
图2 缺氧后nTregs 可能向Th17 细胞转化
2.3 缺氧影响nTregs 对Th 细胞的抑制作用 我们通过流式分析发现,在常氧的情况下,Th 细胞在体外增殖能力活跃,nTregs 通过抑制Th 细胞的增殖发挥免疫调节功能(图3A,P<0.0001)。当对nTregs 进行15 分钟的体外缺氧处理后,与未缺氧nTregs 相比(baseline),nTregs 对Th 细胞的抑制作用明显减弱(图3B,P<0.0001)。说明体外缺氧能够影响nTregs 的免疫抑制功能。

图3 缺氧影响nTregs 对Th 细胞的抑制作用
3 讨 论
在免疫炎症状态下,nTregs 通过FoxP3 的调控能直接或间接抑制靶细胞[6]。然而,nTregs 对一些免疫炎症性疾病的抑制作用并不理想[7]。研究表明在炎症性肠病小鼠的肠道中发现具有促炎作用的RORγt+nTregs[3],提示nTregs 在免疫炎症状态下不稳定。
病理性缺氧本质上是诱发免疫炎症反应的病理生理过程。组织缺氧时,T 细胞、B 细胞和巨噬细胞募集到受损的部位,通过释放IL⁃1、IL⁃6 和TNF 等细胞因子促进炎症级联反应。此外,被激活的缺氧诱导因子HIF 通过促进FoxP3 的降解、STAT3 和RORγT 的激活来调节Th17 和Tregs 之间的平衡[8]。
本研究发现nTregs 在缺氧的环境中不能维持原有的免疫抑制功能,其机制可能与缺氧导致nTregs 中的转录因子FoxP3 失活和STAT3 激活有关。我们还发现体外缺氧诱导nTregs 表达RORγt使nTregs 向Th17 方向转化,为缺氧导致的免疫炎症性疾病提供实验依据。
