大蒜粉蒜酶活力的测定方法研究
2021-05-26胡小霞肖文浚宋百灵李兰兰史荣梅
胡小霞,肖文浚,宋百灵,,李兰兰,王 艳,史荣梅*
(1.新疆埃乐欣药业有限公司,新疆 乌鲁木齐 830013; 2.新疆医科大学药学院,新疆 乌鲁木齐 830011)
大蒜(AlliumsativumL.)作为一种古老的药食两用植物,具有解毒消肿、杀虫、止痢等功效,常用于治疗痈肿疮疡、疥癣、肺痨、顿咳、泄泻、痢疾等[1]。大蒜辣素是目前公认的大蒜最重要的活性成分[2-5],然而完整大蒜本身并不含大蒜辣素,只有当其被切割或破碎时,分处细胞不同部位的蒜氨酸与蒜酶相遇,蒜酶迅速催化裂合蒜氨酸从而产生大蒜辣素。
大蒜粉是新鲜大蒜鳞茎经切制、冻干或低于65 ℃干燥、粉碎后制得,其不仅可以保留大蒜除水分以外的原始成分,包括蒜氨酸和具有活力的蒜酶,还较新鲜大蒜更易于运输、储存和质量控制。大蒜粉已被英国药典[6]、美国药典[7]和欧洲药典[8]收载,其中英国药典和欧洲药典将潜在大蒜辣素含量作为大蒜粉的质控指标,该指标同时显示了蒜氨酸含量及蒜酶活力。大蒜辣素的前体物质是蒜氨酸,蒜氨酸转化为大蒜辣素的转化率与蒜酶活力密切相关。蒜酶是一种二聚体糖蛋白酶,对温度、压力极为敏感。因此,在大蒜粉的制备工艺中,关键技术是对蒜酶活力的保留,它决定了最终大蒜辣素的转化程度。
蒜酶活力测定的常见方法有丙酮酸法[9-10]、乳酸脱氢酶法[11]、4-巯基吡啶法[12]、2-硝基-5-硫代苯甲酸法[13]等,而大蒜粉蒜酶活力的测定方法鲜有报道。作者所在课题组[14-15]经过前期大量研究,确定蒜酶最适反应温度为35 ℃、溶液最适pH值为7.0。蒜酶可与蒜氨酸反应生成大蒜辣素和丙酮酸,丙酮酸与2,4-二硝基苯肼在碱性环境中可生成红棕色的苯腙硝醌化合物,在一定浓度范围内丙酮酸的量与吸光度呈线性关系。因此,作者建立了紫外可见分光光度法测定大蒜粉的蒜酶活力,对显色条件进行优化,并进行方法学验证,以期对大蒜粉的生产工艺进行评价。
1 实验
1.1 材料、试剂与仪器
大蒜粉(共10批),新疆埃乐欣药业有限公司。
丙酮酸钠(>99%)、磷酸吡哆醛,生化试剂,西格玛奥德里奇贸易有限公司;2,4-二硝基苯肼,生化试剂,上海索莱宝生物科技有限公司;蒜氨酸(90%),新疆埃乐欣药业有限公司;盐酸、三氯乙酸,分析纯,成都科龙化工试剂厂;磷酸氢二钠、无水磷酸二氢钾,分析纯,天津致远化学试剂有限公司;氯化钠,分析纯,天津北联精细化学品开发有限公司;氢氧化钠,分析纯,天津永晟精细化工有限公司。
UV-2550型紫外可见分光光度计,日本岛津公司;AB135-S型分析天平,梅特勒-托利多;5424R型低温离心机,德国艾本德。
1.2 溶液的配制
磷酸盐缓冲液(pH 值7.0):取磷酸氢二钠、无水磷酸二氢钾适量,加水溶解并定容于1 000 mL容量瓶中。临用前每100 mL溶液加磷酸吡哆醛溶液(1 mmol·L-1)2.5 mL,即得。
丙酮酸钠标准溶液:取丙酮酸钠适量,加磷酸盐缓冲液制成1 μmol·mL-1的丙酮酸钠标准溶液。
蒜氨酸溶液:取蒜氨酸适量,加磷酸盐缓冲液制成10 mmol·L-1蒜氨酸溶液。
供试溶液:精密称取大蒜粉15 mg,置于50 mL容量瓶中,加磷酸盐缓冲液溶解并定容至刻度,摇匀,12 000 r·min-1离心(4 ℃)5 min;取上清液1.0 mL置于10 mL容量瓶中,加磷酸盐缓冲液稀释至刻度,摇匀,即得,于0~4 ℃保存。
供试酶灭活溶液:取供试溶液5 mL,置于水浴中煮沸5 min,即得。
1.3 检测波长的确定
取丙酮酸钠标准溶液80 μL,加磷酸盐缓冲液至0.8 mL,加10%三氯乙酸0.8 mL、2,4-二硝基苯肼溶液0.4 mL,摇匀,室温放置9 min;加氢氧化钠溶液2.0 mL,摇匀,室温放置5 min;以磷酸盐缓冲液代替丙酮酸钠标准溶液,同法操作,作为空白对照,在300~800 nm区间进行光谱扫描。
1.4 大蒜粉蒜酶活力的测定
取供试溶液0.4 mL、蒜氨酸溶液0.4 mL,分别于(35±0.5) ℃水浴中预热3 min,混合后于(35±0.5) ℃水浴反应5 min,立即加10%三氯乙酸0.8 mL,摇匀,加2,4-二硝基苯肼溶液0.4 mL,按1.3方法测定520 nm处吸光度。另以供试酶灭活溶液代替供试溶液,同法测定520 nm处吸光度。根据单位时间丙酮酸的生成量按下式计算大蒜粉蒜酶活力(U·g-1):
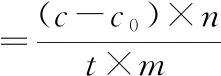
式中:c为测得的丙酮酸浓度,μmol·mL-1;c0为供试品中本底水平丙酮酸浓度,μmol·mL-1;n为供试溶液稀释倍数;t为反应时间,t=5 min;m为大蒜粉称样量,g。
2 结果与讨论
2.1 检测波长的选择
丙酮酸钠与2,4-二硝基苯肼反应后,在碱性条件下于445 nm和520 nm处有吸收峰(图1)。蒜酶与辅酶磷酸吡哆醛结合可形成席夫碱[16],在430 nm附近有弱的吸收峰,为避免干扰,选择520 nm作为检测波长。
2.2 显色条件的优化
2.2.1 2,4-二硝基苯肼溶液浓度的选择
取丙酮酸钠标准溶液80 μL,加磷酸盐缓冲液至0.8 mL,加10%三氯乙酸0.8 mL,分别加不同浓度的2,4-二硝基苯肼溶液0.4 mL,按1.3方法测定520 nm处吸光度,结果见图2。
由图2可以看出,2,4-二硝基苯肼溶液浓度在1.0~4.0 mmol·L-1时,吸光度呈上升趋势;2,4-二硝基苯肼溶液浓度在5.0~10.0 mmol·L-1时,吸光度基本稳定。综合考虑,确定2,4-二硝基苯肼溶液浓度为5.0 mmol·L-1。

图1 丙酮酸钠与2,4-二硝基苯肼反应液的UV-Vis吸收光谱Fig.1 UV-Vis absorption spectrum of reaction solution of sodium pyruvate with 2,4-dinitrophenylhydrazine

图2 2,4-二硝基苯肼溶液浓度对吸光度的影响Fig.2 Effect of concentration of 2,4-dinitrophenylhydrazine solution on absorbance
2.2.2 反应时间的选择
取丙酮酸钠标准溶液80 μL,加磷酸盐缓冲液至0.8 mL,加10%三氯乙酸0.8 mL、2,4-二硝基苯肼溶液0.4 mL,摇匀,在室温分别放置一定时间,按1.3方法测定520 nm处吸光度,结果见图3。

图3 反应时间对吸光度的影响Fig.3 Effect of reaction time on absorbance
由图3可以看出,丙酮酸钠与2,4-二硝基苯肼溶液反应3~4 min时,吸光度明显上升;反应4~9 min时,吸光度缓慢上升;之后延长反应时间,吸光度几乎无变化。因此,确定反应时间为9 min。
2.2.3 氢氧化钠溶液浓度的选择
取丙酮酸钠标准溶液80 μL,加磷酸盐缓冲液至0.8 mL,加10%三氯乙酸0.8 mL、2,4-二硝基苯肼溶液0.4 mL,摇匀,室温放置9 min,分别加不同浓度的氢氧化钠溶液2.0 mL,按1.3方法测定520 nm处吸光度,结果见图4。
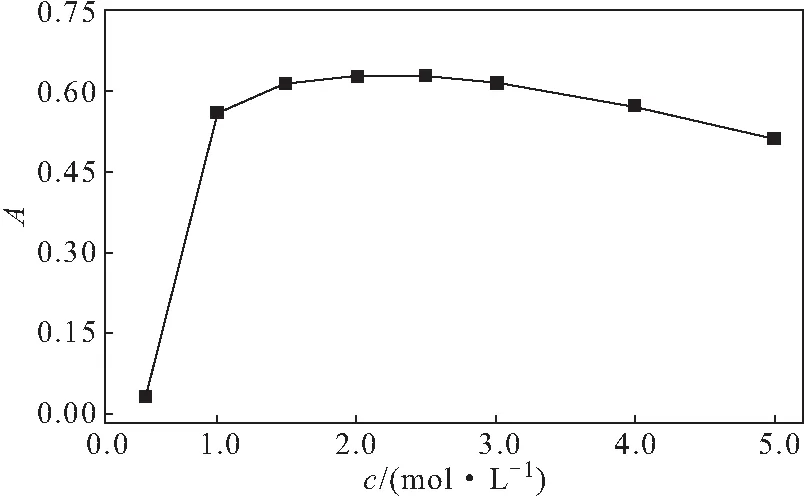
图4 氢氧化钠溶液浓度对吸光度的影响Fig.4 Effect of concentration of sodium hydroxide solution on absorbance
由图4可以看出,随着氢氧化钠溶液浓度的增加,吸光度迅速上升;当氢氧化钠溶液浓度为2.0~2.5 mol·L-1时,吸光度较稳定;继续增加氢氧化钠溶液浓度,吸光度呈下降趋势。因此,确定氢氧化钠溶液浓度为2.5 mol·L-1。
2.2.4 显色时间的选择
取丙酮酸钠标准溶液0.8 mL,加磷酸盐缓冲液至8 mL,加10%三氯乙酸8 mL、2,4-二硝基苯肼溶液4 mL,摇匀,室温放置9 min,加氢氧化钠溶液20 mL,摇匀,室温放置一定时间,按1.3方法测定520 nm处吸光度,结果见图5。
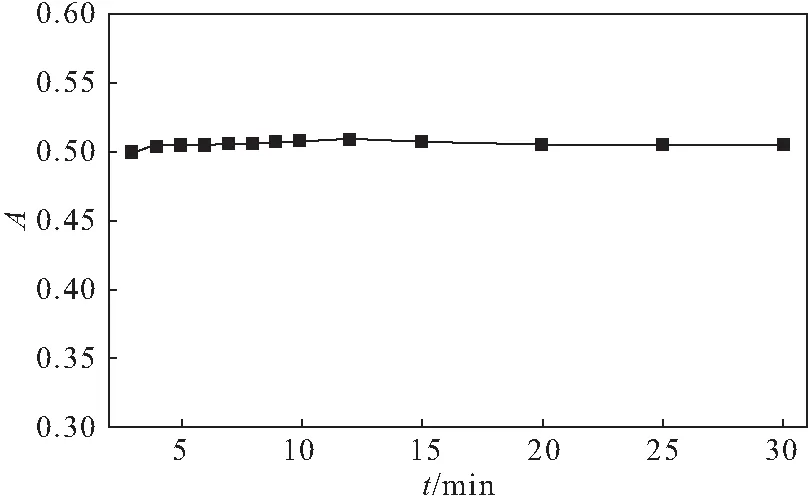
图5 显色时间对吸光度的影响Fig.5 Effect of coloration time on absorbance
由图5可以看出,加氢氧化钠溶液显色后,在5~30 min内,吸光度基本无明显变化。因此,确定显色时间为5 min。
2.3 方法学考察
2.3.1 丙酮酸钠的线性范围
取丙酮酸钠标准溶液,加磷酸盐缓冲液配制成浓度为0.05 μmol·mL-1、0.10 μmol·mL-1、0.20 μmol·mL-1、0.30 μmol·mL-1、0.40 μmol·mL-1、0.50 μmol·mL-1系列丙酮酸钠溶液。取上述系列丙酮酸钠溶液0.8 mL,加10%三氯乙酸0.8 mL、2,4-二硝基苯肼溶液0.4 mL,按1.3方法测定520 nm处吸光度。以丙酮酸钠浓度为横坐标、吸光度为纵坐标绘制标准曲线,拟合得线性回归方程y=12.29x+5.63×10-3,R2=0.9999。表明,丙酮酸钠浓度在0.01~0.10 μmol·mL-1范围内与吸光度呈良好的线性关系。
2.3.2 精密度
精密称取大蒜粉约15 mg,共6份,按1.2方法配制成供试溶液,按1.4方法测定蒜酶活力。测得供试溶液蒜酶活力的RSD为1.9%,符合要求。
2.3.3 加标回收率
精密称取大蒜粉约12.5 mg,共9份,分别置于50 mL容量瓶中,分为3组,依次加丙酮酸钠11.0 mg、13.8 mg、16.5 mg,按1.2方法配制成低、中、高浓度加标样,按1.4方法测定蒜酶活力。测得蒜酶活力平均加标回收率为98.1%,RSD为1.8%(n=9)(表1)。

表1 加标回收率测定结果
2.3.4 溶液稳定性
精密称取大蒜粉约15 mg,按1.2方法配制成供试溶液,于0~4 ℃分别保存1 h、2 h、4 h、6 h、8 h,按1.4方法测定蒜酶活力。结果表明,在0~4 ℃保存8 h内,供试溶液蒜酶活力的RSD为1.6%,稳定性良好。但蒜酶活力易受温度等因素影响,建议临用新配。
2.4 样品测定
测定不同批次大蒜粉的蒜酶活力。结果表明,不同批次大蒜粉的蒜酶活力差异较明显(表2)。
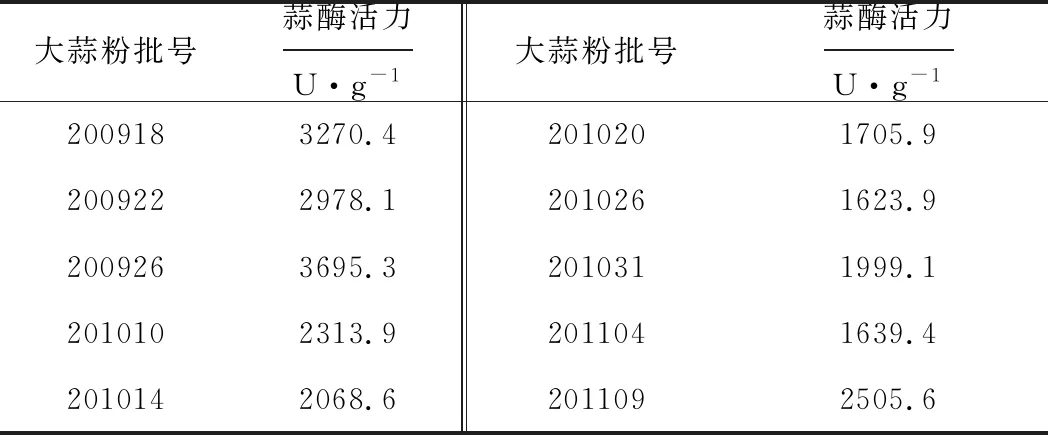
表2 大蒜粉蒜酶活力的测定结果
2.5 讨论
大蒜粉成分较为复杂,本研究扣除其本身含有蒜氨酸反应生成的丙酮酸,再加入蒜氨酸底物与蒜酶反应,通过测定丙酮酸的生成量计算蒜酶活力。大蒜粉中蒜氨酸还可转化为大蒜辣素,而大蒜辣素对蒜酶活力有一定的抑制作用。考虑到不同大蒜粉中蒜氨酸含量的差异可能会对蒜酶活力测定结果产生影响,故设计实验,通过外加蒜氨酸将大蒜粉中蒜氨酸含量拉至同等水平后,再进行蒜酶活力测定。实验结果与上述测定结果(表2)保持一致,大蒜粉中蒜氨酸含量的差异对蒜酶活力的测定无影响。说明大蒜粉中蒜氨酸所转化的大蒜辣素不足以抑制蒜酶活力,故本研究方法可用于不同蒜氨酸含量的大蒜粉蒜酶活力的评价。
3 结论
建立了紫外可见分光光度法测定大蒜粉的蒜酶活力,对显色条件进行优化,并进行方法学验证。结果表明,最佳显色条件为:2,4-二硝基苯肼溶液浓度为5.0 mmol·L-1、反应时间为9 min、氢氧化钠溶液浓度为2.5 mol·L-1、显色时间为5 min。丙酮酸钠浓度在0.01~0.10 μmol·mL-1范围内与吸光度线性关系良好(R2=0.9999),蒜酶活力的平均加标回收率为98.1%(RSD=1.8%,n=9)。该方法稳定可靠、精密度好、准确度高,可用于不同蒜氨酸含量大蒜粉的蒜酶活力测定,对大蒜粉制备工艺的控制具有重要应用价值。
