基于过氧化钙的类芬顿反应对亚甲基蓝的降解
2021-05-26钟书华伍梓芃宋功武
钟书华,伍梓芃,何 瑜*,宋功武
(1.湖北省生态环境厅鄂州生态环境监测中心,湖北 鄂州 436000; 2.湖北大学化学化工学院,湖北 武汉 430062)
亚甲基蓝(Methylene Blue,MB)是一种常见的碱性染料,在医疗、印刷及纺织行业应用广泛,但其具有毒性,人体吸入后会产生头痛、恶心等不良反应,而且进入水体中会对环境造成污染。近年来,对水体中亚甲基蓝的降解处理一直备受关注。传统的降解方法主要有电化学法、光催化降解法、吸附法、膜分离法、微生物降解法等,但通常都很难将亚甲基蓝降解完全[1-3]。
层状双氢氧化物(LDH)是一种含有阴离子的层柱状结构化合物,其结构中均匀分布着两种金属离子,层间的阴离子具有很好的交换性能。在催化降解中,如果LDH中某种金属离子为活性的过渡金属离子时,将具有更好的催化性能与选择性,如含有Fe的LDH能够发生类Fenton反应,从而使降解完全[4-5]。
在类Fenton反应中,一般从H2O2中直接获得羟基自由基(·OH),但H2O2并不稳定,很容易发生分解,最终导致利用率不高;且H2O2会污染环境[6]。研究表明,固态的CaO2在水介质中能缓慢释放H2O2和氧气,可以避免大量H2O2快速分解,改善水体氧环境[7-14];且在通常情况下CaO2比较稳定,便于储存。因此,CaO2可作为类Fenton反应中H2O2的持续供源,减少对环境的不利影响。鉴于此,作者采用共沉淀法制备Cu-Zn-Fe型层状双氢氧化物(Cu-Zn-Fe-LDH),并与CaO2进行复合,得到基于CaO2的Cu-Zn-Fe-LDH(Cu-Zn-Fe-LDH-CaO2)复合材料,通过XRD、FTIR、TEM对其进行表征;以亚甲基蓝为模型污染物考察复合材料的降解性能,对降解条件进行优化。
1 实验
1.1 试剂与仪器
CuSO4·5H2O、FeSO4·7H2O、NaOH、KH2PO4、30%H2O2,分析纯,国药集团化学试剂有限公司;ZnSO4·7H2O,分析纯,天津百世化工;Ca(OH)2,分析纯,上海麦克林生化科技;亚甲基蓝,天津天新精细化工;98%浓硫酸,开封东大化工。
D8 Advance型 X-射线衍射仪,德国Bruker公司;Nicolet iS10型傅立叶变换红外光谱仪,赛默飞世尔公司;Lambda35型紫外可见分光光度计,美国PE公司。
1.2 Cu-Zn-Fe-LDH的制备
采用共沉淀法制备LDH,控制Cu、Zn、Fe的物质的量比为1∶7∶2。将CuSO4·5H2O、ZnSO4·7H2O、FeSO4·7H2O溶于水中,剧烈搅拌,调节溶液pH值至7后,在40 ℃水浴中搅拌3 h,陈化3 h后倾去上清液,下层沉淀离心15 min后再洗涤,连续重复3次,即得黄色沉淀Cu-Zn-Fe-LDH。
1.3 CaO2及复合材料的制备
将过量的Ca(OH)2固体溶解于少量水中,形成悬浊液,加入适量的KH2PO4稳定剂,搅拌30 min;加入适量30%H2O2溶液反应15 min,再加入少量Cu-Zn-Fe-LDH悬浊液搅拌5 min至均匀,抽滤,取沉淀在120 ℃下烘2 h,即得浅绿色Cu-Zn-Fe-LDH-CaO2复合材料,并进行XRD、FTIR、TEM表征。
不加Cu-Zn-Fe-LDH悬浊液,同法制备CaO2。由于反应并不完全,CaO2中有Ca(OH)2残留[15]。
1.4 复合材料催化降解亚甲基蓝
配制一定浓度的亚甲基蓝溶液,加入一定量Cu-Zn-Fe-LDH-CaO2复合材料、KH2PO4,用H2SO4调节溶液的pH值,每隔一定时间取样,测定664 nm处吸光度,计算降解率[16-17]。
2 结果与讨论
2.1 复合材料的表征
2.1.1 XRD分析(图1)
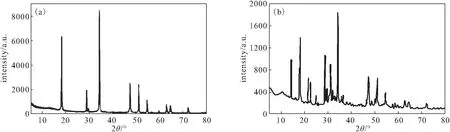
图1 CaO2(a)及Cu-Zn-Fe-LDH-CaO2复合材料(b)的XRD图谱Fig.1 XRD patterns of CaO2(a) and Cu-Zn-Fe-LDH-CaO2 composite(b)
由图1a可知,在2θ为30.3°、35.6°、47.3°、51.6°、53.2°、60.9°处的衍射峰与CaO2的主要衍射峰相吻合。由图1b可知,Cu-Zn-Fe-LDH-CaO2复合材料中存在CaO2的主要衍射峰,但峰强度有所下降,此外,由于Cu-Zn-Fe-LDH的加入,在2θ为14.5°、21.6°、23.2°、31.3°处产生了新的衍射峰。
2.1.2 FTIR分析(图2)
由图2可知,CaO2的主要吸收峰在3 642 cm-1、1 471 cm-1与1 056 cm-1附近,Cu-Zn-Fe-LDH-CaO2复合材料的峰位置(3 603 cm-1、1 423 cm-1、1 110cm-1附近)与CaO2基本一致,此外,由于Cu-Zn-Fe-LDH的加入,在3 404 cm-1处出现了新的吸收峰。
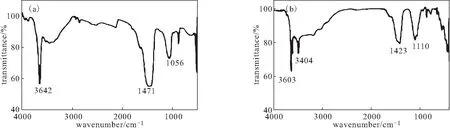
图2 CaO2(a)及Cu-Zn-Fe-LDH-CaO2复合材料(b)的FTIR图谱Fig.2 FTIR spectra of CaO2(a) and Cu-Zn-Fe-LDH-CaO2 composite(b)
2.1.3 TEM分析(图3)

图3 CaO2(a)及Cu-Zn-Fe-LDH-CaO2复合材料(b)的TEM照片Fig.3 TEM images of CaO2(a) and Cu-Zn-Fe-LDH-CaO2 composite(b)
由图3可知,CaO2及Cu-Zn-Fe-LDH-CaO2复合材料均有棱角结构,且Cu-Zn-Fe-LDH-CaO2复合材料能看到比较隐藏的六边形的Cu-Zn-Fe-LDH结构。
2.2 复合材料催化降解亚甲基蓝的条件确定
2.2.1 复合材料用量的选择
配制8 mg·L-1的亚甲基蓝溶液,分别加入不同量(10 mg、25 mg、50 mg、75 mg、100 mg)的复合材料及50 mg KH2PO4,用H2SO4调节溶液的pH值,分别在反应前、反应60 min测定吸光度,计算降解率,结果见图4。
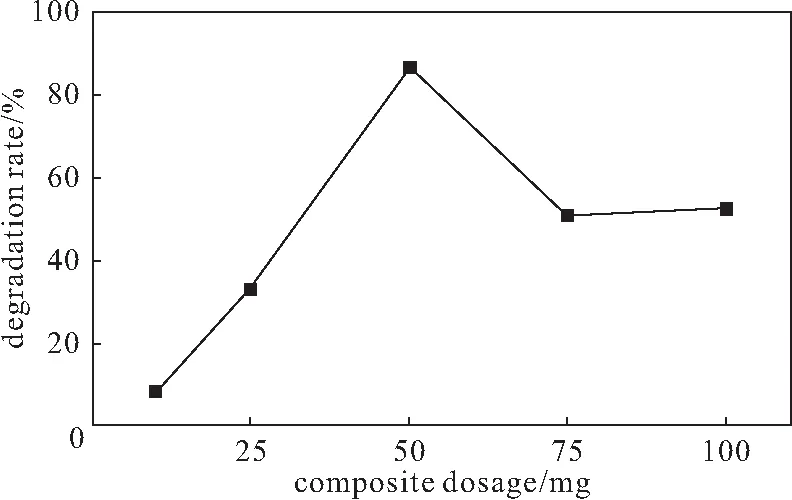
图4 复合材料用量对降解率的影响Fig.4 Effect of composite dosage on degradation rate

2.2.2 亚甲基蓝初始浓度的选择
分别配制不同浓度(1 mg·L-1、2 mg·L-1、4 mg·L-1、6 mg·L-1、8 mg·L-1、10 mg·L-1)的亚甲基蓝溶液,加入50 mg复合材料、50 mg KH2PO4,用H2SO4调节溶液的pH值,分别在反应前、反应60 min测定吸光度,计算降解率,结果见图5。
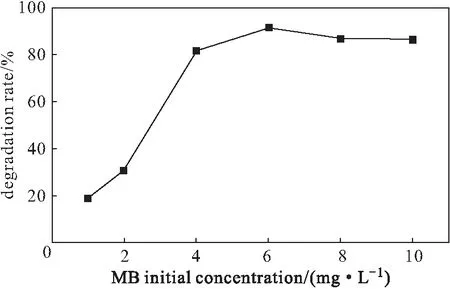
图5 亚甲基蓝初始浓度对降解率的影响Fig.5 Effect of MB initial concentration on degradation rate
由图5可知,随着亚甲基蓝初始浓度的增加,降解率逐渐升高而后趋于稳定。当亚甲基蓝初始浓度为6 mg·L-1时,降解率达到最高。这是因为,在固定条件下,H2O2、H+与Fe2+反应产生的·OH量是一定的,在一定浓度范围内,反应物分子受到·OH攻击的几率会随着亚甲基蓝初始浓度的增加而升高,最终趋于稳定[16]。因此,选择亚甲基蓝初始浓度为6 mg·L-1。
2.2.3 溶液pH值的选择
配制8 mg·L-1的亚甲基蓝溶液(pH值为7.2),加入50 mg复合材料、一定量的KH2PO4,用不同量的酸或碱调节溶液的pH值,剧烈搅拌,分别在反应前、反应30 min测定吸光度,计算降解率,结果见图6。
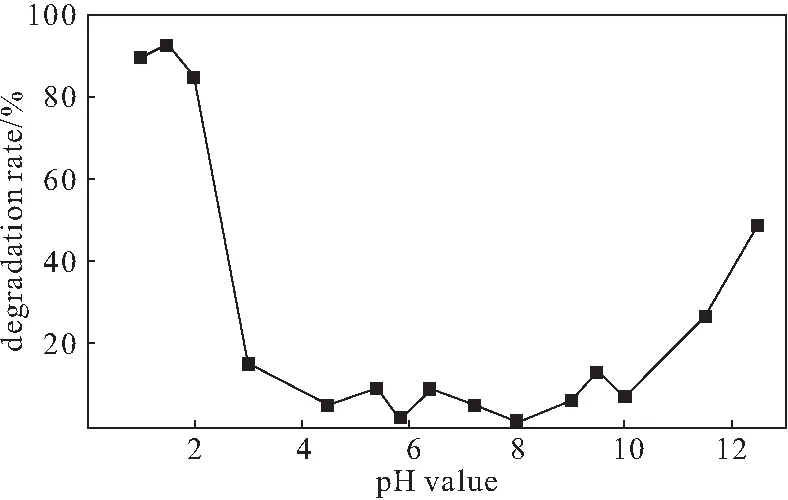
图6 pH值对降解率的影响Fig.6 Effect of pH value on degradation rate
由图6可知,类Fenton反应体系在强酸性条件下降解较快。这是由于,复合材料中混有大量的Ca(OH)2,导致很多H+与OH-反应,加上复合材料中LDH含量较少,而生成的CaO2十分蓬松,拥有很多孔,使得LDH吸附,进而在弱酸性条件下降解也很慢;而在强酸性条件下,Ca(OH)2反应分解,CaO2也更容易产生·OH,有利于降解。理论上碱性条件不利于类Fenton反应,但由于LDH特殊的层状结构产生了吸附效果;在碱性环境下,提供给H2O2的·OH也有利于降解。因此,应控制溶液pH值<3。
2.2.4 KH2PO4用量的选择
配制8 mg·L-1的亚甲基蓝溶液,加入50 mg复合材料,分别加入不同量(0 mg、10 mg、25 mg、50 mg、75 mg、100 mg、150 mg)的KH2PO4,用H2SO4调节溶液的pH值,分别在反应前、反应30 min与60 min测定吸光度,计算降解率,结果见图7。
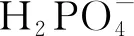
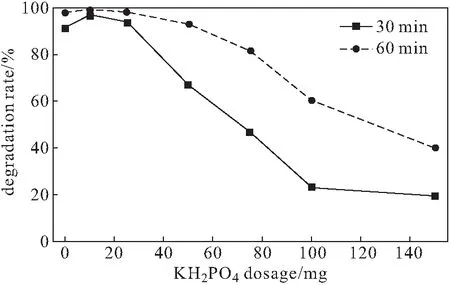
图7 KH2PO4用量对降解率的影响Fig.7 Effect of KH2PO4 dosage on degradation rate
由于KH2PO4对Fe2+与·OH的捕获导致Fe2+含量下降,同时Fe2+与CaO2对磷酸盐也存在降解作用,竞争降低了对亚甲基蓝的类Fenton降解,使得降解率下降[6]。因此,选择KH2PO4用量为10 mg。
2.3 溶解氧测定
采用溶解氧测定仪测定自来水中溶解氧含量。取50 mL沙湖污水样两份,测定溶解氧含量;再分别加入100 mg复合材料,静置一段时间后测定溶解氧含量,结果见表1。

表1 污水中溶解氧含量随时间的变化/(mg·L-1)
由表1可知,加入复合材料前,污水中溶解氧含量很低;加入复合材料后,污水中溶解氧含量升高,300 min后,两种污水中的溶解氧含量均接近自来水溶解氧含量(7.85 mg·L-1)。
3 结论
(1)与传统Fenton反应类似,基于CaO2的类Fenton反应中,以亚甲基蓝为模型污染物,复合材料用量、亚甲基蓝初始浓度、溶液pH值、KH2PO4用量等对·OH产率均有显著影响,从而影响亚甲基蓝的降解率。在复合材料用量为50 mg、亚甲基蓝初始浓度为6 mg·L-1、溶液pH值<3、KH2PO4用量为10 mg时,降解率超过90%。但在实际应用中,要合理控制复合材料用量与KH2PO4用量。
(2)由于CaO2溶解过程产生Ca(OH)2,且复合材料本身也含有Ca(OH)2,反应过程会使pH值升高,从而抑制类Fenton反应和H2O2的释放。在实际应用中,可控制氧化剂的加入;同时,可通过稳定反应体系的pH值,调节H2O2的释放速度从而达到更好的降解效果。
(3)根据溶解氧的测定结果可知,复合材料的制氧效果较好,300 min后,污水的溶解氧含量接近自来水溶解氧含量(7.85 mg·L-1)。
