黑果腺肋花楸有效物质的提取及抗氧化和降糖活性研究
2021-05-26张家豪
张家豪,马 芹
(1.石河子大学药学院,新疆 石河子 832000; 2.新疆华世丹药物研究有限责任公司,新疆 乌鲁木齐 830011)
黑果腺肋花楸(Aroniamelanocarpa),又称野樱莓、不老莓,是蔷薇科腺肋花楸属植物[1]。黑果腺肋花楸的果实呈球形,果肉为黑色,果汁为暗红色,口味酸甜,具有较强的耐寒性,喜湿润和透气性良好的土壤,能在-45 ℃的寒冷环境下生存,是集食用、药用、园林和生态价值于一身的喜阳耐寒落叶灌木[2]。原产自美国东北部[3],上世纪90年代引种至我国,先后引进了8个品种[4]。
黑果腺肋花楸中最重要活性成分是多酚类化合物,包括高浓度的花色苷、黄酮类化合物、原花青素及酚酸等,具有较强的抗氧化活性[5-6]。研究[7]表明,黑果腺肋花楸中多酚类化合物含量达到2.5%~3.5%,约是蓝莓的5倍、越橘的15倍、黑莓的10倍、覆盆子的20倍以及葡萄的80倍。此外,黑果腺肋花楸中黄酮类化合物含量(高达0.25%~0.35%)丰富[8-9],是已知植物中含量最高的。欧美和东亚一些国家以黑果腺肋花楸为原料生产的食品、药品、化妆品、保健品等产品十分丰富,相关产业已建立完善,取得了可观的经济效益。尽管如此,国内对于黑果腺肋花楸的利用主要体现在园林绿化方面,对其果实加工及在食品和药品等方面的开发研究还处于起步阶段[10]。鉴于此,作者建立了黑果腺肋花楸多酚和黄酮的超声辅助提取法,采用单因素实验和正交实验并通过多指标综合评分法优化提取工艺;通过对DPPH的清除能力评价其抗氧化活性;并通过建立肝细胞高糖损伤模型,比较提取物组与模型组葡萄糖消耗量评价其降糖活性,为黑果腺肋花楸保健品的进一步开发利用提供理论依据。
1 实验
1.1 材料、试剂与仪器
黑果腺肋花楸(批号:20180606、20180706、20180806),产自新疆塔城裕民县;人肝LO2细胞系,购于上海细胞典藏中心。
没食子酸标准品(110831-200803)、芦丁标准品(110742-201622),中国食品药品研究院;维生素C(191202),四川依科制药有限公司;GLU葡萄糖检测试剂盒(20191207137),南京建成生物工程研究所;其它试剂,市售。
KQ5200DE型数控超声波清洗器,昆山超声仪器有限公司;TD2002型电子天平,余姚金诺天平仪器有限公司;UV-2600型紫外可见分光光度计,岛津仪器(苏州)有限公司;2323-2型CO2细胞培养箱,美国谢尔登公司;Model-680型酶标仪,BIO-RAD公司。
1.2 黑果腺肋花楸有效物质的提取
称取一定量黑果腺肋花楸,按一定液料比加入一定体积分数的乙醇打浆,在一定超声功率下提取一定时间,除去滤渣及乙醇,得黑果腺肋花楸提取液。将提取液挥去大部分水分得浸膏,然后置于真空干燥箱中烘干得干膏,称重。出膏率=(干膏质量/黑果腺肋花楸质量)×100%。
采用单因素实验和正交实验优化提取工艺。
1.2.1 单因素实验
1.2.1.1 乙醇体积分数的影响
精确称取一定量黑果腺肋花楸,按液料比20∶1(mL∶g,下同)加入体积分数分别为40%、50%、60%、70%、80%的乙醇打浆,在超声功率180 W下提取50 min,提取温度为50 ℃,除去滤渣及乙醇后,测定黑果腺肋花楸提取液的吸光度值,考察乙醇体积分数对多酚含量、黄酮含量和出膏率的影响。
1.2.1.2 超声功率的影响
精确称取一定量黑果腺肋花楸,按液料比20∶1加入60%乙醇打浆,在超声功率分别为80 W、100 W、120 W、140 W、160 W、180 W、200 W下提取50 min,提取温度为50 ℃,除去滤渣及乙醇后,测定黑果腺肋花楸提取液的吸光度值,考察超声功率对多酚含量、黄酮含量和出膏率的影响。
1.2.1.3 提取温度的影响
精确称取一定量黑果腺肋花楸,按液料比20∶1加入60%乙醇打浆,在超声功率180 W下提取50 min,提取温度分别为40 ℃、50 ℃、60 ℃、70 ℃,除去滤渣及乙醇后,测定黑果腺肋花楸提取液的吸光度值,考察提取温度对多酚含量、黄酮含量和出膏率的影响。
1.2.1.4 提取时间的影响
精确称取一定量黑果腺肋花楸,按液料比20∶1加入60%乙醇打浆,在超声功率180 W下分别提取10 min、20 min、30 min、40 min、50 min、60 min、70 min,提取温度为50 ℃,除去滤渣及乙醇后,测定黑果腺肋花楸提取液的吸光度值,考察提取时间对多酚含量、黄酮含量和出膏率的影响。
1.2.1.5 液料比的影响
精确称取一定量黑果腺肋花楸,分别按液料比10∶1、15∶1、20∶1、25∶1、30∶1加入60%乙醇打浆,在超声功率180 W下提取50 min,提取温度为50 ℃,除去滤渣及乙醇后,测定黑果腺肋花楸提取液的吸光度值,考察液料比对多酚含量、黄酮含量和出膏率的影响。
1.2.2 正交实验
在单因素实验的基础上,选取超声功率、提取时间、乙醇体积分数、液料比为考察因素,以多酚含量、黄酮含量和出膏率为考察指标,进行L9(34)正交实验,采用多指标综合评分法对实验结果进行分析,优化提取工艺。
1.3 多酚含量的测定
采用Folin-Ciocalteu法(福林酚试剂法),以没食子酸为标准品,参考GB/T 8313-2008[11]方法绘制没食子酸的标准曲线。精确称量适量没食子酸,加蒸馏水配制成1.0 mg·mL-1的没食子酸储备液。准确吸取2.00 mL、3.00 mL、4.00 mL、5.00 mL、6.00 mL没食子酸储备液,分别置于100 mL容量瓶中,加蒸馏水至刻度,摇匀,得到浓度(μg·mL-1)分别为20、30、40、50、60 的没食子酸标准溶液。分别取1 mL各浓度没食子酸标准溶液置于10 mL容量瓶中,加入1 mL 50%福林酚试剂、3 mL 7.5%碳酸钠溶液、5 mL蒸馏水,避光显色2 h后,测定其在765 nm处吸光度值。以没食子酸浓度为横坐标、吸光度值为纵坐标绘制没食子酸标准曲线,拟合得线性回归方程。
准确吸取1 mL黑果腺肋花楸提取液,按上述方法测定765 nm处吸光度值,根据回归方程计算多酚浓度,按式(1)计算提取液中多酚含量(mg·g-1):

(1)
式中:c为提取液中多酚浓度,mg·mL-1;V为待测提取液体积,mL;n为提取液的稀释倍数;m为黑果腺肋花楸质量,g。
1.4 黄酮含量的测定[12]
精确称取适量105 ℃干燥至恒重的芦丁标准品,加甲醇溶解并定容,配制成150 μg·mL-1的芦丁标准溶液。准确移取芦丁标准溶液0.50 mL、1.00 mL、2.00 mL、3.00 mL、4.00 mL,分别置于10 mL容量瓶中,加入30%乙醇至5 mL,加入5%亚硝酸钠溶液0.3 mL,振摇后静置5 min;加入10%硝酸铝溶液0.3 mL,振摇后静置6 min;再加入4.3%氢氧化钠溶液2 mL,用30%乙醇定容至刻度,摇匀,静置15 min,测定其在510 nm处吸光度值。以芦丁浓度为横坐标、吸光度值为纵坐标绘制芦丁标准曲线,拟合得线性回归方程。
准确吸取1 mL黑果腺肋花楸提取液,按上述方法测定510 nm处吸光度值,根据回归方程计算黄酮浓度,按式(2)计算提取液中黄酮含量(mg·g-1):

(2)
式中:m1为根据标准曲线计算出的待测液中黄酮量,μg;m为黑果腺肋花楸质量,g;V1为待测液体积,mL;V2为提取液总体积,mL。
1.5 抗氧化活性评价
称取一定量DPPH溶于无水乙醇中,配制成100 μg·mL-1的DPPH母液,置于遮光瓶中,-20 ℃下保存。将DPPH母液稀释至50 μg·mL-1[13],于96孔板中每孔加入100 μL,然后按浓度梯度加入100 μL VC溶液或100 μL黑果腺肋花楸提取液;置于37 ℃烘箱中避光反应30 min,用酶标仪测定490 nm处吸光度值,并计算IC50值。
1.6 降糖活性评价
1.6.1 黑果腺肋花楸提取物溶液的配制
将黑果腺肋花楸干膏溶于4% DMSO溶液中,配制成5 mg· mL-1的母液A;用4% DMSO溶液稀释得到1 mg· mL-1的母液B;母液A、B各2倍稀释共得14个浓度(1 000~3.125 μg·mL-1)的黑果腺肋花楸提取物溶液。
1.6.2 对LO2细胞增殖的毒性研究(MTT法)[14]
对LO2细胞进行复苏传代[15],取对数生长期的LO2细胞,制成细胞悬液并进行细胞计数后,接种至96孔板中,每孔100 μL,于37 ℃、5%CO2培养箱中培养24 h;按浓度梯度将黑果腺肋花楸提取物溶液依次加入到96孔板中,每孔40 μL,然后每孔补加60 μL培养基,继续培养20 h;每孔加入20 μL MTT溶液,在37 ℃下培养4 h,弃去培养液;每孔加入100 μL DMSO溶液,振摇10 min,用酶标仪测定490 nm处吸光度值,取平均值,计算存活率,选取其中5个结果相近且差异较小的浓度进行降糖作用研究。
1.6.3 对LO2细胞的降糖作用
对LO2细胞进行复苏传代[15],取对数生长期的LO2细胞,制成细胞悬液并进行细胞计数后,接种至96孔板中,贴壁培养12 h,弃去培养基;用PBS缓冲液洗涤2~3次,弃去洗涤液,每孔加入100 μL无糖培养基;提取物组与肝细胞高糖损伤模型组加入50 μL 25 mmol·L-1的葡萄糖溶液,对照组与空白组加入50 μL无糖培养基,置于37 ℃、5%CO2培养箱中培养6 h;向提取物组与对照组加入MTT实验选取的5个浓度的提取物溶液,按照浓度梯度每孔加40 μL,然后再补加10 μL无糖培养基,模型组与空白组每孔补加50 μL无糖培养基,于37 ℃、5%CO2培养箱中培养24 h。按葡萄糖检测试剂盒的使用说明进行检测,另取一个新的96孔板,分为样本组、校准组、质控组及空白组;每孔加入200 μL葡萄糖试剂为底液,样本组每孔加2 μL提取物溶液并混匀;校准组加入2 μL校准液;质控组加入2 μL质控液;空白组加入2 μL无糖培养基,于37 ℃反应10 min,用酶标仪测定490 nm处吸光度值,每组取平均值,按式(3)计算葡萄糖浓度(mmol·L-1):

(3)
2 结果与讨论
2.1 单因素实验结果
2.1.1 乙醇体积分数的影响(表1)

表1 乙醇体积分数对黑果腺肋花楸多酚含量、黄酮含量和出膏率的影响
从表1可知,乙醇体积分数在40%~80%时,随着乙醇体积分数的增大,多酚含量先升高后下降,黄酮含量总体逐渐升高,出膏率总体呈先下降后升高的趋势。这是由于,多酚在植物中与蛋白质等物质一般通过氢键形式结合,乙醇体积分数较小时,不足以破坏氢键或者破坏程度不够,而乙醇体积分数较大时,则会降低溶剂极性。当乙醇体积分数为50%时,多酚含量最高,为6.010 mg·g-1;当乙醇体积分数为70%时,黄酮含量最高,为10.237 mg·g-1;出膏率在乙醇体积分数为40%和80%时较高,分别为16.42%和17.12%。表明乙醇体积分数对黑果腺肋花楸有效物质的提取影响较大。
2.1.2 超声功率的影响(表2)
从表2可知,超声功率在80~200 W时,多酚含量、黄酮含量、出膏率均先下降再升高而后再下降。当超声功率为80 W时,多酚含量最高,为6.965 mg·g-1;当超声功率为140 W时,黄酮含量和出膏率最高,分别为12.588 mg·g-1、18.95%。表明超声功率对黑果腺肋花楸有效物质的提取影响较大。

表2 超声功率对黑果腺肋花楸多酚含量、黄酮含量和出膏率的影响
2.1.3 提取温度的影响(表3)

表3 提取温度对黑果腺肋花楸多酚含量、黄酮含量和出膏率的影响
从表3可知,随着提取温度的升高,多酚和黄酮的含量基本不变,处于一个相对稳定的状态;而出膏率呈缓慢下降的趋势。表明提取温度对黑果腺肋花楸有效物质的提取影响较小。综合考虑,确定最佳提取温度为40 ℃。
2.1.4 提取时间的影响(表4)
从表4可知,随着提取时间的延长,多酚含量、黄酮含量、出膏率均先升高后下降至平稳状态。多酚含量、黄酮含量在20 min时达到最高,分别为6.968 mg·g-1、14.125 mg·g-1;出膏率在30 min时达到最高,为18.59%。表明提取时间对黑果腺肋花楸有效物质的提取影响较大。
2.1.5 液料比的影响(表5)

表4 提取时间对黑果腺肋花楸多酚含量、黄酮含量和出膏率的影响
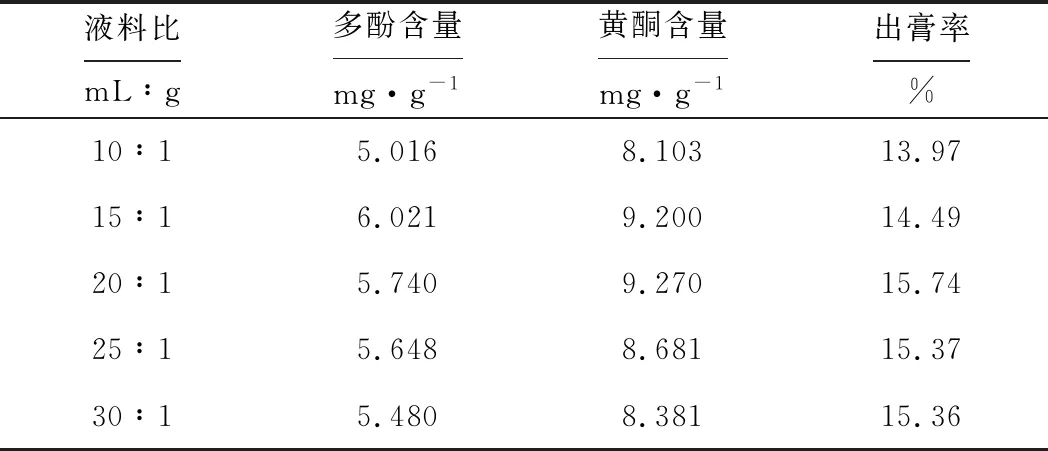
表5 液料比对黑果腺肋花楸多酚含量、黄酮含量和出膏率的影响
从表5可知,随着液料比的增大,多酚含量、黄酮含量均先升高后下降,出膏率则先升高后缓慢下降至平稳状态。这是由于,当原料质量一定时,增加溶剂用量有利于原料中有效成分向提取液中扩散,则多酚含量、黄酮含量升高;当溶剂增加到一定量时,原料中的有效成分大多已经溶解在提取液中了,继续增加溶剂用量,多酚含量、黄酮含量不再升高。当液料比为15∶1时,多酚含量最高,为6.021 mg·g-1;当液料比为20∶1时,黄酮含量、出膏率最高,分别为9.270 mg·g-1、15.74%。表明液料比对黑果腺肋花楸有效物质的提取影响较大。
2.2 正交实验结果
采用多指标综合评分法,以各指标的最大值为参照将数据统一化,多酚含量(X)赋权30%,黄酮含量(Y)赋权30%,出膏率(Z)赋权40%,综合评分W=(0.3X/6.462+0.3Y/12.121+0.4Z/18.03)×100,对实验结果进行直观分析和方差分析,确定最佳提取工艺。正交实验的因素与水平见表6,直观分析见表7,方差分析见表8。
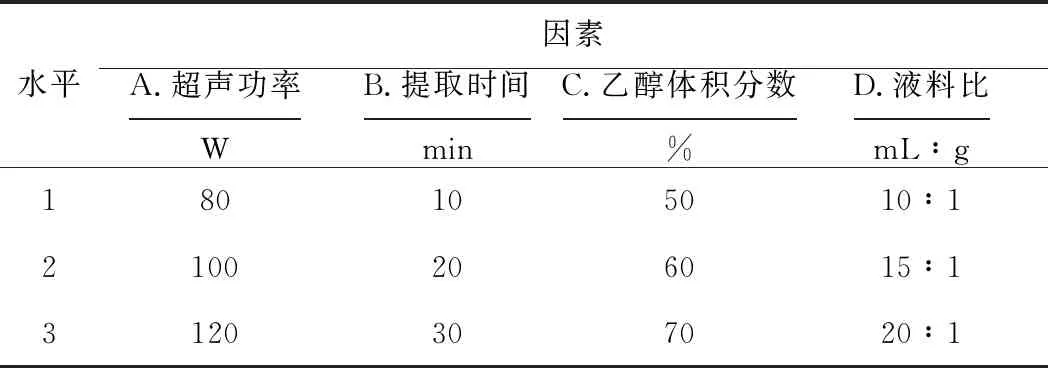
表6 正交实验的因素与水平

表7 正交实验的直观分析
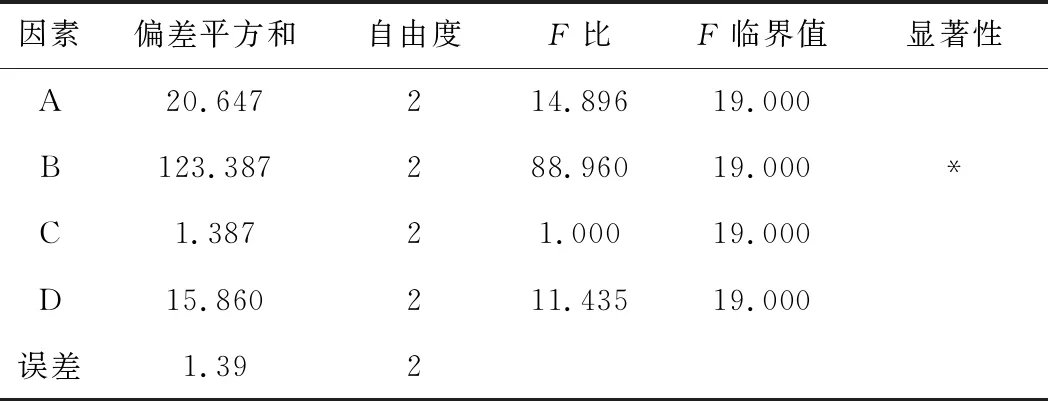
表8 正交实验的方差分析
由表7可知,各因素的影响大小顺序为B>A>D>C;各因素影响趋势为:B1>B3>B2,A3>A2>A1,D1>D3>D2,C3>C1>C2;理论最佳提取工艺为A3B1C3D1。由表8可知,因素B有显著性差异,因素A、C、D均无显著性差异。根据节能及安全方面考虑,确定最佳提取工艺为A3B1C1D1。综合单因素实验和正交实验结果,确定最佳提取工艺为:超声功率120 W、提取时间10 min、乙醇体积分数50%、液料比10∶1、提取温度40 ℃。
2.3 验证实验结果
在最佳提取工艺下,进行三批次工艺验证实验,结果见表9。

表9 工艺验证实验结果
由表9可知,三批次工艺验证实验结果评分均达到或超过95.0,且多酚含量、黄酮含量和出膏率的RSD分别为1.60%、2.27%、0.90%,表明该工艺稳定可行。
2.4 黑果腺肋花楸提取液的抗氧化活性(图1)

图1 不同浓度VC和黑果腺肋花楸提取液的抗氧化活性Fig.1 Antioxidant activity of VC and Aronia melanocarpa extract solution with different concentrations
从图1可知,VC与黑果腺肋花楸提取液的IC50值分别为9.550 μg·mL-1、0.355 mg·mL-1,根据黑果腺肋花楸出膏率为17%,将其IC50值换算为相同浓度单位,为60.350 μg·mL-1。研究[16]表明,桑葚、黑加仑和蓝莓提取物的抗氧化活性大小为桑葚>黑加仑>蓝莓,且桑葚提取物的抗氧化活性远高于蓝莓和黑加仑提取物,其IC50值依次为0.953 mg·mL-1、8.112 mg·mL-1、8.911 mg·mL-1;而本实验中黑果腺肋花楸提取液的IC50值小于桑葚提取物,相较于其它浆果,黑果腺肋花楸提取液的IC50值与VC更为接近。因此,黑果腺肋花楸提取液有较强的抗氧化活性。
2.5 黑果腺肋花楸提取物的降糖活性
2.5.1 MTT法优选浓度
LO2细胞毒性实验结果显示,加入14个浓度(1 000~3.125 μg·mL-1)的黑果腺肋花楸提取物溶液培养的LO2细胞活力较好,黑果腺肋花楸提取物溶液对LO2细胞的增殖无显著抑制作用,表明浓度为1 000~3.125 μg·mL-1的黑果腺肋花楸提取物溶液无肝细胞毒性。选取200 μg·mL-1、125 μg·mL-1、100 μg·mL-1、62.5 μg·mL-1、50 μg·mL-15个浓度的黑果腺肋花楸提取物溶液培养LO2细胞进行降糖实验,其LO2细胞的存活率如图2所示。

图2 LO2细胞存活率Fig.2 Survival rate of LO2 cell
2.5.2 葡萄糖含量检测结果(图3)
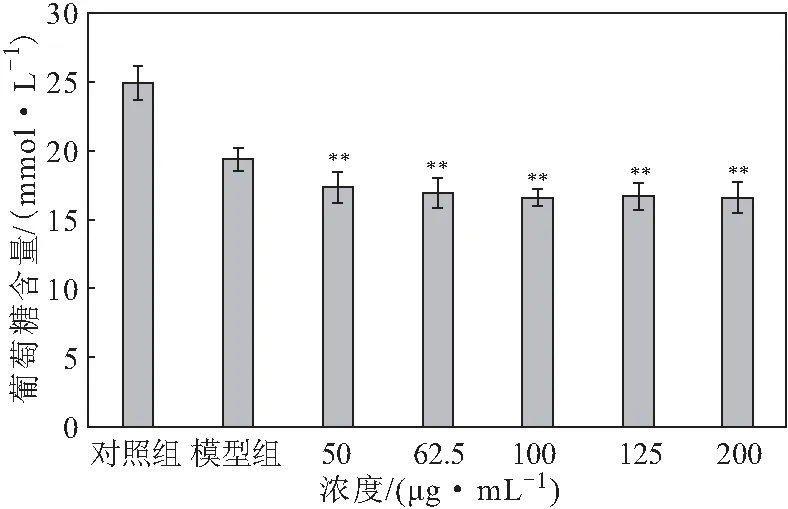
注:**,P≤0.01,表示与模型组相比具有显著性差异
葡萄糖含量越少,则消耗量越多,即降糖效果越好。从图3可知,加入黑果腺肋花楸提取物溶液后,葡萄糖含量明显下降;加入的提取物溶液浓度越高,葡萄糖含量越少。与肝细胞高糖损伤模型组相比,提取物组葡萄糖消耗量显著提升(P≤0.01),由5.59 mmol·L-1·(24 h)-1升至8.29 mmol·L-1·(24 h)-1。表明黑果腺肋花楸提取物具有较强的降糖活性。
3 结论
建立了黑果腺肋花楸多酚和黄酮的超声辅助提取法,采用单因素实验和正交实验并通过多指标综合评分法优化提取工艺。确定黑果腺肋花楸多酚和黄酮的最佳提取工艺为:超声功率120 W、提取时间10 min、乙醇体积分数50%、液料比10∶1(mL∶g)、提取温度40 ℃。黑果腺肋花楸提取物的IC50值(60.350 μg·mL-1)与VC的相近,具有较强的抗氧化活性;黑果腺肋花楸提取物溶液(1 000~3.125 μg·mL-1)无肝细胞毒性,且与肝细胞高糖损伤模型组相比,提取物组葡萄糖消耗量显著提升,由5.59 mmol·L-1·(24 h)-1升至8.29 mmol·L-1·(24 h)-1,具有较强的降糖活性。该方法操作简便、绿色无污染、提取率高,为黑果腺肋花楸的工业化生产奠定了基础。
