锂离子电池电化学仿真技术综述
2021-05-26杨东辉吴贤章王羽平黄汉川屠芳芳
杨东辉,吴贤章,王羽平,黄汉川,张 文,屠芳芳,陈 冬
(浙江南都电源动力股份有限公司基础技术研究院,浙江 杭州311305)
现代电子设备和电动汽车的应用迅速发展,对可充电锂离子电池(LIBs)等高能量密度电源的需求日益增长[1-2]。
锂离子电池是一个多尺度,多物理场的系统。以最为常见的磷酸铁锂电池来说,从材料尺度上组成其正极的活性材料为微米级的磷酸铁锂颗粒,从电极尺度上正极材料由磷酸铁锂、黏结剂和导电剂组成,从电芯尺度上电芯的集群由正极、隔膜和负极通过依次堆叠的方式组合而成。锂离子电池充放电过程包含固液界面处的电荷转移、锂离子的液相扩散和电迁移、锂离子的固相扩散、固相导电和液相导电引起的欧姆电阻、电极和导线之间的接触电阻等物理、化学过程,同时伴随着上述过程产生的欧姆热和反应热[3]。
研发人员在进行锂离子电池的开发时,往往是采用正向试错试开发的方式,通常需要考虑材料、配方、极片面密度、极片压实、极片尺寸、装配方式、注液量等重要设计参数,而要形成一个可用于工业生产的完整的锂离子电芯制作体系,需要对多达十几道工序的工艺进行开发,对初期大量实验数据的积累,因此现有锂离子电池体系开发方式多是在已有的体系上进行改进的方式,灵活性较小。锂离子电池仿真技术的出现为研发人员提供了新的思路,锂离子电池仿真模型主要分为等效电路模型和电化学模型,等效电路模型利用一些简单的电路元件来模拟电池的一些基础结构和物理化学过程的外在表现,其模拟的数据为电池电压、电流等外部数据,难以反映电池内部物理、化学过程的实际运行情况。电化学模型是一种第一原理模型,它利用一系列偏微分方程模拟电池内部发生的各种物理、化学过程,除了可以计算这些内部过程引起的电池外部电压、电流的变化以外,还可以定量计算电池内部各部分的电流、电位、物质浓度的变化,以及计算欧姆极化、浓差计划、电化学极化引起的过电位大小和热效应。因此电化学模型不但适用于锂离子电芯段的正向开发,而且可以计算出许多常规测试无法得到的参数。因此对于许多从事锂离子电池理论研究的工作者来说,电化学模型也是一个重要的研究工具。
本文主要介绍了电化学模型的原理和一些重要参数的辨识方法,以及电化学模型在锂离子电池研究方面的应用。
1 锂离子电池电化学模型介绍
1.1 锂离子电池电化学模型的发展
1996年,Doyle等[4]基于锰酸锂-石墨锂离子电池提出了锂离子电池准二维模型(P2D 模型)。该模型在一个简化的多孔电极结构和浓溶液理论的基础上,通过一系列偏微分方程组描述了锂离子电池内部发生的锂离子固相扩散、锂离子液相扩散、电解质中锂离子的电迁移、固液界面的电荷转移四个主要物理、化学过程。
P2D模型在模拟电池的外部和内部特性方面的优势得到了国内外研究者的广泛关注,钴酸锂、磷酸铁锂、三元锂离子电池的P2D仿真模型很快被建立起来[5-8]。后续研究者将P2D模型和传热模型耦合起来,建立了电化学-热耦合模型,用来模拟电池工作过程温度的变化[9-10]。除此之外P2D 模型在模拟电池容量衰退、电池安全性分析等方面均有不同程度的应用,这将在本文的第二部分进行详细介绍。
1.2 锂离子电池电化学模型原理

图1 锂离子电池电化学模型原理图(放电过程)Fig.1 Schematic diagram of the electrochemical model of a lithium-ion battery(discharge process)
图1为锂离子电池电化学模型原理。该模型从负极集流体到正极集流体形成一个一维的空间维度,电极是由均匀的球形活性物质颗粒组成的多孔电极,电解质均匀地分布在电极和隔膜中,并且模型假设在充放电过程中电极的体积和孔隙率不发生变化,正负极集流体的电导率无限大。在电池充放的过程中,锂离子嵌入和脱出正负极活性物质颗粒,造成颗粒内部锂离子浓度分布不均匀,由此延伸出一个从活性物质颗粒内部到表面的空间维度,在该维度上只考虑锂离子浓度随时间和空间的变化。除此之外,模型还包含一个时间维度,即电池运行的时间。模型遵循的两大守恒分别是电荷守恒和物料守恒[11]。
模型中在时间维度和空间一维(负极集流体到正极集流体)上一共有3个因变量,分别是固相电势Φs(x,t)、液相电势Φl(x,t)和电解质盐浓度cl(x,t)。在活性物质颗粒上有一个包含延伸维度的因变量固相锂浓度cs(x,r,t)。
1.2.1 电荷守恒
1.2.1.1 固相电荷守恒
在活性物质颗粒中,固相电流is(x,t)大小和固相电势大小符合欧姆定律[12]
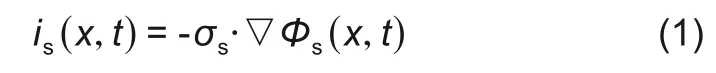
其中σs为固相的电导率。在正极集流体处,电池放电时电流的大小等于外电路电流大小i_app,因此

其中n为单位向量。由于电荷守恒,固相电流的散度表达如下
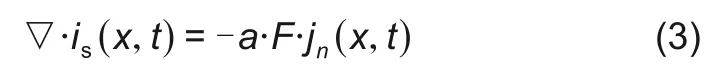
其中a为电极活性面积;jn(x,t)为颗粒表面锂离子的通量;F为法拉第常数。这里当电极脱嵌锂离子的时候jn(x,t)为正,当电极嵌入锂离子的时候该值为负。
1.2.1.2 液相电荷守恒
而在电解质中,液相电流大小除了受到欧姆定律的影响,同时电解质中还存在锂离子的液相扩散、电迁移和对流过程[13]。由于对流造成的影响可以忽略不计,所以电解质中液相电流i1(x,t)的表达式如下

式中,σ1(x,t)为电解液的电导率;R 为气体常数;dlnf/dln[cl(x,t)]是电解质活性相关性系数,它是温度T和电解质盐浓度c1(x,t)的函数;t+(x,t)为锂离子迁移数,为cl(x,t)的函数。
由于电荷守恒电解质中液相电流的散度表达如下

式中,a为电极活性面积;jn(x,t)为颗粒表面锂离子的通量;F为法拉第常数。电极活性面积的计算公式如下

式中,εs为电极体积分数;rp为活性物质颗粒半径。
1.2.2 物质守恒
1.2.2.1 液相物质守恒
在电解质中存在锂离子物质守恒,电解质溶液中存在锂离子的液相扩散和电迁移过程,同时电解质中的副反应也会造成锂离子浓度的变化[4]。其关系由Nernst-Planck方程确定
式中,εe为电解质体积分数;Rl为电解质中存在的副反应产生的锂离子量,电解质中存在的副反应主要来自锂盐和电芯中的痕量水的反应,通常在建模过程中该项取值为零[14]。Nl(x,t)为溶液中锂离子通量,其表达式如下

式中,D1(x,t)为锂离子液相扩散系数,它表征了锂离子在电解液中扩散的容易程度。
1.2.2.2 固相物质守恒
在电池放电的过程中,负极活性物质颗粒表面的活性锂失去电子,进入电解质,导致了负极活性物质颗粒内部活性锂浓度分布不均匀,从而造成活性锂在浓度梯度下的扩散作用,电池的正极活性物质中也存在和该过程方向相反的扩散过程。锂离子在活性物质颗粒中的扩散符合球体中的Fick 第二定律[15]
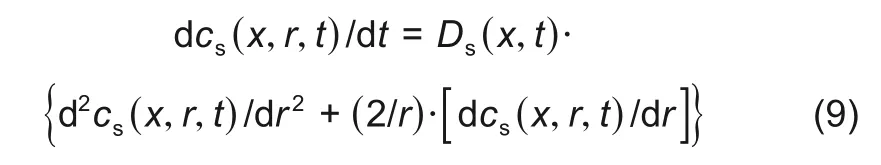
式中,Ds(x,t)为锂离子固相扩散系数,该扩散方程的两个边界条件分别如下所示
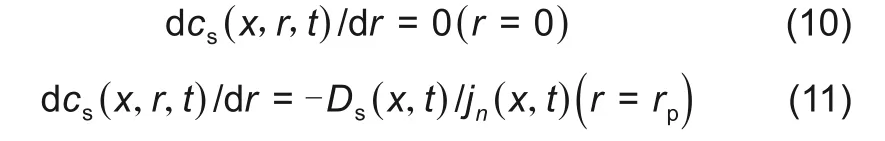
1.2.3 固液界面电荷转移和过电势
电池放电过程中,在负极活性物质颗粒与电解质界面处,存在着活性锂失电子变为锂离子的反应,在正极存在相反的反应过程,界面处发生的电化学反应符合Butler-Volmer方程[4]:
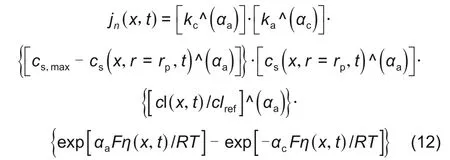
式中,kc、ka、αa、αc分别是阴极反应速率常数、阳极反应速率常数、阳极传递系数、阴极传递系数,cs,max为最大活性锂浓度,η(x,t)为过电位。其表达式为

式中,Eeq(x,t)为平衡电极电位。平衡电极电位是电极SOC和温度的函数。其中电极SOC的表达式如下所示

通过计算上述一系列偏微分方程组和代数方程组就可以求出任意时刻、任意位置处固相电势、固相电流、电解质盐浓度和固相锂浓度的值。通过这四个状态值可以表征电池的外部和内部特性。
1.3 模型关键参数辨识方法
锂离子电池电化学模型是个较为复杂的模型,即使在各方面做了简化,其输入参数仍然多达50余个。除了与电芯设计参数和工况控制参数有关的参数可以从设计文件直接获得以外,有许多电极材料相关的参数需要通过实验方法测量得到。在进行模型仿真的时候,参数辨识的准确性直接影响仿真结果的准确性。本人根据以往的仿真经验,总结了对仿真结果有较大影响的几个模型参数的辨识方法。
1.3.1 平衡电极电位
电池的开路电压Eocv等于正负极平衡电极电位Eeq_pos、Eeq_neg的差值[16]
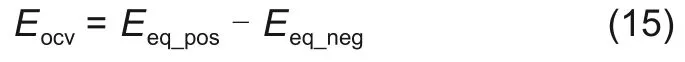
正负极平衡电极电位可由正负极扣电的开路电压表示,如图2 所示为298 K 条件下正极的平衡电极电位曲线,从图中可以看出,正极的平衡电极电位曲线为嵌锂量x(电极SOC)的函数,在电池放电过程中,正极的SOC变化是从图中的x0到xend,正极平衡电极电位的变化则是从Eeq_pos(x0)到Eeq_pos(xend);对于负极而言,其平衡电极电位曲线如图3所示,和正极相同,电池放电过程中负极的SOC变化为从图中的y0到图中的yend,同样的,负极平衡电极电位变化为从Eeq_neg(y0)到Eeq_neg(yend)。

图2 LiFePO4平衡电极电位曲线Fig.2 Balance electrode potential curve of LiFePO4

图3 石墨平衡电极电位Fig.3 Balance electrode potential curve of graphite
1.3.2 最大活性锂浓度和初始浓度
锂离子电池是通过锂离子在正负极材料中的脱嵌和嵌入反应来形成电流的。以常见的磷酸铁锂电池为例,放电时,负极石墨中的锂脱嵌,通过电解质输送到正极,并嵌入正极的FePO4相中;充电时,正极的LiFePO4相脱出锂离子,负极石墨中嵌入锂离子形成LiC6相[17]。对于正极磷酸铁锂来说,其理论容量是170 mA·h/g,然而在实际电芯工作电压窗口内(2.5~3.65 V)无法将磷酸铁锂相中的锂完全脱出,根据本人实际生产过程中电芯设计的经验来看,只有92%的锂能参与充放电循环,这一部分锂被称为活性锂。对于磷酸铁锂电池来说,电芯中循环所需要的锂最初均来自正极磷酸铁锂材料,因此正极材料中的最大活性锂量直接决定了电池的容量。
在进行模型仿真时,一般通过最大活性锂浓度(mol/m3)来表示电极材料中能脱出或嵌入的锂离子量。其计算公式如下所示
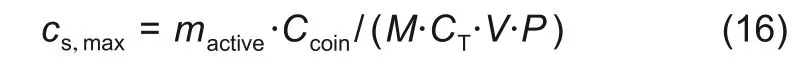
式中,cs,max表示极片中的最大活性锂浓度;mactive为极片中活性物质的质量,g;M 为活性物质的摩尔质量,g/mol;Ccoin为扣电的克容量,mA·h/g;CT为理论克容量,mA·h/g;V为电极活性物质的体积,m3;P为电极孔隙率。
在1.3.1 节中提到的电池平衡电极电位的计算是电化学模型仿真的重要环节,其中最重要的两参数分别是正负极起始的SOC状态,即x0和y0。
众所周知,磷酸铁锂电池在制作时,其负极为石墨材料,电池中的锂都来自正极磷酸铁锂和电解质中的锂盐,在电池制作的化成环节,其中的一部分锂用于形成固体电解质膜(SEI 膜),在电极体积不发生变化的条件下,后续循环不会产生新的SEI膜,活性锂的量理论上不会发生变化,因此在计算正负极初始状态时只需考虑负极化成所需要的锂量[18]。
负极化成所需的锂量的计算式为

式中,cap_formation 为化成消耗的锂量,mol;mactive_neg为负极活性物质质量,g;Mneg为负极活性物质摩尔质量,g/mol;Ccoin_neg为负极材料扣电克容量,mA·h/g;CT_neg为负极材料理论克容量,mA·h/g;θ为负极扣电首效。因此正极初始锂浓度的计算公式为

式中,c0_pos为正极初始锂浓度,mol/m3;cs,max_pos为正极最大活性锂浓度,mol/m3;Ccell_pos为电池设计克容量,mA·h/g;Ccoin_pos为正极扣电容量,mA·h/g;mactive_pos为正极活性物质质量,g;Mpos为正极活性物质摩尔质量,g/mol;Ccoin_pos为正极材料扣电克容量,mA·h/g;CT_pos为正极材料理论克容量,mA·h/g。
负极的初始锂浓度计算公式为

式中,V_neg为负极活性物质体积,m3;P_neg为负极孔隙率。Cremain为上一次放电结束时负极的残留锂浓度。
对于正极来说,其初始SOC满足以下关系式

同理,负极的初始SOC
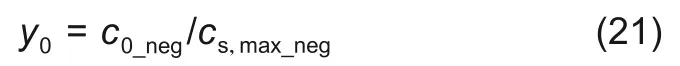
正负极的放电终止状态是由电池放电的截止电压决定的,模型能够自动计算电池放电的终止状态。
1.3.3 锂离子固相扩散系数
在锂离子电池工作过程中,活性物质颗粒内部存在锂离子固相扩散的过程,由此引起电极不同部位浓差过电位的变化,模型采用球形体系的Fick第二定律描述了锂离子固相扩散过程,其中固相扩散系数Ds决定了锂离子扩散的容易程度。
对于该参数的测定,常采用恒电位间歇滴定法(PITT)[19]。图4 给出了一种磷酸铁锂材料固相扩散系数和电极SOC 关系。从图中可以看出,该材料的锂离子固相扩散系数在10-12~10-11m2/s 数量级。图5为一种石墨材料中锂离子固相扩散系数的测量结果,其值在10-12~10-11m2/s数量级。
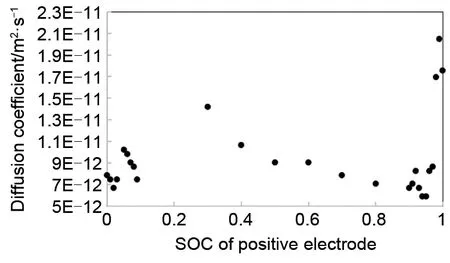
图4 磷酸铁锂材料固相扩散系数Fig.4 Diffusion coefficient of LiFePO4

图5 石墨扩散系数Fig.5 Diffusion coefficient of graphite
1.3.4 温度影响
对于在实际工作中的电池来说,其内部的各种物理化学反应不可避免地会产生热量,同时外部环境温度也会对电池的温度造成影响。而模型输入的部分参数(如平衡电极电位、固相扩散系数等)也受到温度变化的影响,在进行热仿真时,电池温度是实时变化的,这就要求在参数辨识时考虑温度对这些参数的影响。为了解决这个问题,可以引入阿伦尼乌兹方程对参数进行修正[20]。根据阿伦尼乌兹方程,不同温度条件下的参数K,满足以下关系式
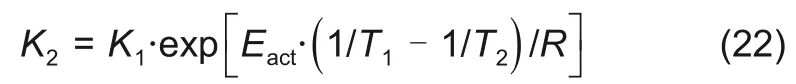
式中,Eact为反应活化能;R 为气体常数;K1、K2为参数在T1、T2温度下的值。
2 锂离子电池电化学模型的仿真应用
2.1 锂离子电池电化学模型在电芯设计方面的应用
一般来说,在进行一款新的电池设计时,需要考虑材料的属性、配方、极片面密度、压实密度、形状等设计因素。而最终成品的电池必须满足容量、电压、循环性能等基本的设计要求。应用锂离子电池电化学模型可以研究不同的正负极材料、配方、极片设计等对电池容量、电压等性能的影响。
图6为一款20 A·h的磷酸铁锂电池的放电曲线仿真结果和实际测试得到的电池放电曲线的对比。图中的点线为实际电池1 C 放电测试得到的曲线,实线为模型仿真得到的该电芯1 C放电的曲线,仿真得到的电池1 C 放电容量偏差小于5%,电压偏差小于20 mV。因此可以通过电化学仿真的方法在电池制作前将电池的放电曲线模拟出来,从而得到电池的容量和电压的变化规律。为电池的正向开发提供理论依据。

图6 20 A·h磷酸铁锂电池放电曲线仿真结果和测试曲线对比Fig.6 Simulation and test value of 20 A·h LiFePO4 cell
电化学模型可以用于计算部分通过常规实验方法难以测量的参数。在实际电池中,由于几何的不同导致边缘效应的不同,电池极片上各部位的电流密度、电位、电解质盐浓度均有不同。由于锂离子电池是个封闭的体系,这些性能参数无法通过常规的实验进行测量,因此可以借助仿真的手段对其进行计算。图7为通过电化学三维极片模型计算的一款20 A·h磷酸铁锂电池在1 C放电进行1800 s时的极片状态(数据为本文作者模型计算结果)。从图7(a)中可以看出靠近正极极耳处电解质电位小于靠近负极极耳处电解质电位;从图7(b)中可以看出隔膜上方的电解质电流密度大于隔膜下方;从图7(c)中可以看出正极集流体靠近极耳处的电位低于极片的其他地方,集流体下方电位高于集流体上方的电位;从图7(d)可以看出靠近极耳处电解质盐浓度高于其他部位,隔膜下方的电解质盐浓度低于隔膜上方的电解质盐浓度。在进行电芯极片设计时,可以通过仿真方法研究不同极片厚度、不同极片尺寸条件下电极各处电位分布以及电流密度分布情况,从而预先进行有效的设计参数优化。除了叠片式电芯可以使用以上模型进行设计优化以外,卷绕式电芯也适用该模型。在未来进行新的电极结构创新时,也可以使用该模型进行理论计算。

图7 放电1800 s时(a)隔膜靠近负极处电解质电位;(b)隔膜靠近负极处电解质电流密度;(c)正极集流体电位;(d)隔膜靠近负极处电解质盐浓度Fig.7 Discharge for 1800 s(a)electrolyte potential near the negative electrode(b)electrolyte current density near the negative electrode(c)current collector potential of the positive electrode(d)electrolyte salt concentration near the negative electrode
电化学仿真模型还可以模拟不同倍率以及温度放电条件下电池的放电曲线。Chen 等[21]用COMSOL 软件的锂离子一维模型模块,模拟了一款商业软包电池(7.8 A·h,3.6 V)常温环境中电池不同倍率放电(1/3、1、4 C)的电压-容量曲线,发现放电速率越低;放电的容量越大;放电电压平台越高。仿真容量相对于测试容量的偏差分别为0.7%、0.2%和7.6%(1/3、1、4 C),说明该模型在模拟电芯低倍率放电条件下的容量的准确性较高;同时模拟了该款电池在不同温度(0、25、35 ℃)下1 C 放电曲线,发现温度越高,电池的放电容量越大,并且仿真值和测试值的偏差分别为1.1%、0.2%和0.02%(0、25、35 ℃),25 ℃和35 ℃下的放电平台相同,均高于0 ℃下的放电平台;除此之外,还通过模型模拟了放电过程中电池不同位置电极活性物质表面和内部锂离子浓度随时间变化的情况,发现负极活性物质表面和内部锂离子浓度的变化小于正极,并且搁置后锂离子浓度恢复速率负极小于正极,说明正极锂离子液相扩散能力小于负极,又因为正负极的电极体积分数差异不大,所以电极厚度是影响液相扩散的主要因素;同时还模拟了不同粒径大小(2、4、8 um)的正极活性材料颗粒对电池放电曲线的影响,发现电池的放电容量与粒径无关,但是粒径越小,电池的放电起始电压越高。
Meyer 等[22]用锂离子电池一维模型研究了三元LiNi1/3Mn1/3Co1/3O2/C6电池在不同放电倍率下,不同插层材料局部SOC 的差异。通过1 C 电流条件下的充放电模拟,发现局部SOC 和插层粒子与隔膜的距离有关,在电池放电初期,氧化还原反应主要发生在隔膜周围的粒子上,这导致了局部SOC 在空间上分布的差异。当放电电流加大到3 C时,局部SOC 的差异变大。该项研究表明,电极内部的电子电位和离子电位导致了一个变化的过电位,从而导致距离隔膜不同距离处的局部SOC 的差异。同时研究表明小颗粒的粒子具有更快的放电速率,并且其局部SOC 的差异较小,过电位较小,因此在靠近隔膜处采用大颗粒的活性物质,在靠近集流体处采用小颗粒的活性物质有利于平衡电池的整体过电位,有助于提升电池的循环性能。
Yang 等[23]基于一款8 A·h 的磷酸铁锂动力电芯建立了锂离子一维仿真模型,研究了该电池的脉冲特性,分析了电池内部参数对内阻的影响。用磷酸铁锂1 C 放电曲线进行模型标定,发现容量偏差<4%,电压偏差小于50 mV。实验研究了35 ℃,不同SOC 条件下,电池在直流脉冲实验下的直流电阻、欧姆电阻和极化电阻,发现欧姆电阻在不同的SOC 下不变,极化电阻和直流电阻随SOC 的增大先减小后增大。同时他们还设计实验研究了SOC=0.5 条件下,不同温度(5、20、35、50 ℃)对直流电阻、欧姆电阻和极化电阻的影响,发现这3种电阻均随温度的升高而降低。通过模型对实验结果进行模拟,发现温度通过影响活性材料的电导率和锂离子固相扩散系数影响电池的电阻,SOC 通过影响锂离子固相扩散系数影响电池的电阻。
2.2 仿真技术在模拟电池实际工况性能方面的应用
在实际应用中,电池并不是遵循完整的充放电循环进行工作的,当汽车根据特定的循环工况行驶时,电池的温度和电压将发生变化,并将受到监控。通常借助某种算法将电池的荷电状态(SOC)通知监控单元,然后确定电池电量已用尽还是充满电等情况。控制单元据此将分别停止放电和停止充电。监测到温度上升也可以触发控制单元。利用模型仿真的方法可以更好地了解循环期间电池性能的变化,提高电池状态估算的精确度。
Nyman等[24]基于一款镍钴铝三元圆柱电池,研究了电池在SOC=40%状态下HPPC循环过程的状态变化,用COMSOL 的电池循环工况监控的接口模拟了该电池在上述SOC 状态下HPPC 循环过程(其中分别研究了EUCAR、ISO-energy test 和FreedomCAR 三种标准)浓差极化、欧姆极化、过电位的变化。首先COMSOL 的电池循环工况监控接口可以较为精准地模拟电池的HPPC循环过程的电压变化(误差在50 mV以内)。然后通过该接口内的锂离子接口可以模拟工况循环过程中电池内部极化的大小。
Wei 等[25]依据热物理规则,采用MATLAB 和GT-suite作为仿真工具,建立了车辆行驶过程中的动力电池热动力学模型。该模型预测大电流放电过程温度变化的准确性高于预测大电流充电过程温度,预测值和真实值的偏差在2 ℃以内。
2.3 仿真技术在电池寿命衰减研究中的应用
电池的循环寿命始终是电池质量好坏的一大评判标准,制作长寿命的电池始终是电池制造商和科研人员不变的研究主题之一。电池循环过程中发生的副反应和退化过程可能导致各种不良效应,造成锂离子电池容量的损失。通常,电池由于不同位置同时发生的多个复杂现象和反应而产生老化,在负载循环中,电池所处的阶段不同,其退化程度是不同的,具体取决于电位、局部浓度、温度以及电流的方向。在循环过程中,电池内部发生的这一系列变化无法直接用实验观测,因此可以借助模型仿真的方法,将可能导致电池容量衰退的原因编辑成可以量化计算的公式,带入到锂离子电池电化学模型中,由此可以通过仿真值和测试值的对比验证容量衰退机理的正确性。
Henrik 等[26]基于SEI 膜的形成机理建立了磷酸铁锂电池容量衰退的模型,该模型考虑了磷酸铁锂电池在循环过程中负极膨胀导致SEI膜破裂,电解液和石墨反应形成新的SEI膜的过程,电池容量的减少由形成SEI 膜消耗的电量计算,形成SEI 膜消耗的电量又由SEI膜形成的反应电流在时间上求积分得到。模型还分别计算了SEI膜完整处和破裂处的电流,从而得到SEI膜形成的反应电流。Henrik等分析了模型中的相关参数,认为在较高的温度下,SEI膜形成反应的交换电流密度增大,电解液中参加成膜反应物质的扩散系数增大,因此在较高温度下,SEI膜更厚。这就是高温下电池容量衰减得更快的原因。
Ning等[27]提出了一种基于广义第一性原理的可充电锂离子电池充放电模型。该模型是基于电化学副反应产生的活性锂损失和阳极膜电阻的上升而建立的。定量分析了放电深度(DOD)、充电结束电压(EOCV)、副反应过电位等参数对循环寿命的影响。以1 C 充电率、0.5 C 放电率、4.0 V EOCV、0.4 DOD 的实验结果验证循环寿命模型。模拟结果与实验结果一致,第1968 次循环容量仿真值和测试值偏差小于2%。模拟电池在多种循环情况下也得到了证明。
Jiang 等[28]基于P2D 模型,结合负极充电过程生成SEI 膜的机理,建立电化学-热耦合容量衰减模型。通过磷酸铁锂电池800次循环容量衰减曲线验证模型的准确性,后续研究了充放电倍率、负极固相体积分数、活性物质颗粒粒径对电池循环性能的影响。发现在1 C循环800次条件,磷酸铁锂电池的SEI膜阻抗增量为15.6 mΩ/m2,电池放电容量减少了6.35%;放电倍率越高,循环容量衰减的速率越快;在1 C循环条件下,负极固相体积分数保持在0.5~0.6区间电池的循环稳定性最高;同时研究发现较大的活性颗粒粒径有利于提高电池的循环稳定性。
2.4 仿真技术在电池产热特性研究中的应用
锂离子电池充放电过程产热导致的温度变化是影响电芯性能的主要环境因素。在实际使用过程中,出于安全性考虑,电池管理系统也必须具有监控电池温度的功能。在电芯设计过程中,可以预先通过热仿真技术预测成品电池的产热特性,优化设计方案。
图8 为第2.1 节中所述的20 A·h 磷酸铁锂电芯1 C 放电结束时表面温度分布的仿真结果。该模型的原理是将锂离子电池一维模型和三维的热模型耦合仿真的结果。模型假设电芯的集群部分为热源,其热量来自电池放电过程产生的化学能,电芯集群和电解液部分简化为一个固体,由一个各向同性的导热系数控制,电池的表面假设处于298 K自然对流状态的空气中,由空气的传热系数控制。从仿真的结果可以看出放电结束时,电芯的温度整体上升了8 ℃,其中电芯中心的温度最高。为了验证模型的准确性,将上述20 A·h电芯充满电后,待温度冷却至25 ℃,置于25 ℃环境的空气中1 C 放电至2.5 V,在电芯表面的中心、四个角落和引出极耳上各设置一个热电偶测量其温度变化。测量结果如图9所示,电芯中心位置的温度最高,引出极耳部分的温度最低,放电结束电芯表面整体温度上升了8 ℃。
Luo 等[29]用COMSOL 仿 真 软 件 模 拟 了 一 款8.5 A·h磷酸铁锂电芯在0.2、0.5和1 C充电条件下温度的变化,通过和设计测试值的对比,发现仿真结果和实际测试值的平均误差均小于0.1 ℃。他们随后又模拟了上述电芯pack形成的48 V/50 A·h模组在0.2、0.5和1 C充电条件下的温度变化,发现发现仿真结果和实际测试值的平均误差均小于0.5 ℃。
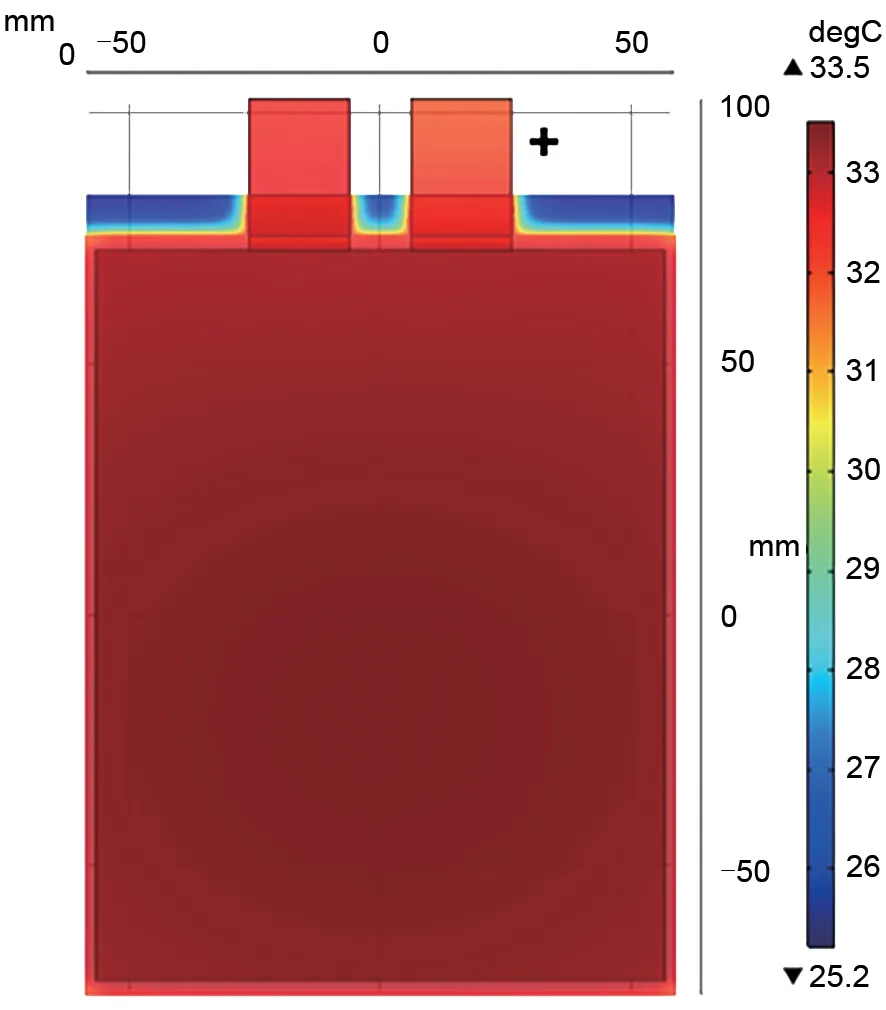
图8 20 A·h磷酸铁锂电池1 C放电结束表面温度分布Fig.8 Surface temperature distribution at the end of 1 C discharge of 20 A·h lithium iron phosphate battery

图9 20 A·h磷酸铁锂电池1 C放电过程表面温度测量结果Fig.9 Surface temperature measurement of 20 A·h lithium iron phosphate battery during 1 C discharge
Sun 等[30]用COMSOL 作为仿真工具,对锂离子电池进行数值模拟分析,得到最优化的电池工作环境。三维热模型将电池视为一个内部没有对流传热的整体,同时忽略了电池内部的热辐射。实验电池为一种圆柱形锂离子电池。模拟了不同环境温度对电池内部温度的影响,仿真结果显示,电芯中心温度高于边缘温度,放电过程中环境温度越高,电池温度越高。环境温度的增加使电池内部电化学反应速率增加,产热增加。同时实验研究了0.5 C 和1 C 放电结束电池内部温度的分布,发现大电流放电导致电池内部温度上升的速率增加。
Tian 等[31]建立了一维电化学-热耦合模型,电化学过程产生的热作为热源导入传热模型中去,传热模型计算出的温度变化反过来又导入电化学模型,对电化学模型中受到温度影响的参数进行修正。文献用不同倍率下电池的放电曲线对模型进行验证。放电倍率越大、误差越大,最大相对误差为6.15%。同时,利用该模型可以方便地计算不同物理化学过程产生的热量随时间的变化,发现电芯产热的主要部位为负极。
Mei 等[32]建立了18.5 A·h 锂离子电池的电化学热耦合模型,并在4 种放电速率下进行了实验验证。在此模型基础上,初步研究了电极设计参数(电极厚度、活性物质体积分数和颗粒尺寸)对电池性能(电化学特性、热行为、能量密度和功率密度)的影响。结果表明,随着活性物质电极厚度和体积分数的增大,极化率、产热率和能量密度增大,功率密度减小。另外,随着颗粒尺寸的减小,能量密度和功率密度都有所提高。
2.5 仿真技术在电池安全性分析中的应用
锂离子电池的安全性是电池使用者最为关心的问题之一,经过合理设计的电池能通过过充、挤压、针刺等安全项测试。利用模型仿真的方法,也可以模拟电池在遭受外部安全威胁时电池状态的变化,从模型中可以深入分析电池遭受危险冲击或者不当使用过程中的失控模式,为电池的安全设计提供理论基础。
Zhao 等[33]使用COMSOL 建立了锂离子电池针刺实验的模型,模型模拟了锂离子电池在中心受到穿刺时电池电压、温度的变化。研究了一款0.65 A·h 的钴酸锂电池在针刺实验时各部分温度变化,发现在穿刺开始阶段,穿刺处温度首先有100 ℃的提升,然后逐渐递减到电池的边缘。在穿刺开始阶段,电芯的温度呈上升趋势。除此之外,文献基于一款5 A·h 钴酸锂电池研究了不同的电极厚度对电池穿刺实验的影响,发现电极厚度小的电池在穿刺后在开始阶段有更快的温升,但是达到最高温度的时间要晚于电极厚度大的电池,电极厚度小的电池的最高温度低于电极厚度大的电池。因此电极厚度小的电池安全性更高。
Qi等[34]基于一款10 A·h的三元锂离子电池建立了过充条件下的锂离子三维电-热耦合模型,模拟了电池发生热失控的临界时间、临界温度以及热分布。模拟结果和实验结果的误差在8%以内。模型研究了电池表面不同位置在2 C过充条件下温度的变化,发现正极极耳附近的热失控温度最大,同时模型研究了不同过充电流下正极极耳附近电池表面温度变化的情况,随着过充电流增加,临界温度的变化趋势变小,热失控开始的时间变早。同时模型模拟了不同电流过充达到临界点时电池表面和内部的温度分布,发现过充电流越大,达到热失控临界点时电池内外温差越大。
Huang等[35]通过热仿真模型研究了三元锂离子电池热失控过程,通过对比不同环境温度(350、400、420、448 K)条件下电池温度的变化,发现当温度为350 K 和400 K 时,电池温度最终趋向于环境温度并且达到稳定值,当温度为420 K和448 K时,电池温度上升到一定值后突然极速上升,发生热失控。
3 结 论
在锂离子电池设计过程中,通过模型仿真的方法可以计算电池的放电曲线和放电容量,减少大量实验过程。目前可以做到1 C放电曲线的容量偏差小于1%,电压偏差小于20 mV,并且可以得到电极上的电流密度和电势分布等通过常规实验无法测量的数据。同时模型可以模拟电池放电过程的热效应,其温度偏差在1 ℃以内。除此之外,电化学仿真技术还可以模拟电池工作状态下的电压、电流,为电池的设计提供理论指导。同时,通过对锂离子电池寿命衰减模型的研究,可以帮助研究人员深入了解锂离子电池的循环失效模式,从而在电池开发阶段进行相应的调整。此外,锂离子电池电化学模型还可以用于模拟电池受到危险冲击条件下电芯的状态变化,从而为提高电芯安全性的设计提供理论基础。
随着锂离子体系完善程度的提升,未来的锂离子电池产品必将向更加标准化的方向发展,从材料到极片、从极片到电芯、从电芯到模组,将形成一个固定的标准体系,通过仿真的方法进行电芯开发将成为主流的开发方式。在此之前,应该先建立起一套普适的、精确的建模方法和参数识别方法,建立一个包含大量电极材料的材料数据库,在进行电池开发时,只需要选择相应的材料以及电芯结构参数,带入模型中便可获得所设计电芯的电化学、热力学工作窗口的预测值,在此基础上再进行模组层面的模型仿真,得到模组的电化学、热力学工作窗口的预测值,然后根据模型仿真的结果以及开发需求选择合适的材料、电芯结构参数便可以快速确定设计方案,在不进行实验的情况下便完成电芯开发任务,使研发成本得到大幅度降低。在未来,除了建立一个完整的电芯材料数据库,还可以建立一个电芯生产过程控制的数据库以及售后电芯实际运行情况的数据库,将这三个数据库结合起来,借助机器学习的方法,分析得到最优化的电芯设计方案,未来的科研人员只需要输入电芯研发的具体需求,系统便自动计算出最优的设计方案。
