普鲁士蓝类似物及其衍生物在钾离子电池中的应用
2021-05-26李敬发
陈 强,李 敏,李敬发
(1南京信息工程大学物理与光电工程学院,江苏 南京210044;2中国科学院光电技术研究所,四川 成都610209;3南京信息工程大学化学与材料学院,江苏 南京210044)
自工业革命以来,人类社会飞速发展,经济条件和生活水平不断提高与改善,但是伴随着社会的不断进步,以煤、石油、天然气为代表的不可再生能源被大量消耗,终将因人类使用而枯竭,并带来一系列的环境污染问题[1-2]。研究者渐渐将目光转向以太阳能、风能、水能为代表的可再生能源,其可再生、无污染的特点,获得广泛关注。然而,受时间、空间等自然因素的影响,可再生能源不能被持续利用,无法克服间歇性的缺陷,但快速发展的社会对能源的需求又是持续性的,这就要求必须开发出高效稳定的能量储存与转换系统,从而调和这一矛盾[3]。如今,常见的储能系统可以被分为以下几类:机械储能、热储能、电磁储能、化学储能。二次离子电池,尤其是碱金属离子电池,作为电化学储能的一种,因其具有较高的能量密度、较好的循环性能和极小的环境污染,被认为是最具前景的储能系统之一[4]。从过去几十年的电池行业来看,锂电池因其比容量高、体积小、重量轻以及环境友好等特点,主导了便携式电子设备市场[5-6]。随着锂离子电池广泛的应用在产品中,价格和需求这一矛盾日渐凸显,而锂在地壳中的含量和分布的不均匀性,更加阻碍了锂在大规模储能系统上的应用。因此,开发高性能、低成本的能量储存系统,在大规模储能方面变得十分迫切。从元素周期表来看,锂、钠、钾同属第一主族,具有相似的物理化学性质,许多化学反应形式相似,更重要的是,相较于锂,钠、钾在地壳中含量丰富[7],成本价格低。但因钠离子标准电极电势较Li+约高0.3 V,钠离子电池的能量密度仍然和锂离子电池有较大差距[8-9],而K+同Li+具有接近的标准电极电势,并且具有更低廉的价格,钾离子电池被认为是具有前途的一类储能体系。
1 钾离子电池
与钠离子电池和锂离子电池体系相同钾离子电池有相似的摇椅式工作原理如图1所示,钾离子在电池内电路充当载流子,充电时,钾离子由正极材料脱出,通过电解液和隔膜嵌入负极材料;放电时过程与之相反,电子在外电路转移为负载提供电能。
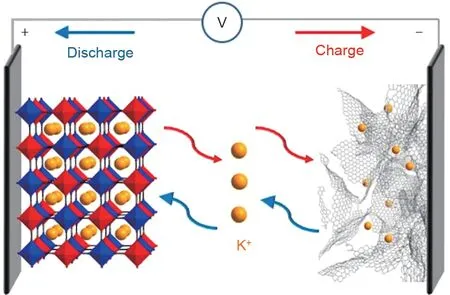
图1 “摇椅式”钾离子电池[10]Fig.1 Schematic illustration of a“rocking-chair”potassium-ion battery[10]
与锂、钠离子电池相比,除了地壳含量丰富之外,钾离子电池还有以下优势:①就电势而言,钾的标准电极电势比钠更低,而且在碳酸丙烯酯(PC)电解液中,钾的电势甚至比锂低[11](表1),故钾在工作电压输出上比锂、钠更胜一筹;②由于锂可以在低电压下与铝形成铝锂合金[12],造成锂的不可逆损失,而钠、钾不会与铝形成铝钠、铝钾合金,这就意味着低成本的铝箔可以代替铜箔作为钠、钾电池的集流器,这样不仅可以降低电池成本,还可以解决过放问题[13];③与Li+、Na+相比,K+的路易斯酸度最弱,所以Stokes 半径最小[14](表1),即溶剂化离子最小,使其在电解液和电解质/电极界面具有最高的离子迁移率和离子导电率[15-16]。此外,较小的去溶剂化能量使得其界面反应阻力低,在电解质中的扩散动力学性能比锂、钠优越[17],Li+、Na+、K+与EC分子形成的溶剂化结构如图2(a)~(c)所示,通过分子动力学模拟研究,钾离子的扩散系数大约是锂离子的3 倍[18],使得在同等条件下钾离子电池会比锂离子电池拥有更好的倍率性能和功率性能;在实验方面,如图2(d)所示,K/K2C6O6电池中K+的扩散系数远远超过同类型的Li/Li2C6O6和Na/Na2C6O6电池[19];④钾离子在嵌入/脱出工业石墨的反应动力学方面高度可逆,这就表明已经发展成熟的高昂的锂离子电池系统可以更加平稳地转移到低成本的钾离子电池系统[15,20]。
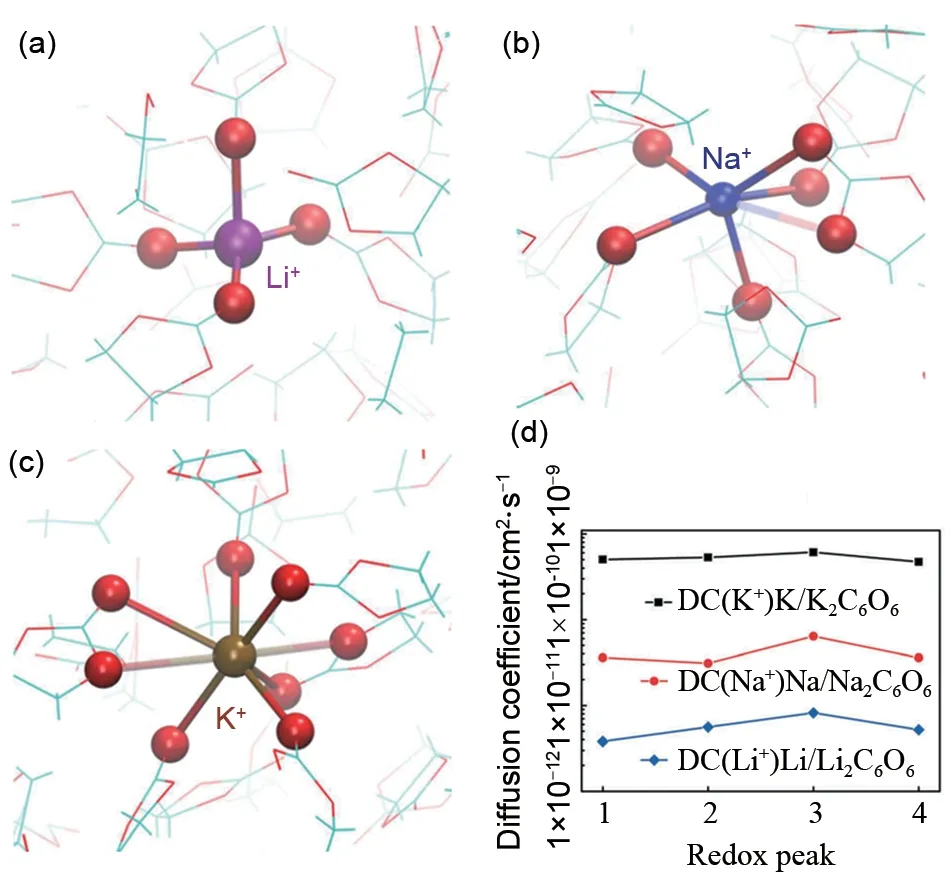
图2 (a)Li+,(b)Na+及(c)K+与EC分子形成的典型溶剂化结构[18];(d)Li/Li2C6O6、Na/Na2C6O6 and 和K/K2C6O6电池扩散系数比较[19]Fig.2 Typical solvation structures of(a)Li+,(b)Na+,and(c)K+in EC[18];(d)comparison of diffusion coefficient of Li/Li2C6O6,Na/Na2C6O6 and K/K2C6O6 batteries[19]
因此,综合金属资源丰富程度、标准电极电势、集流器成本、反应动力学以及工业体系转移难度等因素考虑,钾离子电池在大规模储能方面被认为是强有力的候选者。如今,研究者在钾离子电池方面展开了广泛的研究,开发出先进的电极材料是构建高效经济的钾离子电池系统的关键之一[21-22]。普鲁士蓝类似物因其开放稳定的框架结构而备受研究者青睐,本文从普鲁士蓝类似物出发,详细介绍它及其衍生物作为钾离子电池材料的研究进展并就其未来发展方向做出展望。
2 普鲁士蓝类似物及其衍生物
普鲁士蓝类似物(PBAs),其化学通式为AxMAy[MB(CN)6]z·□m·nH2O(0≤x≤2),A代表Li+、Na+、K+等碱金属离子,MA、MB代表Fe、Ni、Co等过渡金属不同价态的离子,其中,x、y、z取决于MA和MB的价态,□代表空位,m 代表空位数,n 代表水分子数[23],以Fe[Fe(CN)6]和Fe[Fe(CN)6]0.75·□0.25·3.5H2O为例[24],相关晶体结构分别如图3(a)、(b)所示。
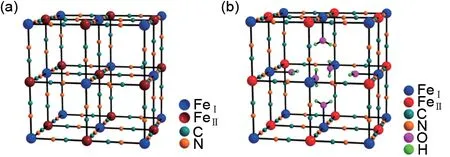
图3 (a)Fe[Fe(CN]6[24]的晶体结构;(b)含缺陷的Fe[Fe(CN)6]0.75·□0.25·3.5H2O[24]的晶体结构Fig.3 (a)crystal structure of Fe[Fe(CN]6][24]and(b)crystal structure of a defect-rich Fe[Fe(CN)6]0.75·□0.25·3.5H2O[24]framework
PBAs 为面心立方结构,空间群为Fm3m,在其晶格中,MA和MB位于顶点位置,由位于棱上的氰基(—C≡N—)按MB—C≡N—MA的形式线性连接,高自旋态的MA与N 配位,低自旋态的MB与C配位,形成MAN6和MBC6金属八面体,MA、MB均位于配合物中心,交替连接形成面心立方结构,拥有开放的三维骨架[25-26];就空位而言,以KFe[Fe(CN)6]和Fe4[Fe(CN)6]3为例,前者含有可溶性K+,后者不含可溶性K+,故为保持结构中的阴阳离子电荷平衡,含有高达25%的晶体缺陷,形式为Fe(CN)6空位[27];水分子的形式有两种,一种是位于空位、与MA配位的配位水,另一种称为沸石水或间隙水,完全或部分占据整个晶胞的8 个可能的8c(1/4,1/4,1/4)位点[28-29],水含量随着合成方案的变化而变化,由于共沉淀反应属于快速反应动力学过程,在合成状态下完全脱水通常很困难[30-31],但在充放电过程中水分子可以起到保持结构稳定的作用[30]。普鲁士蓝类似物的形貌和电化学性质主要与迁移离子、过渡金属、空位和结晶水有关[32-33]。
在理论计算方面,Ling等[34]通过第一性原理进行计算,展现了碱金属离子在普鲁士蓝类似物中的嵌入/脱出过程对材料晶格能的影响,与Li+和Na+的插嵌位点为面心24d 不同,K+的插嵌位点是体心8c,此时体系的能量最低,随着离子半径的增大,嵌入电位也升高,Li+、Na+和K+的电位分别为3.08、3.23、3.70 V(表2),这表明如果采用普鲁士蓝作为钾离子电池正极材料,高的电压能给钾离子电池带来高的能量密度。此外,离子的大小与离子扩散通道的匹配性是决定氧化还原体系性能的关键因素。在脱嵌类材料中,普鲁士蓝类似物及其衍生物的晶格结构与K+较好的匹配度会降低吉布斯自由能,表明该类材料适用于钾离子的嵌入/脱出,且结构不易坍缩;根据研究[35-37],在循环性能方面,普鲁士蓝性能尤为优异,适用于钾离子电池材料研究。
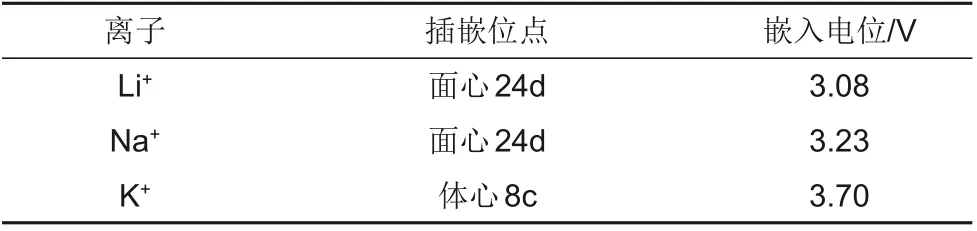
表2 锂、钠、钾离子在普鲁士蓝中的插嵌位点和嵌入电位Table 2 Intercalation sites and intercalation potentials of Li+,Na+and K+in Prussian blue
除此之外,通过XRD和中子衍射技术等试验手段,科学家也对普鲁士蓝储能机理进行详细研究。Keggin 等[38]通过X 射线研究立方晶型的FeFe(CN)6的结构,发现—C≡N—线形官能团可以提供0.5 nm的键长,最早预测该材料具有容纳碱金属离子的能力。科学家[27,39-40]利用X射线和中子衍射技术对体系Fe4[Fe(CN)6]3·nH2O结构进行了研究,发现了它与材料储能能力高度相关的两大特点:首先,有足够大的三维扩散通道,与扩散离子的相互作用较弱,有利于离子嵌入/脱出;其次,可以通过控制合成过程以提高结晶度来降低[MBCN6]4−空位,减少间隙水分子数目,增加嵌入位点,这对于长期循环和高比容量至关重要。过渡金属的种类也对储能有很大影响,当MA=Fe、Mn、Co,MB=Fe 时,晶格中有两个氧化还原活性位点,理论上可实现约155 mA·h/g的比容量;而当掺杂金属MA=Ni、Cu、Zn时,材料仅有一个氧化还原活性位点,能起到支撑开放框架结构的作用,虽然比容量很低,仅为77 mA·h/g,但材料循环性能和倍率性能良好[41]。通过对反应条件(温度、pH、表面活性剂种类和用量)的控制,如图4(a)~(f)所示,可合成一维到三维的多种形貌的目标产物,如棒形[42]、管形[43]、纳米片形[44]、球形[45]、立方体形[46]、多面体形[47];另外,通过对反应物中过渡金属源的控制,部分或全部取代金属种类可获得相应目标类似物[48-49]。

图4 (a)纳米棒形[42];(b)纳米管形[43];(c)纳米片形[44];(d)纳米球形[45];(e)纳米立方体形[46];(f)纳米多面体形[47]Fig.4 (a)nanorods[42];(b)nanotubes;(c)nanoflakes[44];(d)nanospheres [45];(e)nanocubes[46];(f)nanopolyhedrons[47]
综上所述,PBAs 作为钾离子电池正极材料,有如下优点:①独特的开放框架结构提供开放通道,有助于离子快速传导;②双氧化还原反应活性位点为材料提供高容量;③制作工艺简单,成本低,形貌、种类可调控。然而,普鲁士蓝类似物仍面临着导电性和热稳定性较差、电化学窗口范围较窄、充放电过程中与电解液发生副反应等缺点,相关问题的解决方案[50-52]也被科研人员探究。
此外,利用PBAs 作为前体可以制备出不同种类、不同构型的金属氧化物,在电化学能量转换过程中能够高效提高电极的电化学性能,这在锂离子电池负极材料中已经得到验证[53-55]。如图5(a)~(d)所示,除金属氧化物外,PBAs 还被广泛用于制备过渡金属基化合物的衍生物,如硫化物[56]、硒化物[57]、磷化物[58]、硼化物[59],并且PBAs 形貌可控、元素分布均匀的特点,更增加了获得多种形貌衍生物的可能性。
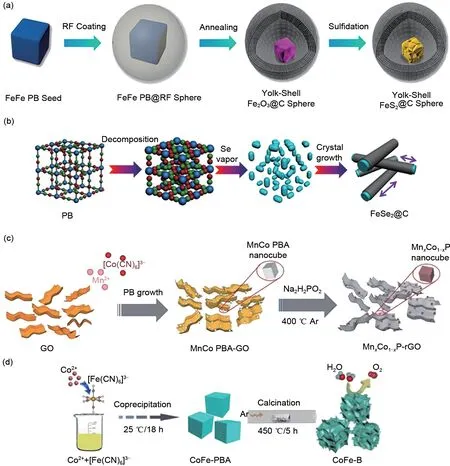
图5 普鲁士蓝衍生物:(a)硫化物[56];(b)硒化物[57];(c)磷化物[58];(d)硼化物[59]合成Fig.5 Prussian blue derivatives:Synthesis diagrams of(a)sulfides [56];(b)selenides[57];(c)phosphates [58];(d)borides[59]
但是,所得纳米材料结构的形貌与煅烧温度、气氛、时间等因素密切相关,Pan等[60]详细总结热分解条件对于以普鲁士蓝作为前体的纳米材料的影响,揭示了控制产物类型及物理化学性质的关键合成因素。除此之外,PBAs还可衍生出如碳化物[61],杂原子掺杂孔状碳[62]材料,其中碳提供了支撑、结构稳定性和更高的电导率,而过渡金属为电化学能量转换和存储过程提供了高度活跃的场所。Nanda等[63]通过简单改变煅烧温度,直接煅烧得到不同碳形貌下的Fe3C。基于溶液的化学相变方法受到关注,由于反应条件避免高温煅烧,且易于控制、调整和大范围应用,因此,液相反应获得所需产物的可能性更大。例如,Lou 等[64]利用化学刻蚀和离子交换的方法,对Ni-Co-PBAs 进行转化,获得了NiS纳米结构,具有开放稳定的结构,高表面积和良好的电化学性能,并对合成过程中的反应动力学进行了详细阐述。
3 普鲁士蓝类似物在正极材料中的应用
3.1 Fe基普鲁士蓝
2004年,Eftekhari[65]采用电化学沉积法合成普鲁士蓝,首次将普鲁士蓝作为钾离子正极材料研究了它在非水系电解液中的性能,发现其具有优良的电化学性能,钾离子电池逐渐进入研究者的视野。其储能机理如下

如 图6(a)所 示,Lei 等[23]报 道 了K0.220FeⅢ[FeⅡ(CN)6]0.805·4.01H2O 作为钾离子正极材料呈现出高的放电平台3.1~3.4 V,在50 mA/g下的电流密度下仍具有73.8 mA·h/g 的循环比容量,衰减速率为0.09%/圈,结合一系列非原位测试(XRD、Raman光谱、XPS),证实反应主要活性位点为C-Fe2+/Fe3+,类型为固溶型反应。如图6(b)所示,Guo等[66]报道工作电压为3.34 V,放电比容量为118.7 mA·h/g,具有极好循环稳定性,超长循环寿命可达1000次,容量保持率为80.49%的KFeⅡ[FeⅢ(CN)6]0.82·2.87H2O,它有两对氧化还原峰分别位于3.47 V/3.17 V 和4.10 V/3.83 V,分别来自于C-Fe2+/Fe3+和N-Fe2+/Fe3+,正因利用不同的氧化还原对,电化学性能才会如此优异。相比于PB、PG,PW因具有高钾含量而有更高的理论容量。如图6(c)所示,Wang等[67]成功制备出高钾离子含量的K2FeⅡ[FeⅡ(CN)6]·2H2O,基于此材料开发了水系钾离子电池,每分子可提供两个储钾活性位点,放电比容量为120 mA·h/g,在高电流倍率(21.4 C)下,工作500圈(每圈约2.8 min可完全充放电)容量保持率高于85%,可提供双电子氧化还原对,且开放的晶体结构可以使钾离子自由穿梭并促进其快速移动。如图6(d)所示,Fu等[68]通过湿化学沉淀法合成FeⅢFeⅢ(CN)6,在电解液(1 mol/L KPF6溶解于EC/DEC溶剂)中以0.5 C充放电可提供124 mA·h/g的高可逆比容量。在5 C下循环500圈比容量为93 mA·h/g,库仑效率为100%。Chen等[69]在高浓度的KCl溶液中合成了K1.92FeⅡ[FeⅡ(CN)6]0.94·0.5H2O在KCIO4/PC电解液中比容量为133 mA·h/g,在0.1 C下循环200圈容量保持率为92.8%。Komaba等[70]采用K1.64Fe[Fe(CN)6]0.89·0.15H2O 作为钾离子正极材料,然而,少量的[Fe(CN)6]空位限制了钾离子的储存,从而降低了材料的电化学性能。

图6 (a)K0.220FeⅢ[FeⅡ(CN)6]0.805·4.01H2O[23]的循环性能曲线;(b)KFeⅡ[FeⅢ(CN)6]0.82·2.87H2O[66]的循环性能曲线及电压稳定性;(c)K2FeⅡ[FeⅡ(CN)6]·2H2O[67]的循环性能曲线;(d)FeⅢFeⅢ(CN)6[68]的循环性能曲线Fig.6 (a)cycling performance of K0.220FeⅢ[FeⅡ(CN)6]0.805·4.01H2O[23],(b)cycling performance and voltage stability of KFeⅡ[FeⅢ(CN)6]0.82·2.87H2O[66],(c)cycling performance of K2FeⅡ[FeⅡ(CN)6]·2H2O[67],(d)cycling performance of FeⅢFeⅢ(CN)6[68]
此外,晶粒的尺寸同样对材料的性能有极大影响。Nazar等[71]通过柠檬酸盐辅助络合沉淀法,制备出纳米、亚微米、微米等不同尺寸的K1.7FeⅡ[FeⅡ(CN)6]0.9,证明了晶粒的尺寸对电化学性能的强烈影响,当晶粒的尺寸为20 nm时,十分接近理论比容量140mA·h/g,在4.0V和3.2V有两个明显的放电平台,在300次循环后容量保持率为65%,库仑效率为98%,能量密度约为500 W·h/kg,可与同类的钠离子材料相媲美,而随着粒径增大,尺寸约160 nm和约1.8 μm的材料,比容量分别为120 mA·h/g和10 mA·h/g,性能大大降低。Padigi等[72]研究了在相同的反应条件下,前体为亚铁氰化钠和铁氰化钠对PB和PG粒子尺寸的影响。他们认为PG的容量比PB高在于PG的颗粒尺寸小,K+在颗粒之间的传输更为迅速。
近年来,利用碳材料对PBAs 进行掺杂形成复合材料,对PBAs的电化学性能提升起到了极大作用。Zarbin 等[73]利用沉淀和电化学方法使FeHCF生长在SWCNT和MWCNT上获得CNT/PB纳米复合物薄膜,SWCNT/PB(比容量为8.3 mA·h/cm3)较MWCNT/PB(比容量为2.7 mA·h/cm3)比容量更高,且表现出更好的可逆性,而MWCNT/PB 则具有更好的循环稳定性。Li 等[74]报道了K4Fe(CN)6/C 复合物具有良好的电化学性能,工作电压约为3.6 V,20 mA/g 下放电比容量为65.5 mA·h/g,十分接近单电子转移的理论储钾比容量72.8 mA·h/g,扩散系数与LiFePO4相当。
3.2 Mn基普鲁士蓝

图7 (a)K1.89Mn[Fe(CN)6]0.92·0.75H2O[75]的恒流充放电曲线;(b)K1.6Mn[Fe(CN)6]0.96·0.27H2O[52]在不同循环圈数下的充放电曲线;(c)K1.75Mn[Fe(CN)6]0.93·0.16H2O和K1.64Fe[Fe(CN)6]0.89·0.15H2O[70]的循环性能曲线Fig.7 (a)typical galvanostatic charge/discharge profile of K1.89Mn[Fe(CN)6]0.92·0.75H2O[75];(b)charge and discharge profile of K1.6Mn[Fe(CN)6]0.96·0.27H2O[52]in different cycles;(c)cycling performance of K1.75Mn[Fe(CN)6]0.93·0.16H2O and K1.64Fe[Fe(CN)6]0.89·0.15H2O[70]
相对于铁基普鲁士蓝,锰基普鲁士蓝的放电电位更高,从而可获得更高的能量密度。如图7(a)所示,Goodenough等[75]合成K1.89Mn[Fe(CN)6]0.92·0.75H2O,在0.2 C下比容量为142 mA·h/g,该值十分接近理论比容量,由于Fe2+/Fe3+和Mn2+/Mn3+两对氧化还原反应对相互作用、相互影响,两者的平台都十分接近3.6 V。如图7(b)所示,Lee 等[52]报道K1.6Mn[Fe(CN)6]0.96·0.27H2O 在KFSI 溶于PC/FEC 电解液中具有115 mA·h/g 的放电比容量,两平台分别位于3.9 V和4.1 V,同时,该试验还表明通过加入氟代碳酸乙烯酯(FEC)可以抑制材料与电解质之间的副反应,减少了电极材料分解,从而提高了材料性能。如图7(c)所示,Komaba 等[70]采用K1.75Mn[Fe(CN)6]0.93·0.16H2O 作为钾离子正极材料,在采用KPF6溶于EC/DEC 溶剂作为电解液时,K1.75Mn[Fe(CN)6]0.93·0.16H2O 的工作电压为3.8 V,比容量为141 mA·h/g 与LiCoO2在锂离子电池中的能量密度相当,性能在同类材料(Fe、Co、Ni、Cu)中最为优异,同时结合原位XRD 图谱详细分析了材料的嵌钾反应机理,在充电过程中,单斜相由于MnN6和FeC6八面体在晶胞中重新排列转变为立方相,之后由于高自旋的Mn3+的Jahn-Teller 效应继续转变为四方相,在放电过程中两种结构相变均可逆进行,由此实现高度可逆的钾离子的插嵌。最近,Yang 等[76]基于螯合作用在Mn-Fe 普鲁士蓝类似物(Na1.8Mn[Fe(CN)6]0.88[Fe(CN)6]0.12·2.65H2O) 中 引 入Mn 空位抑制材料的Jahn-Teller 畸变,并在钠离子电池中表现出优异的储钠性能,这为普鲁士蓝类似物改性提供了新思路。对于K1.64Fe[Fe(CN)6]0.89·0.15H2O,其性能与K1.7FeⅡ[FeⅡ(CN)6]0.9[71]和K1.68FeⅡ1.09FeⅡ(CN)6·2.1H2O[48]相比无太大差别,3种材料的放电平台都在4.0~3.2 V,比容量大约为110 mA·h/g。
3.3 其他金属基与部分取代普鲁士蓝
同时,其他不同过渡金属源和部分金属取代的材料的电化学性能也被研究。Cui 等[77-79]合成K0.6Ni1.2Fe(CN)6·3.6H2O,在水系电解液(以HNO3调节pH=2的1 mol/L KNO3)中,以8.3 C循环1000圈无容量损失,其后以1.75%/1000 圈开始衰减;随即K0.71Cu[Fe(CN)6]0.72·3.7H2O 也 在 电 解 液(1 mol/L KNO3∶0.01 mol/L HNO3)中被研究;其后将其作为正极极材料,活性炭/聚吡咯复合物作为负极材料组装全电池,在5 C/50 C 下的能量效率分别为95%/79%,10 C下深度充放电1000次几乎无容量损失,库仑效率高达99.9%。如图8(a)~(d)所示,Ji 等[48]报道了多种普鲁士蓝类似物:KxMFe(CN)6·mH2O(M=Fe、Co、Ni、Cu)作为钾离子正极材料,其中,K1.68FeⅡ1.09FeⅡ(CN)6·2.1H2O 有明显的两个放电平台,而Ni、Cu 仅有一个,在同类的钠离子正极材料Na2CoFe(CN)6[80]中接近120 mA·h/g,有明显的两电子转移特性的K1.55Co0.88Fe(CN)6·3.2H2O作为钾离子正极材料时,平台仅有一个,且放电容量仅为一半,作者认为这是由于Na+和K+的电负性不同造成的,具体是因电负性使得氰基电子云偏离,Co3+/Co2+较难被氧化,故容量有限。近期,如图8(e)~(f)所示,Hu等[51]采用Fe取代部分Mn的富锰钾基普鲁士蓝KxFeyMn1−y[Fe(CN)6]w·zH2O 为正极、有机染料为负极,成功构建了一款水系钾离子全电池。研究表明,该水系钾离子全电池可以在0~2.6 V电压区间内运行,其能量密度可达80 W·h/kg,寿命可达2000次以上,容量保持率为73%,这归功于Fe取代部分Mn 抑制了充放电过程中的Jahn-Teller 畸变,从而提高了材料的循环稳定性,理论计算表明,Fe取代部分Mn可以降低正极的能带带隙和钾离子的扩散活化能,从而提高了正极材料的电子和离子电导,使得材料具有更高的倍率性能。Ghasemi 等[81]通过电泳沉积、电化学还原等合成手段,采用碳材料对物质进行改性,合成Ni-Fe-HCF/ERGO 纳米复合物,在0.5 A/g 下为67.77 mA·h/g,超过单一的Ni-Fe-HCF(44.72 mA·h/g)和ERGO(32.5 mA·h/g),同时也比同类的Ni-HCF/ERGO(44.58 mA·h/g)和Fe-HCF/ERGO(44.72 mA·h/g)高。
综上所述,为了获得高能量密度的钾离子电池,在普鲁士蓝正极材料方面,可从富钾材料、过渡金属种类、构筑空位、晶粒尺寸及材料掺杂包覆改性等方面考虑。
4 普鲁士蓝类似物及其衍生物在负极材料中的应用
单一的PBAs 不仅在锂、钠离子电池中作负极材料被研究[82],而且可以作为钾离子电池负极材料。Guo 等[83]制备了一种典型的普鲁士蓝类似物Co3[Co(CN)6]2,首次研究了PBAs 作为钾离子电池负极材料的性能。在0.05~2.0 V(vs. K+/K)的电压范围内,所制备的Co3[Co(CN)6]2具有324.5 mA·h/g的可逆储钾比容量,并且表现出了良好的倍率性能及循环稳定性,其恒定电流充放电过程中的库仑效率高达99.5%,这些性质使得该材料有可能成为钾离子电池的负极材料,基于一系列表征手段,发现Co3[Co(CN)6]2储钾的机理涉及到K+在活性物质中的扩散,在此过程中,与碳和氮配位的钴均表现出电化学活性。

图8 KxMFe(CN)6·mH2O [48]的充放电曲线:(a)FeFe-PW,(b)CoFe-PW,(c)NiFe-PW,和(d)CuFe-PW;(e)KxFeyMn1−y[Fe(CN)6]w·zH2O[51]作为全电池的充放电曲线;(f)KxFeyMn1−y[Fe(CN)6]w·zH2O[51]作为全电池的循环性能曲线Fig.8 Charge/discharge potential profiles of Prussian white electrodes[48]:(a)FeFe-PW,(b)CoFe-PW,(c)NiFe-PW,and(d)CuFe-PW,(e)charge-discharge curves of KxFeyMn1−y[Fe(CN)6]w·zH2O[51]as full battery,(f)cycling performance curves of of KxFeyMn1−y[Fe(CN)6]w·zH2O[51]as full battery
PBAs 还被广泛用于制备过渡金属基化合物的衍生物,并且已经在锂[53-55,84]、钠[57,85]离子电池中得到广泛应用。PBAs中的氰基(CN−)在煅烧过程中可以转化为氮掺杂的碳[86-88],可有效促进表面控制电荷储存与提高电极材料的导电性。如图9(a)所示,Xu等[89]通过磷化PBAs的前体得到了双壳层规则结构的双金属磷化物(Ni-Fe-P/NC),首次将其应用于钾离子电池中,所得材料显示出了较好的电化学性能,将其用作钾离子二次电池的负极材料时,在500 mA/g的高电流密度下,经过1600周循环后其放电比容量可维持在约172.9 mA·h/g,对应于每周循环容量的衰减率为0.026%。

图9 (a)Ni-Fe-P/NC[89]的循环性能曲线;(b)FeS2@C、FeS2-0及FeS2-PB[90]的循环性能曲线;(c)FeS2@RGO[91]的循环性能曲线;(d)3DG/FeP及FeP[92]的循环性能曲线Fig.9 (a)cycling performance of Ni-Fe-P/NC[89],(b)cycling performance of FeS2@C,FeS2-0 and FeS2-PB [90],(c)cycling performance and FeS2@RGO[91],(d)cycling performance of 3DG/FeP and FeP[92]
采用不同的非金属源,对材料进行相应的非金属化,同时采用相关碳基材料(C、GO、CNT)进行掺杂形成复合材料,对材料性能有极大改善。如图9(b)所示,Xu等[90]采用普通的普鲁士蓝作为前体,通过多步煅烧工艺进行碳包覆、蚀刻和硫化,成功制备了FeS2@C复合材料和普通的FeS2-0及FeS2-PB相比,材料的循环稳定性得到明显增强。该材料具有独特的三维立方体外部结构,且又是疏松的纳米颗粒碳,碳层增强材料导电性,为体积膨胀提供了缓冲空间,从而起到了限制作用,纳米颗粒在核壳内部有利于电解液浸润和K+迁移。如图9(c)所示,Mai 等[91]首次利用RGO 包覆PB 后进一步硫化衍生出FeS2空心纳米笼,具有三维中空纳米结构,由于FeS2和RGO的协同作用,材料在循环性能方面有了极大的改善。Wang 等[93]通过简单的化学沉淀和一步碳化-硒化法制备多孔Mn-Fe-Se和交错碳纳米管,并成功制备出多孔Mn-Fe-Se/CNT 复合材料。利用交错碳纳米管的导电性和多孔Mn-Fe-Se的缓冲空间的协同作用,复合材料具有显著的电化学性能,具备良好的钾钠离子储存能力,具有较高的循环性性能和倍率性能,较单一Mn-Fe-Se 的性能有了极大的改善。
此外,科研人员对新颖的合成方法进行了探究。如图9(d)所示,Zhang 等[92]开发了一种新型的空间约束热转化策略,以GO/PB复合材料为前体,经还原和自组装后,以NaH2PO2为磷源,成功构建了以FeP 空心纳米球为基础的3DG/FeP,0.1 A/g下可逆比容量为323 mA·h/g,较单一的FeP而言,循环性能及比容量有了明显提升,2 A/g 下可逆比容量为127 mA·h/g,且循环2000 圈后容量保持率为97.6%,在目前已知材料中,倍率性能最佳。由此可知,在普鲁士蓝类负极材料方面,可从过渡金属协同效应、形貌设计、掺杂包覆改性及合成方法等方面考虑。
与传统的碳负极材料相比,普鲁士蓝类似物及其衍生物作为新兴的钾离子电池负极材料,以过渡金属硫化物、磷化物、硒化物为主,是一个十分庞大的体系,两者相比互有优劣。主要优势在于普鲁士蓝类似物及其衍生物在电化学反应中会发生多电子转移[83,90,92],因而具有极高的理论比容量,虽然碳材料可以作为钾离子电池的负极,但其理论比容量有限,以石墨为例,理论比容量仅为279 mA·h/g,故限制了碳材料在钾离子电池负极材料中的应用;在反应过程中,普鲁士蓝类似物及其衍生物由于在反应过程中产生较大的体积变化而导致材料颗粒粉化、脱落[90,92],造成材料循环稳定性极差,而碳材料在充放电循环过程中的体积变化较小,故可表现出良好的循环稳定性[20]。将两种材料的优势相结合的碳限域法则派生出良好的负极材料,未来可继续朝着这一方向研究探索。
5 总结与展望
普鲁士蓝类似物及其衍生物作为一个庞大的体系,具有独特的开放框架结构,其形貌易于调控并可与非金属反应生成对应衍生物,已经作为正负极材料在钾离子电池中得到了广泛的应用。目前,普鲁士蓝类似物及其衍生物的制备工艺日趋成熟,未来将朝着简化工艺步骤,材料掺杂改性,衍生材料探究等方向发展。随着量子点[94-96]和MXene[97-99]等低维材料储钾形式的兴起,现就材料应用方面做出展望:①对材料本身而言,可通过调控水分子含量、颗粒形貌与尺寸得到最佳产物;②作为正极材料,可采取部分取代的方法,探究金属离子协同效应机理,以获得性能优异的材料;③对负极材料,可采取非金属化、构筑异质结构、量子点掺杂和MXene 包覆等改性方法,提升纯相物质的性能。除此之外,普鲁士蓝类似物及其衍生物的发展极有可能带动电解液、导电剂和黏结剂的发展,增大其自身的应用前景,最后派生出一套良好的储能系统。总之,通过科研人员的不懈努力,不断探究材料的合成及改性方法和提高材料的电化学性能,必将增强普鲁士蓝类似物及其衍生物在储能领域中的应用。
