阜新地区肉及肉制品中产气荚膜梭菌的分离鉴定及药敏试验
2021-05-25蔡楠楠夏红杜波任妍妍修敏刘文新张眉眉
蔡楠楠 夏红 杜波 任妍妍 修敏 刘文新 张眉眉
(1.阜新市疾病预防控制中心 辽宁阜新 123000;2.辽宁省疾病预防控制中心)
1 前言
产气荚膜梭菌又称魏氏梭菌, 是一种条件致病菌,是人兽共患病原菌,严重威胁动物及人类公共卫生安全[1-2]。 产气荚膜梭菌镜下,观察革兰氏染色呈紫色,形态为粗短芽孢杆菌,在微需氧或者厌氧条件下生长良好。 在自然环境中以及人和动物胃肠道中广泛存在。该菌较容易导致人类食物中毒、伤口处的创伤性坏疽以及禽类和牲畜类的坏死性肠炎。 该菌所产生的毒素至少有15 种以上,目前根据主要的致死性毒素 α、β、ε 和 t 将产气荚膜梭菌分为 A,B,C,D,E 这 5 种类型[3]。 其中 A 型是主要对人致病的类型,C 型占少数。 致病因素主要与肠毒素(CPE 和β2毒素)有关。 其中A 型产气荚膜梭菌引起的食物中毒在美国等西方国家居前三[3]。 在我国,对生禽肉、牲畜肉及相应肉类制品的需求量很大, 但对这些肉及肉制品的加工处理过程不当, 均有可能造成产气荚膜梭菌感染。
对2018~2020 年食品风险监测项目,阜新地区的肉及肉制品中所获得的产气荚膜梭阳性菌株进行典型生化特性试验、毛细管电泳分型、进化树分析和耐药性分析, 了解当地肉及肉制品感染的产气荚膜梭的主要分型和耐药情况, 为由产气荚膜梭菌引起的人类食物中毒及动物的坏死性肠炎的诊断和防治提供理论和实践基础。
2 材料与方法
2.1 材料
样品采集于2018~2020 年阜新市五区两县(细河区、海州区、太平区、清河门区、新邱区、阜蒙县和彰武县)各大农贸市场肉及肉制品摊位,按分层随机采样原则采集74 份鲜肉及鲜肉制品, 其中鲜鸡肉16 份,鲜牛肉 12 份,鲜猪肉 12 份,鲜羊肉 12 份,预包装鸡肉制品10 份,调理肉制品12 份,每份样品至少采集500 g,4 h 内送至实验室进行检测。
2.2 标准菌株来源
参考菌株:产气荚膜梭菌A 型(ATCC13124)由省疾病预防控制中心食品所保存, 产气荚膜梭菌B型(NCTC13110)、产气荚膜梭 C 型(NCTC8081)等由阜新市卫生健康服务中心保存。对照菌株:金黄色葡萄球菌ATCC29213、 大肠埃希氏菌ATCC25922,蜡样芽孢杆菌CMCC (B)63301 等由阜新市卫生健康服务中心保存。 生化鉴定、毛细管电泳分型鉴定,作为质控,均同时进行相应标准菌株。
2.3 仪器与试剂
智能气体工作站MARKⅡ,毛细管电泳仪(QIAGEN公司),测序结果来源于QIAGEN 公司,耐药试剂来自杭州微生物试剂有限公司。NA 颗粒、TSC、含铁牛乳等培养基均来源于青岛海博生物技术有限公司;Ex Ta8 DNA 聚合酶为宝生物有限公司产品;PCR引物、探针委托Invitrogen 公司合成。
2.4 细菌分离与鉴定
细菌的分离取样品25 g 放入225 ml 0.1%蛋白胨水中进行稀释,吸取稀释液1 ml 加入平皿,将稀释液加入9 ml 生理盐水, 以此类推做2~3 个稀释度。加TSC 培养基后摇匀,36℃厌氧培养20 h。按照《2018~2020 年国家食品污染物和有害因素风险监测工作手册》产气荚膜梭菌标准检测程序,挑取相应黑色菌落接种于血平皿,36℃厌氧培养20 h,选取出具有双层溶血环的菌落接种FTG 培养基,36℃厌氧培养20 h。
生化鉴定参照 《2018~2020 年国家食品污染物和有害因素风险监测工作手册》 产气荚膜梭菌标准检测程序及标准生化试剂盒说明书, 主要有牛奶发酵试验、硝酸盐动力试验及乳糖明胶试验。
2.5 基因分型
2.5.1 基因组DNA 提取
用接种环刮取1/4 血平皿上培养物加入硕世提取试剂盒,制成混悬液。按照试剂盒说明书进行提取。
2.5.2 引物设计与合成
参考文献[4]合成 6 对引物(见表1):cpa、cpb、etx、iA、cpe、cpb2,分别扩增产气荚膜梭菌 α、β、ε、ι、β2 和 CPE 毒素。

表1 扩增产气荚膜梭菌的六种毒素基因的引物序列
2.5.3 PCR 分型
按照表1 引物序列扩增相应毒素基因。 多重PCR 反应总体系为 25 μl,ta8 酶 Mix2 μl,上下游引物各 1 μl(10 μmol/L),无 RNA 酶水 19 μl,模板 DNA2 μl[5]。 PCR 反应程序:94℃ 10 min,94℃ 30 s,56℃30 s,72℃ 1 min 30 个循环;72℃延伸 10 min,4℃保存[5]。用毛细管凝胶电泳分析观察PCR 产物的结果。
α 毒素基因与 16SrRNA 基因分析。 将 PCR 产物送Invitrogen 有限公司进行测序。 用DNAStar 软件对分离株和参考株序列进行α 毒素基因同源性分析;用MegAlign 软件构建16S rRNA 基因系统发育树,进行遗传进化分析[6,9]。
2.6 药敏试验
研究依据纸片扩散法[7-8]进行药敏试验。 药敏纸片分别为红霉素、多西四环素、青霉素、卡那霉素、庆大霉素、头孢氨苄、头孢曲松、头孢呋辛、米诺环素、氨苄西林、丁胺卡那、哌拉西林[9]。 将22 株菌株接种于鲜血琼脂平皿,36℃恒温厌氧培养18 h。刮取鲜血琼脂平皿上适量菌落, 用生理盐水稀释至0.5 麦氏比浊标准,吸取0.2 mL 菌悬液,放置于营养琼脂平皿,L 棒将菌液均匀放置于整个平皿。用经过高压灭菌的镊子将药敏纸片贴于平皿中的培养基表面,每个平皿贴四张,调整纸片间距离,使间距至少为24 mm。 纸片中心与平皿边缘的距离应至少为15 mm,菌落涂布后15 min 内将贴完纸片。 翻转平皿,37℃恒温厌氧培养24 h。游标卡尺测量抑菌圈直径。抑菌圈直径<10 mm 为耐药 (R),10~15 mm 为中度敏感(I),>15 mm 为高度敏感(S),>20 mm 极敏感。
3 结果
3.1 产气荚膜梭菌的分离与鉴定
3.1.1 病原的分离
分离的菌株在TSC 上呈黑色,带晕环或不带晕环, 在鲜血琼脂平皿上成圆形或菌落边缘呈锯齿状或放射状、光滑、灰白色、中等或偏大,厌氧培养18 h内层呈清晰狭小的透明溶血环、外层不完全溶血。
3.1.2 生化试验
在共计74 份肉及肉制品样品中分离出22 株产气荚膜梭菌。 其中 2018 年 6 株,2019 年 9 株,2020年7 株。 按照各种微量生化发酵管说明书对分离株和A 型标准菌株的纯培养进行生化试验。 牛奶发酵试验有很明显的发酵现象,产酸产气,发酵乳糖,液化明胶,能将硝酸盐还原为亚硝酸盐,动力阴性,上述特点符合产气荚膜梭菌的生长特性。
3.2 基因分型
通过常规细菌分离和系列生化鉴定试验, 分离出的22 株产气荚膜梭菌, 均扩增出A 型产气荚膜梭特异的324 bp 条带,与预期扩增出的cpa 基因片段大小一致。 未扩增出 cpb、etx 和 iA、cpe 基因的特异性条带,表明22 株产气荚膜梭菌均为A 型,未发现其他菌型(B、C、D、E)。进一步扩增 β2毒素基因和CPE 基因, 发现 3 种基因型分别为:β2毒素阴性、CPE 阴性的 A 型产气荚膜梭菌;β2毒素阳性、CPE阴性的A 型产气荚膜梭菌;β2毒素阳性、CPE 阳性的A 型产气荚膜梭菌; 未检测出β2毒素阴性、CPE阳性的A 型产气荚膜梭菌。

表2 不同肉及肉制品中产气荚膜梭菌的分离与鉴定
3.3 α 毒素同源性分析
对22 株分离株α 毒素基因序列分析显示, 分离株 C.perfringen 201901、C.perfringen 201902、C.perfringen 201905、C.perfringen 202004、C.perfringen 202006 之间以及 C.perfringen 201801、C.perfringen 201804 之间α 毒素基因序列同源性较高,同源性为100%, 而分离株 C.perfringen 201805、C.perfringen 201907 之间α 毒素基因序列同源性最低,同源性为93.6%。
3.4 16S rRNA 基因分析
16S rRNA 基因系统进化树显示,22 株分离株中存在一个大簇, 本簇中, 除C.perfringen 202007和 C.perfringen 201903 这 2 株外, 均为 2018 年的分离株,而且分离株C.perfringen 201805 与标准菌株C.perfringen ATCC 13124 亲缘关系最近, 基因离散率为0.786%。2019 年的2 株分离株C.perfringen 201906 和C.perfringen 201907 在进化树中呈单独一个分支,平均基因离散率为4.373%。
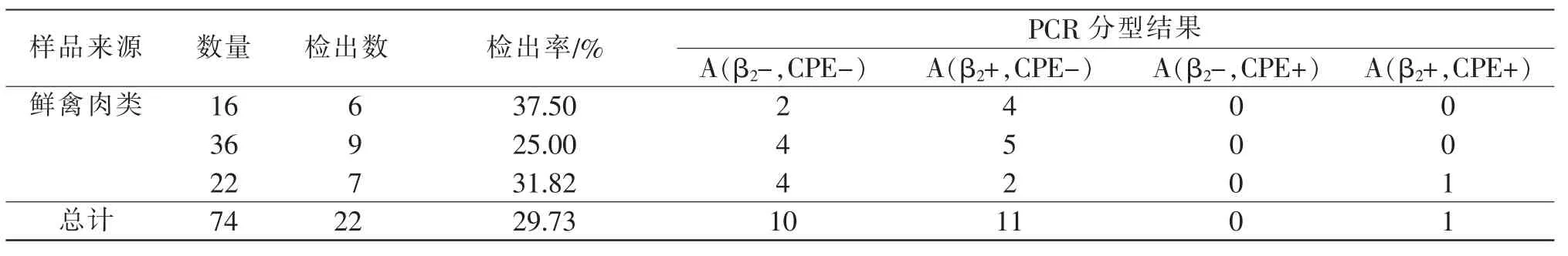
表3 22 株产气荚膜梭菌毒素分型结果

图1 22 株产气荚膜梭菌16S rRNA 基因系统进化树
3.5 药敏试验
共22 株的药敏试验结果表明, 所有菌株对多西四环素敏感,敏感率为100%;对卡那霉素、庆大霉素耐药,耐药率为100%;对头孢氨苄、米诺环素、多西四环素的敏感率均达到了90%以上。 在对22株菌落耐药实验的过程中,发现202001 和202004对头孢曲松、头孢呋辛、氨苄西林和哌拉西林出现抑菌环上又重新覆盖菌落的情况。耐药情况详见表4。

表4 22 株肉及肉制品中产气荚膜梭的耐药性检测结果
4 讨论
产气荚膜梭菌(C.perfringens)是人兽共患病原菌,能对人和多种动物致病。产气荚膜梭菌除患病动物体内感染外,在宰杀、储藏、配送等环节中对肉及肉制品的不当操作中,也很容易造成外在感染[10-11]。
产气荚膜梭菌的生长需要特殊的厌氧条件和设备,加上特殊的采样方式、专用的培养基和鉴定试剂等,一般的实验室难以开展对该菌的研究,因此对该菌及其在食物中毒产生的不良影响缺少认识[12]。 虽然国外有厌氧菌引起食物中毒的相关报道, 但系统的研究肉及肉制品产气荚膜梭的感染情况及与食物中毒关系在国内鲜见报道,在本地区更是空白[13]。在社会对食品安全问题日渐重视的今天, 对食品中厌氧菌的危险性应该进行评估。 本次研究对肉及肉制品中产气荚膜梭菌感染情况进行分析, 初步了解了食品中产气荚膜梭菌的污染情况、 菌型分布和耐药情况。
阜新地区各农贸市场出售的肉及肉制品中存在产气荚膜梭菌污染,本研究从74 份肉及肉制品中分离出的22 株产气荚膜梭菌。分离到的产气荚膜梭菌均为A 型产气荚膜梭菌,没有发现该菌的其它菌型(B、C、D、E),这与相关报道一致[14]。 其中以鲜禽肉(鲜鸡肉) 中带菌率最高。 仅携带β2毒素基因的为11 株, 并检出一株同时携带β2基因和CPE 基因的产气荚膜梭菌。本研究利用生化鉴定,结合毛细管电泳对产气荚膜梭菌分离株进行基因分型具有快速简便等优点, 采用纸片法对22 株细菌进行耐药实验。这为开展产气荚膜梭菌相关流行病学研究以及对不同型产气荚膜梭菌引起的不同疾病的快速大规模诊断提供了实用手段[15,16]。
本研究在一定程度上对产气荚膜梭菌的毒素分型,进化树分析,分子生物学上进行了研究,同时也为进一步核糖体基因分型(Ribotyping)、脉冲场凝胶电泳(PFGE)等分子分型和调查本地区厌氧菌在食物中毒产生的影响以及与食源性疾病的关系奠定了研究基础。
本研究显示, 分离株 C.perfringen 201901、C.perfringen 201902、C.perfringen 201905、C.perfringen 202004、C.perfringen 202006 之间以及 C.perfringen 201801、C.perfringen 201804 之间 α 毒素基因序列同源性为100%, 而分离株C.perfringen 201805、C.perfringen 201907 之间α 毒素基因序列同源性为93.6%。 22 株分离株中存在1 个大簇,除C.perfringen 202007 和 C.perfringen 201903 这 2 株外,均为2018 年的分离株,而且分离株C.perfringen 201805与标准菌株C.perfringen ATCC 13124 亲缘关系最近。
研究表明在对2018~2020 年肉及肉制品中分离出的22 株产气荚膜梭菌对卡那霉素、庆大霉素完全耐药,原因可能与该地区禽类、牲畜肉饲养过程中长期使用这些药有关。2020 年分离出的菌株202001和202004 对头孢曲松、头孢呋辛、氨苄西林和哌拉西林这几种药出现了抑菌环中重新生长出大片菌落的现象,随着这几类药物的长期使用,产生了耐药突变株。 分离出的菌株对多西四环素的敏感率达到100%,对头孢氨苄和米诺环素的敏感率也达到90%以上。如果发生感染,早期使用这3 种药物会有很好的效果, 提倡在临床用药前进行药敏试验以达到有的放矢的效果。
本次研究结果表明, 在阜新地区农贸市场出售的肉与肉制品中存在产气荚膜梭菌和可以导致人食物中毒的肠毒素阳性A 型产气荚膜梭菌污染。 这是食品安全中的一个隐患。 该菌作为一种重要的致人腹泻和伤口感染的病原菌,污染情况应引起重视。为有效预防该菌致病事件出现, 市场部门和卫生部门应加强监管, 对可能引起污染的环节制定相应的预防措施。应加强食品安全的宣传,指导群众在处理肉及肉制品过程中要注意生熟分开,勤洗手,避免带伤操作。
