妊娠期糖尿病并发脂代谢紊乱的危险因素
2021-05-25金鑫,吴艳
金 鑫,吴 艳
(合肥市第三人民医院妇产科,合肥 230000)
妊娠期糖尿病(gestational diabetes mellitus,GDM)是妊娠期常见的并发症,其发病率逐年增加,目前全球范围内GDM的发病率约为1% ~14%,我国发病率约为1.7% ~16.7%[1]。据调查[2],GDM患者的脂代谢紊乱发生风险高,对母儿的危害严重,产后转归难度大,需引起高度重视,尤其是在伴有肥胖症的患者中,其发生率更高,危害更为严重。研究指出[3],GDM患者一旦并发脂代谢紊乱,巨大儿、胎儿糖脂代谢紊乱、先兆子痫和子痫的发生风险均升高,因此需积极探讨其危险因素并加强防控。既往关于妊娠期脂代谢影响因素的报道较多[4-6],但关于GDM并发脂代谢紊乱的危险因素仍缺乏系统报道。鉴于此,本研究通过回顾分析300例GDM患者的临床资料,探讨GDM并发脂代谢紊乱的危险因素。
1 资料与方法
1.1 临床资料 回顾分析2016年2月~2018年5月在合肥市第三人民医院妇产科定期产检的300例GDM患者的资料。纳入标准:确诊为GDM[7];孕期定期产检;资料记录完整。排除标准:非自然妊娠者;孕期转至其他医院产检或分娩者;意外死亡或失访者;妊娠前已存在糖尿病史者;妊娠前已存在脂代谢紊乱者。300例GDM患者的年龄20~41岁,平均(29.71±2.36)岁。本研究经医院伦理委员会审批。
1.2 脂代谢紊乱的判断标准 参考《临床妇产科学》[8],将产检期间总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白-胆固醇(LDL-C)、高密度脂蛋白-胆固醇(HDL-C)水平至少有1项异常者记为脂代谢紊乱,均采用美国贝克曼库尔特公司生产的X7型全自动生化分析仪检测。正常范围:TC 5.12~6.59mmol/L,TG 1.54~2.45mmol/L,LDL-C 2.04~2.53 mmol/L,HDL-C 1.50~2.04mmol/L。将并发脂代谢紊乱者记为并发组,否则记为未并发组。
1.3 危险因素分析方法 归纳可能影响GDM并发脂代谢紊乱的因素包括高龄产妇(年龄≥34岁),孕次,生育史,孕周,胎数,孕前肥胖[孕前体质量指数(BMI)>25.0kg/m2],GDM家族史,高脂血症家族史,合并妊娠高血压疾病,体质量增幅(BMI<19.8kg/m2者,孕期体质量增幅11.5~16kg为宜;孕前BMI≥19.8kg/m2且<26.1kg/m2者,孕期体质量增幅7~11.5kg为宜;孕前BMI≥26.1kg/m2,孕期体质量增幅6~10kg为宜),高脂饮食,合并多囊卵巢综合征,载脂蛋白B,脂蛋白a,脂蛋白脂酶,血糖控制依从性,胰岛素抵抗,血清瘦素等,将其作为自变量(X),对其进行赋值,结果见表1。将脂代谢紊乱的并发情况作为因变量(Y),并发记为1,未并发记为0,分析影响因素。

表1 妊娠期糖尿病并发脂代谢紊乱的自变量赋值结果
1.4 统计学分析 采用SPSS26.0软件,计数资料采用“n(%)”描述,两组比较采用χ2检验;以logistic回归分析探讨影响因素。P<0.05为差异有统计学意义。
2 结 果
2.1 脂代谢紊乱的发生率统计 300例GDM患者中,76例并发脂代谢紊乱,发生率为25.33%(76/300)。并发组中,7例并发先兆子痫,7例胎膜早破,7例产后出血,母体不良妊娠结局发生率为27.63%(21/76);6例巨大儿,7例宫内窘迫,5例新生儿窒息,围产儿不良妊娠结局发生率为23.68%(18/76)。未并发组中,4例并发先兆子痫,6例胎膜早破,7例产后出血,母体不良妊娠结局发生率为7.59%(17/224);8例巨大儿,5例宫内窘迫,2例新生儿窒息,围产儿不良妊娠结局发生率为6.70%(15/224)。并发组母体和围产儿不良妊娠结局发生率均明显高于未并发组(χ2=20.606,P=0.000;χ2=16.727,P=0.000)。
2.2 并发组和未并发组自变量构成比对比 并发组高龄产妇、孕前肥胖、高脂血症家族史、合并妊娠期高血压疾病、高脂饮食、合并多囊卵巢综合征、血糖控制依从性差、胰岛素抵抗者构成比均明显高于未并发组(P<0.05);两组孕期体质量增幅、载脂蛋白B、脂蛋白a、脂蛋白脂酶、血清瘦素水平分布差异显著(P<0.05),其中并发组孕期体质量增幅偏大、载脂蛋白 B>1.12g/L、脂蛋白 a>140mmol/L、脂蛋白脂酶>2.25mmol/L、血清瘦素>22.1g/L者构成比均明显高于未并发组(P<0.05),见表2。
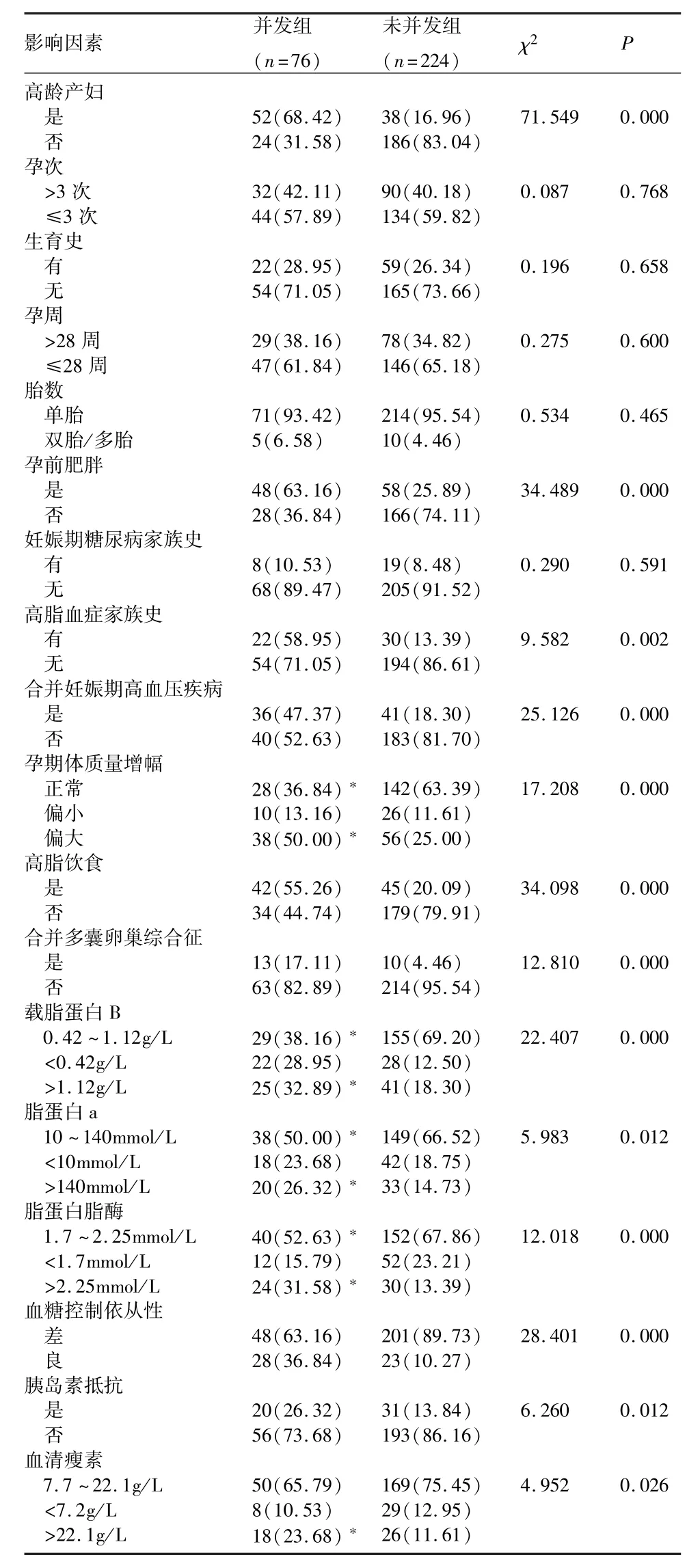
表2 并发组和未并发组自变量构成比对比[n(%)]
2.3 logistic回归分析 高龄产妇、孕前肥胖、高脂血症家族史、合并妊娠期高血压疾病、孕期体质量增幅偏大、高脂饮食、合并多囊卵巢综合征、载脂蛋白B>1.12g/L、脂蛋白 a>140mmol/L、脂蛋白脂酶>2.25mmol/L、血糖控制依从性差、胰岛素抵抗、血清瘦素水平>22.1g/L均是影响GDM并发脂代谢紊乱的独立危险因素,见表3。
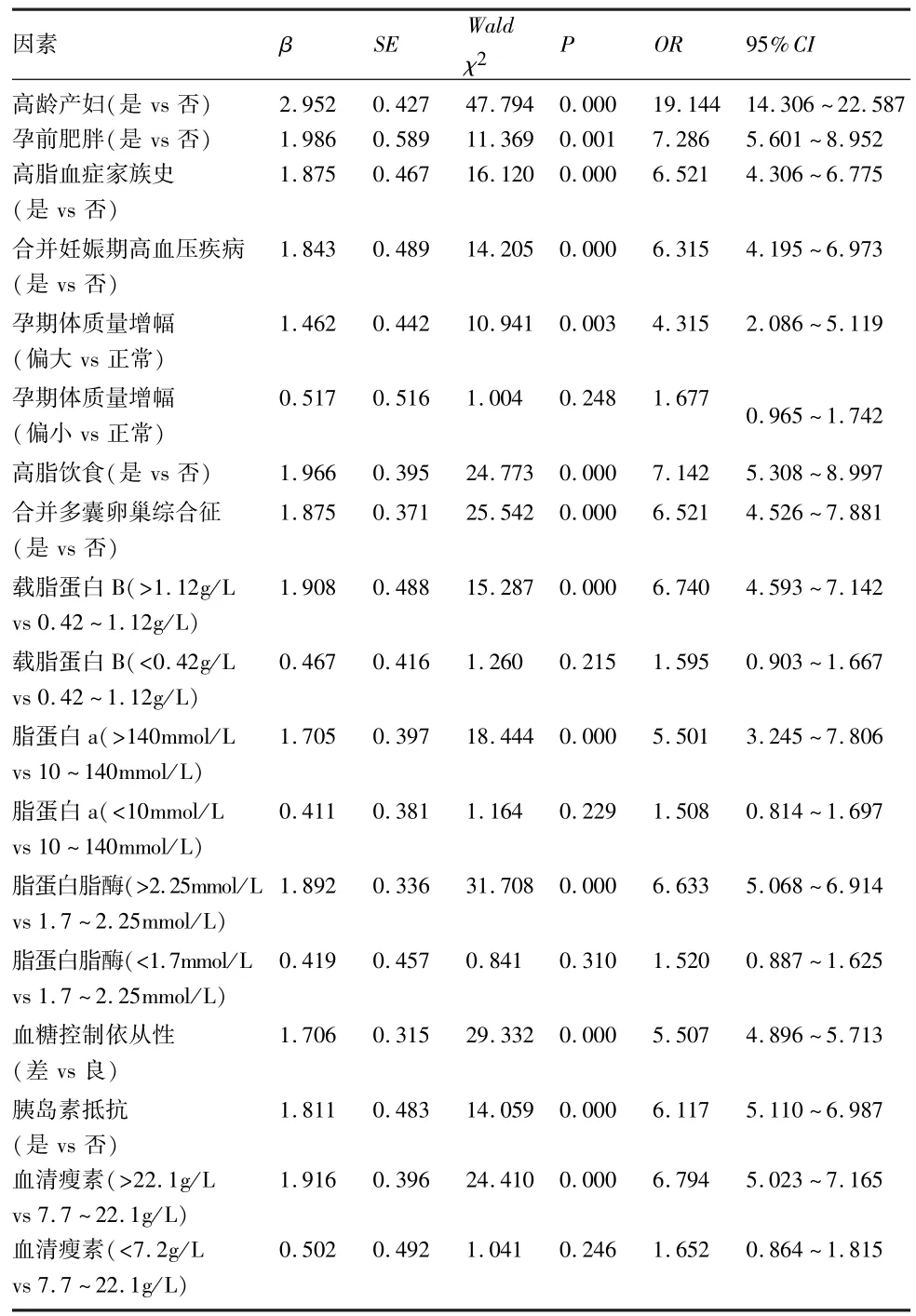
表3 logistic回归分析
3 讨 论
3.1 GDM并发脂代谢紊乱的风险及不良影响 GDM患者脂代谢紊乱的发生风险高[9],且可影响胎儿的生长发育,导致巨大儿、先兆子痫、胎膜早破等母体和围产儿不良妊娠结局[10-11]。本研究中并发组母体、围产儿不良妊娠结局发生率均明显高于未并发组。因此对GDM患者并发脂代谢紊乱的危险因素进行分析具有至关重要的临床意义。
3.2 高龄产妇、孕前肥胖、高脂血症家族史、合并妊娠期高血压疾病、合并多囊卵巢综合征的影响及防控 本研究显示,并发组高龄产妇、孕前肥胖、高脂血症家族史、合并妊娠期高血压疾病、合并多囊卵巢综合征的构成比均高于未并发组,且均为GDM并发脂代谢紊乱的独立危险因素。高龄产妇机能减退,糖脂代谢调控能力下降,因而容易发生GDM和脂代谢紊乱;孕前肥胖的GDM患者存在糖脂代谢紊乱,因而孕期并发脂代谢紊乱的风险也较高;有高脂血症家族史者可能存在某种脂代谢调控基因突变或蛋白合成异常,孕期并发脂代谢紊乱的风险高[12];合并妊娠期高血压疾病者代谢综合征的发生几率高,脂代谢紊乱的风险显著升高;合并多囊卵巢综合征者内分泌水平紊乱,尤其是对于GDM患者,2种疾病均可影响脂代谢状态,增加脂代谢紊乱的发生风险[13]。因此,对于高龄、孕前肥胖、有高脂血症家族史的产妇,需加强脂代谢监测和调控,积极控制GDM患者的血压水平,降低妊娠期高血压疾病的发生风险,积极调控合并多囊卵巢综合征患者的内分泌状态,控制对脂代谢的影响。
3.3 孕期体质量增幅偏大、高脂饮食、血糖控制依从性差、胰岛素抵抗的影响及防控 本研究结果表明,并发组孕期体质量增幅偏大、高脂饮食、血糖控制依从性差、胰岛素抵抗者构成比均高于未并发组,且均是影响GDM并发脂代谢紊乱的独立危险因素。结合相关报道,分析原因可能为:孕期体质量增幅偏大是导致肥胖的根本病因,而肥胖患者的糖脂代谢紊乱的风险更高,因此此类患者脂代谢紊乱的风险也更高;高脂饮食是导致妊娠期脂代谢紊乱的重要原因,尤其是对于GDM患者[14];血糖控制依从性差可导致血糖长期处于较高水平,可通过影响内分泌水平增加脂代谢紊乱的发生风险;胰岛素抵抗患者的糖代谢调控难度大,对于糖代谢控制不佳者脂代谢紊乱的发生几率可显著升高[15]。因此对于GDM患者,需控制体质量合理增长,改善饮食结构,提高血糖控制依从性,控制胰岛素抵抗,增强血糖水平控制效果。
3.4 载脂蛋白B、脂蛋白a、脂蛋白脂酶、血清瘦素高于上限的影响及防控 本研究结果显示,并发组载脂蛋白B>1.12g/L、脂蛋白 a>140mmol/L、脂蛋白脂酶>2.25mmol/L、血清瘦素水平>22.1g/L者构成比均远高于未并发组,且经logistic回归分析证实均为GDM并发脂代谢紊乱的独立危险因素。载脂蛋白B是LDL-C中含量最多的蛋白质,可调节肝脏合成极低密度脂蛋白,其水平越高脂代谢紊乱的发生率越高,但具体原因仍需深入探讨。脂蛋白a可携带大量胆固醇结合于血管壁,其水平越高脂代谢紊乱的发生率越高[16];脂蛋白脂酶属于甘油三酯酶,可在血管内皮表面发生作用,影响TG代谢,进而影响脂代谢,故其水平异常可影响脂代谢状态[17]。瘦素是机体糖脂代谢的重要参与者,瘦素水平异常者可影响脂类代谢,影响妊娠结局[18]。因此,在GDM患者治疗期间,还需积极监测上述实验室指标的水平。
综上所述,GDM患者存在一定的脂代谢紊乱风险,且一旦并发脂代谢紊乱,母体、围产儿不良妊娠结局的发生率均显著升高,需引起高度重视。高龄产妇、孕前肥胖、高脂血症家族史、合并妊娠期高血压疾病等均可增加GDM并发脂代谢紊乱发生率,需加强防控,以减轻对母体和胎儿的健康造成的危害。
