PARP1在上皮性卵巢癌中的表达及临床意义*
2021-05-25孟金玉潘惜雨
孟金玉,潘惜雨,褚 然,宋 坤
(山东大学齐鲁医院妇产科,济南 250012)
卵巢癌是40岁以上女性最常见的恶性肿瘤之一,其死亡率居妇科恶性肿瘤首位[1]。卵巢癌早期临床表现隐匿,加之缺乏有效的早期筛查手段,患者确诊时多已处于III期和IV期,5年生存率低于50%[2]。目前,卵巢癌的治疗以肿瘤细胞减灭术为主,辅以化疗、放疗及靶向治疗等多种治疗方法,但仍有相当一部分病例经初始的手术治疗及化疗之后出现复发,或对化疗耐药[3]。因此,卵巢癌亟需探究一种新的早期筛查和治疗手段。
DNA损伤修复是目前癌症治疗的研究热点。DNA单链损伤时,其完整的互补链可作为模板,通过碱基切除修复(base excision repair,BER)、错配修复(mismatch repair,MR)等途径进行DNA损伤修复。而DNA双链损伤则主要通过非同源末端剪接(non-homologous end joining,NHEJ)及同源重组修复(homologous recombination repair,HRR)途径进行修复[4]。DNA损伤中,单链DNA损伤(single-strand break,SSB)会发展为致死性最强的双链DNA断裂(double-strand break,DSB),而DNA双链损伤如得不到及时修复,将会出现基因组不稳定和细胞死亡[5]。如果存在同源重组修复缺陷(homologous recombination deficiency,HRD),如 BRCA1、BRCA2 突变等,则可选择性地利用PARP抑制剂(PARP inhibitors,PARPi)抑制DNA单链损伤修复,导致未修复或修复不良的肿瘤细胞发生合成致死[6]。已有研究表明,PARP1异常表达与多种恶性肿瘤的发生、发展有关,PARP1在乳腺癌、结直肠癌等恶性肿瘤中异常表达[7]。本研究旨在通过数据库分析卵巢癌组织与正常卵巢组织的PARP1表达差异,结合病理组织学样本探讨PARP1表达与临床病理特征及预后的相关性,探讨PARP1作为上皮性卵巢癌常规检测指标的临床意义,进而为卵巢癌临床诊疗提供一定参考价值。
1 资料与方法
1.1 数据库资料来源 使用R语言下载肿瘤细胞系百科全书(Cancer Cell Line Encyclopedia,CCLE)数据库信息,获取特定的卵巢肿瘤矩阵数据并进行GO功能的富集。使用基因表达谱数据分析网站(Gene Expression Profiling Interactive Analysis,GEPIA)在线数据库下载卵巢癌(426例)与正常卵巢组织(88例)数据。新加坡癌症科学研究所卵巢癌数据库(ovarian cancer database of Cancer Science Institute Singapore,CSIOVDB)提取上皮性卵巢癌的临床病理学特征,分析PARP1表达量与卵巢癌分期、分级、铂耐药等临床特征之间的关系。Kaplan Meier Plotter(KM plotter)数据库分析了PARP1与上皮性卵巢癌患者生存、预后之间的关系。
1.2 临床资料来源 随机选取2015年至2017年山东大学齐鲁医院收治的45例上皮性卵巢癌患者及12例行子宫附件切除术的非卵巢病变者的临床标本。45例上皮性卵巢癌患者的年龄29~73岁,≥55岁25例,<55岁20例;组织病理学诊断均为高级别浆液性卵巢癌(high grade serous ovarian cancer,HGSOC);FIGO分期(2014版分期):I/II期8例,III/IV期37例;肿瘤直径≥8cm 25例,<8cm 20例;腹水阳性30例,阴性15例;CA125≥35U/mL 41例,<35U/mL 4例;患者死亡10例,存活35例。上皮性卵巢癌患者纳入标准:(1)术后病理确诊为高级别浆液性卵巢癌;(2)患者术前均未接受化疗、放疗、免疫治疗等其他治疗;(3)无其他肿瘤及卵巢相关疾病病史。(4)患者的年龄、腹水、分化程度、分期、肿瘤大小、CA125、预后等相关临床信息完整。本临床研究获得山东大学齐鲁医院伦理委员会的批准许可。
1.3 主要试剂 PARP1兔抗人单克隆抗体(ab91217)购自英国Abcam公司;生物素-链霉卵白素免疫组化检测试剂盒(SP-9000)、DAB显色试剂盒(ZLI-9018)购自中杉金桥;电子显微镜购自日本Olympus公司。
1.4 免疫组化染色 所有临床组织学样本均经4%多聚甲醛固定、脱水及石蜡包埋处理,制备成4μm切片备用。65℃烤片1h,二甲苯溶液中脱蜡透明,于梯度乙醇中脱去二甲苯。枸橼酸抗原修复30min,内源性过氧化物酶阻断剂孵育30min,山羊血清工作液室温孵育30min以封闭非特异性抗原,一抗4℃过夜。次日室温复温1h。二抗室温孵育30min。辣根过氧化物酶标记链霉卵白素工作液室温孵育30min。显微镜下DAB显色45s,置于自来水中充分冲洗,苏木素染色7min,自来水充分冲洗。玻片置于1%盐酸酒精分化1~2s,1%氨水反蓝10s。将玻片置于梯度乙醇中脱水,二甲苯I、II透明,中性树脂封片。
1.5 免疫组化结果评估 PARP1表达在细胞核,染色阳性结果为胞核呈黄色或黄褐色。免疫组化分析结果由两个独立的病理医师进行评估。染色强度评分:阴性0分;弱阳性1分;中等阳性2分;强阳性3分。阳性细胞率评分:少于5%,0分;5% ~25%,1分;26% ~50%,2分;51% ~75%,3分;大于75%,4分。评分为染色强度和染色区域的乘积:0~7分为低表达,8~12分为高表达。
1.6 统计学处理 应用R3.6.1、GraphPad8.0及SPSS24.0统计学软件。计数资料用率(%)表示,采用卡方检验。Kaplan-Meier生存分析用于比较两组患者间总生存率(overall survival,OS)的差异。P<0.05为差异有统计学意义。
2 结 果
2.1 CCLE数据库富集PARP1的功能 使用R进行肿瘤细胞系百科全书数据库(Cancer Cell Line Encyclopedia,CCLE)的数据下载,获取特定的卵巢肿瘤矩阵数据并进行GO功能的富集,结果显示PARP1主要参与RNA剪切、DNA损伤修复等功能(图1)。
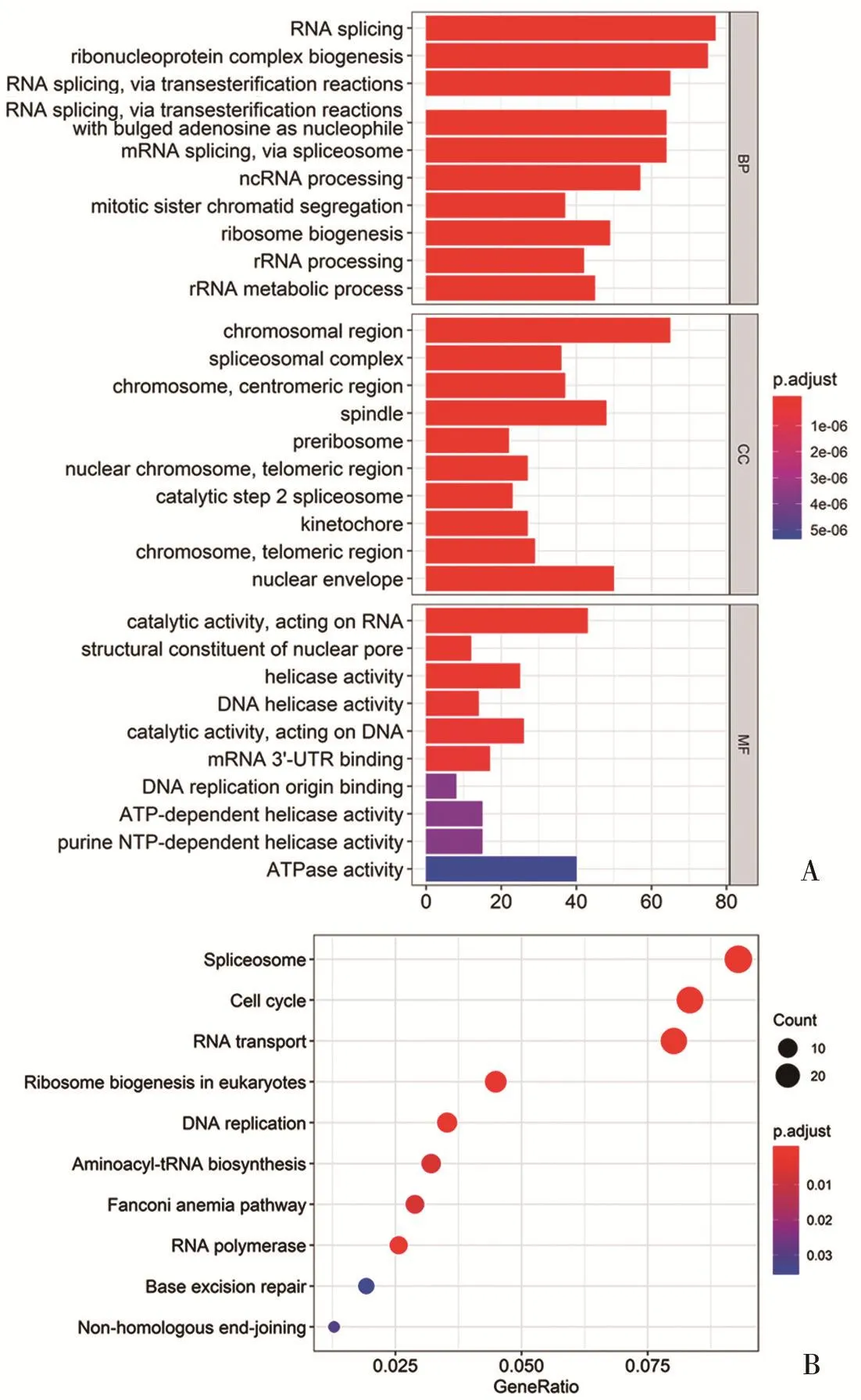
图1 CCLE数据库中PARP1的功能富集
2.2 数据库分析PARP1在上皮性卵巢癌中的表达使用基因表达谱数据分析网站(gene expression profiling interactive analysis,GEPIA)分析PARP1在不同肿瘤中的表达水平。结果显示,PARP1在乳腺癌、淋巴瘤、食道癌、卵巢癌等组织中的表达高于相应的正常组织(图2A)。新加坡癌症科学研究所卵巢癌数据库(ovarian cancer database of Cancer Science Institute Singapore,CSIOVDB)进一步分析显示,上皮性卵巢癌多种肿瘤组织学类型中,浆液性癌和内膜样癌中的 PARP1表达高于其他类型(图2B)。

图2 数据库分析PARP1表达
2.3 PARP1在上皮性卵巢癌和正常卵巢组织中的表达差异 使用GEPIA在线数据库分析PARP1在卵巢癌和正常卵巢组织中的表达差异,PARP1在卵巢癌中的表达高于正常卵巢组织(图3A),差异有统计学意义(P<0.05)。

图3 数据库分析PARP1在卵巢癌及正常卵巢组织中的表达差异
2.4 PARP1在临床样本中的表达差异 临床组织学样本显示,PARP1主要表达在细胞核,染色阳性为核呈黄色或黄褐色,高级别浆液性卵巢癌中PARP1高表达,而正常卵巢组织中PARP1不表达或弱表达(图4A-D)。
2.5 数据库分析PARP1表达水平与临床病理特征的关系 CSIOVDB在线数据库分析显示:G1、G2、G3级卵巢癌中 PARP1表达分别为 8.553、8.910、9.012,差异有统计学意义(P<0.05)(图4A)。不同分期卵巢癌中 PARP1表达分别为8.737、8.956、8.986和 8.934,其中 I、II、III 期卵巢癌中的 PARP1表达差异有统计学意义(P<0.05),III、IV期卵巢癌中PARP1表达差异无统计学意义(图4B)。化疗耐药复发组中PARP1表达高于PARP1耐药组及PARP1敏感组,差异有统计学意义(P<0.05)(图4C)。KM plotter在线数据库显示,PARP1高表达与患者的不良预后相关,PARP1高表达与患者的总生存率无关(P=0.11)(图4D),但患者的无进展生存期(progression-free-survival,PFS)明显缩短(P=0.0042)(图4E),PARP1低表达组患者较高表达组患者,具有更好的总生存期(overall survival,OS)(P=0.025)(图4F)。

图4 PARP1在正常卵巢组织及卵巢癌组织中的表达情况
2.6 临床组织学样本分析PARP1表达与病理学特征之间的关系 上皮性卵巢癌患者中PARP1表达量与患者的年龄、分期、腹水等临床特征无显著相关(P均>0.05),与患者的生存有显著相关性(P=0.029)(表1)。
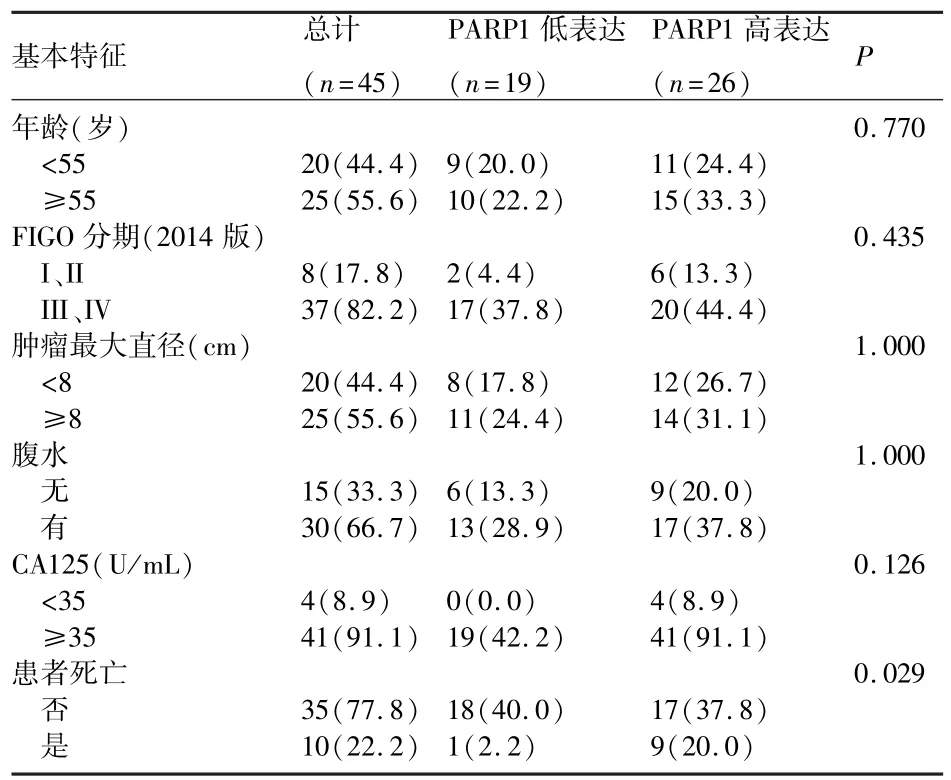
表1 PARP1分组患者基本特征

图5 数据库分析PARP1表达与临床病理特征之间的关系
3 讨 论
卵巢癌早期临床表现隐匿,发现时多处于晚期,晚期5年生存率低于30%,死亡率在女性生殖系统肿瘤中居首位[8]。鉴于传统治疗手段效果有限,因此寻找具有诊断、预后和预测潜力的诊断标记物及新治疗靶点成为现阶段的研究热点。目前,针对靶向药物的临床前研究及临床试验取得了较好的进展,提示各种新型靶向药物的分析与研究将成为卵巢癌的研究热点,具有重要的临床意义与科研价值。
目前已有许多PARP抑制剂获得美国食品和药物管理局(food and drug administration,FDA)的批准用于临床,如奥拉帕利、卢卡帕利、尼拉帕利等,还有其他一些PARP抑制剂正处于临床实验阶段[9]。其中,奥拉帕利和尼拉帕利是目前研究最广泛的口服小分子PARP1/2抑制剂。2014年欧洲药品管理局(European Medicines Agency,EMA)批准奥拉帕利用于铂敏感复发BRCA突变卵巢癌的维持治疗,同时被美国批准用于治疗既往接受过三线或三线以上铂类化疗复发的BRCA突变晚期卵巢癌[10]。2017年FDA批准尼拉帕利用于复发性上皮性卵巢癌、输卵管癌及原发性腹膜癌的维持治疗[11]。PARP抑制剂在肿瘤治疗中已经取得了相当大的进展,但在临床治疗过程中仍有部分患者存在原发耐药等问题[12]。研究发现,PARP1在乳腺癌耐药细胞中的表达低于敏感细胞,这表明PARP1蛋白的表达水平可能具有治疗相关性[13]。对PARP抑制剂治疗的剂量依赖性临床反应表明,肿瘤细胞中PARP1表达量可能反应PARP1抑制剂的治疗效果[14]。Domagala等[15]在有关PARP1与乳腺癌的研究中指出,高表达PARP1的三阴性乳腺癌较低表达PARP1者可能更适应用PARP抑制剂。因此肿瘤中PARP1表达水平将有助于预测患者对PARPi治疗的敏感性,实现更加精准的靶向治疗,从而起到预测和提高患者预后的作用。
PARP1是存在于真核细胞细胞核的DNA损伤修复酶,参与肿瘤的发生发展、神经退行性疾病及自身免疫性疾病等多个过程[16-17]。乳腺癌、前列腺癌、脑胶质瘤、胰腺癌、子宫内膜癌等多种恶性肿瘤中PARP1表达高于正常组织,且PARP1表达与肿瘤的分期及患者的不良预后也有显著的关系[18-19]。研究表明,PARP1可作用于Snail的启动子,参与上皮间质转化(epithelial mesenchymal transformation,EMT)过程,从而促进肿瘤的侵袭转移[20]。PARP1还可与转录因子相互作用,诱导血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达,从而促进肿瘤血管的生成[21]。此外,有研究表明PARP1参与免疫微环境的调节,抑制PARP1靶点可以导致基因组的不稳定性,增加肿瘤的突变负荷[22]。当前的研究显示,PARP1作为关键的DNA损伤修复酶,在卵巢癌的发生发展中具有重要的作用,并在卵巢癌的治疗研究中显示了良好的应用前景。除PARP1的酶活性之外,PARP1自身的表达可能也是潜在的卵巢癌治疗与预测靶点。
本研究发现,PARP1作为一种聚腺苷二磷酸核糖聚合酶,主要参与RNA剪接、DNA损伤修复等多种生理学过程。PARP1在多种肿瘤组织中高表达,而在卵巢癌中,内膜样癌和浆液性癌中PARP1表达高于其他组织学类型。数据库发现,PARP1在卵巢癌组织中的表达高于正常卵巢组织,在临床组织学样本中也验证了该结果。PARP1在卵巢癌中的表达与分级呈正相关(P<0.05),而与卵巢癌的分期无明显相关性(P>0.05)。此外,数据库发现PARP1高表达可能参与化疗耐药及化疗耐药后复发,且PARP1高表达与患者的PFS相关(P=0.0042)。临床组织学样本发现,PARP1的高表达与更低的总体生存率相关(P=0.025),而与其他的临床病理特征无明显的相关性。本研究存在一些局限性,如用于验证研究结果的临床病理组织切片样本量较少,导致一些临床数据的偏倚,有待进一步扩大临床数据量,对研究结果进一步验证。
综上所述,卵巢癌组织中PARP1表达水平较正常卵巢组织明显升高,高表达水平的PARP1与卵巢癌的化疗耐药、复发及患者的不良预后相关,提示PARP1可能具备作为卵巢癌常规筛查标记物的潜在价值。本研究仅检测了PARP1蛋白在卵巢癌组织中的异常表达,且临床样本有限,其与卵巢癌发生发展及化疗耐药的相关性,仍需多中心、大样本及体内外基础实验来进行更深层次的研究。
