非小细胞肺癌中转录因子SOX2 的表达及其临床意义
2021-05-25李鹏程周艳刚王晓燕
杨 芳 李鹏程 刘 薇 周艳刚 王晓燕 任 涛
1.成都医学院第一附属医院肿瘤科,四川成都 610500;2.成都医学院第一附属医院病理科,四川成都 610500
美国癌症协会2020 年1 月发布的癌症统计数据显示,不管男性还是女性,死亡人数最多的均为肺癌[1]。而非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌最常见的病理类型,占80%~85%。虽然近年来靶向药物及免疫治疗的使用提高了NSCLC 的生存率,但其5 年生存率仅约16%[2]。因此,探索新的生物标志物与NSCLC 临床病理特征及预后之间关系具有重要意义。既往研究结果显示,卵巢癌[3]、乳腺癌[4]及头颈部鳞癌[5]等肿瘤细胞的增殖、侵袭和转移均受SOX2 影响。故本实验采用免疫组织化学法检测SOX2蛋白在NSCLC 组织和癌旁组织中的表达情况,探讨SOX2 蛋白与NSCLC 临床病理特征和预后之间的相关性。
1 资料与方法
1.1 一般资料
收集2017 年1 月—2019 年5 月成都医学院第一附属医院(以下简称“我院”)行手术切除并经病理科确诊的NSCLC 标本74 例。所有病例术前未接受任何治疗,且临床数据齐全。其中男40 例,女34 例;年龄39~83 岁,平均(63.8±10.6)岁;≤60 岁23 例,>60 岁51 例。腺癌43 例,鳞癌31 例;Ⅰ期39 例,Ⅱ期+Ⅲ期35 例;有淋巴结转移30 例,无淋巴结转移44 例。本研究纳入患者均知情同意,通过我院医学伦理委员会审查,符合医学伦理学标准。
1.2 方法
兔抗人SOX2 多克隆抗体(美国Abcam 公司,货号:ab97959)为一抗,按MaxVision/HRP 试剂盒(福州迈新生物技术开发有限公司,货号:1808060014)说明书进行免疫组织化学染色。步骤如下:石蜡切片脱蜡和水化,修复,使用3%的过氧化氢阻断内源性过氧化物酶的活性,加一抗(1∶400),4℃过夜。PBS 洗涤后,加聚合物增强剂,室温孵育20 min,孵二抗(酶标抗鼠/兔聚合物,福州迈新生物技术开发有限公司,货号:200526S407g)15 min。加新配制的DAB 溶液5 min,水洗,苏木精复染,最后脱水干燥,用中性树胶封片。镜下观察并照像。
1.3 观察指标
SOX2 蛋白阳性表达在镜下表现为细胞核内出现黄色颗粒。每张切片选取5 个高倍镜(200×)视野。染色强度计分标准:无着色0 分;淡黄色1 分;黄色或深黄色2 分;褐色或棕褐色3 分。阳性细胞所占百分比计分标准:<5%为0 分;5%~25%为1 分;﹥25%~50%为2 分;>50%~75%为3 分;>75%为4 分。总分=阳性细胞得分×染色强度得分,0 分为阴性(-);1~4 分为弱阳性(+);5~8 分为阳性(++);9~12 分为强阳性(+++)。为便于统计,人为将阴性和弱阳性定义为阴性(-),阳性和强阳性定义为阳性(+)。
1.4 统计学方法
采用SPSS 17.0 统计学软件进行数据分析,计数资料用例数表示,组间比较采用χ2检验;预后分析使用Kaplan-Meier 曲线和Log-rank test 分子检验,最后使用COX 模型对预后因素行多因素回归分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 NSCLC 组织及癌旁组织中SOX2 的表达情况
NSCLC 组织SOX2 阳性表达率为47.3%(35/74),高于癌旁组织的9.5%(7/74),差异有高度统计学意义(χ2=26.063,P <0.01)。阳性染色主要在细胞核,偶有细胞质同时染色,见图1。

图1 NSCLC 组织及癌旁组织中SOX2 的表达情况(免疫组织化学染色,200×)
2.2 SOX2 表达与NSCLC 患者临床病理特征间的关系
不同组织学类型、有无淋巴结转移、不同临床分期SOX2 阳性率比较,差异有统计学意义(P <0.05 或P <0.01)。见表1。

表1 SOX2 表达与NSCLC 患者临床病理特征的关系[例(%)]
2.3 Kaplan-Meier 生存分析
本研究从2017 年4 月开始随访,随访截至2020 年4 月,中位随访14 个月。结果显示,SOX2 阳性表达的NSCLC 患者生存期长于SOX2 阴性表达者,差异有高度统计学意义(P <0.01)。见图2。

图2 Kaplan-Meier 生存分析
2.4 COX 多元回归分析
具体赋值如下:SOX2 表达(0=阴性,1=阳性),年龄(0=>60 岁,1=≤60 岁),性别(0=女性,1=男性),病理类型(0=鳞癌,1=腺癌),临床分期(0=Ⅱ期+Ⅲ期,1=Ⅰ期),吸烟史(0=无,1=有),淋巴结转移(0=无,1=有)。结果显示,SOX2 阳性表达及淋巴结转移是NSCLC 患者预后的独立影响因素(RR >1,P <0.05)。见表2。
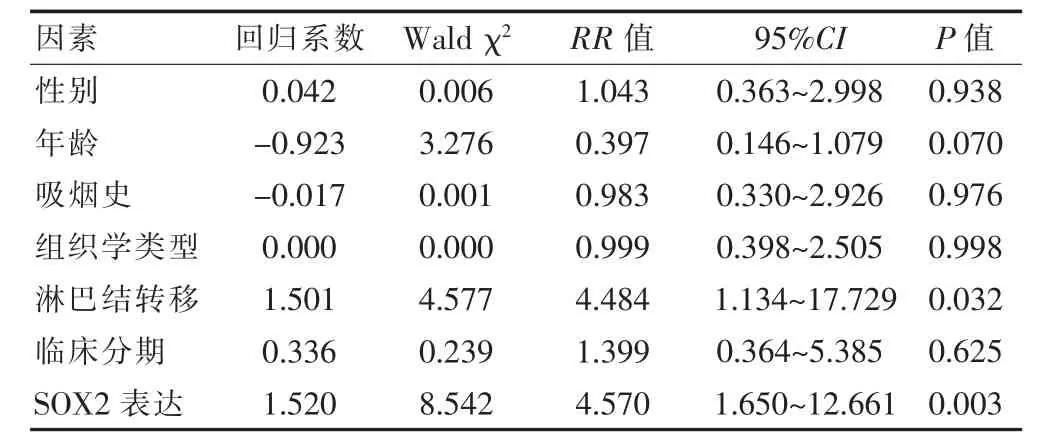
表2 COX 多元回归分析
3 讨论
SOX2 为SOX 基因家族的成员之一,在维持干细胞的自我更新、多向分化和重编程中发挥重要作用[6-7]。目前关于SOX2 表达与NSCLC 预后的相关性缺乏共识。Sholl 等[8]认为SOX2 过表达是Ⅰ期肺腺癌患者的不良预后因素。Sasaki 等[9]认为SOX2 过表达与肺鳞癌预后无明显相关性,而Wilbertz 等[10]认为SOX2 的表达与肺鳞癌的预后改善有关。Ying 等[11]研究提示SOX2 表达上调主要发生在肺鳞癌中,且SOX2 高表达者预后优于低表达者。荟萃分析显示[12],无论是SOX2基因DNA 拷贝数的增加还是SOX2 蛋白的高表达,都有利于NSCLC 的整体生存。本研究结果显示,SOX2 表达与性别、年龄、是否吸烟无明显相关性(P >0.05),癌组织SOX2 阳性表达率高于癌旁组织(P <0.01),其阳性表达主要发生在肺鳞癌中,研究结果与欧洲和日本学者的研究一致[9,13],提示SOX2 可作为诊断肺鳞癌的潜在分子标志物[14]。本研究结果显示,SOX2 阳性表达的NSCLC 患者生存期长于SOX2 阴性表达者;COX 多元回归分析显示,SOX2 表达是NSCLC 患者的独立预后因素,这一结果与Sholl 等[8]研究结果相反。分析其原因,考虑本研究中Ⅱ期及Ⅲ期患者约占一半比例,大部分患者术后接受化疗和/或放疗,而Sholl 等[8]研究中,纳入的为Ⅰ期患者,得出相反的结论,提示SOX2 阳性表达导致更好的预后可能与癌细胞对化疗和/或放疗的敏感性有关。但本研究为回顾性研究,术后辅助方案不统一,并且患者驱动基因表达情况等信息不完整,不排除治疗方案及驱动基因表达情况对预后的影响。因此,SOX2 阳性表达与肺癌细胞对化疗和/或放疗的敏感性尚待进一步研究。
目前有不少将SOX2 作为治疗靶点的研究正在进行[15-17]。SOX2 通过其下游信号传导介质AKT 激酶在NSCLC 疾病进展过程中促进肿瘤的生长和耐药,因此,SOX2 可能成为NSCLC 的治疗靶点[18-19]。另有研究显示[20-21],上皮间质转化增强了肿瘤细胞的侵袭和转移能力,最终促进肿瘤细胞向机体各个部位扩散。Chang[22]观察到SOX2 下调增加了肿瘤上皮标志物的表达,而间质标志物及其相关基因下调,提示SOX2 可能促进NSCLC 的上皮间质转化。miRNA 参与了细胞的发育、增殖、分化及凋亡等多种生物学过程,包括肺癌在内的多种癌症中也发现了异常的miRNA 表达模式[23-24]。有证据表明,miRNA 可能通过调控其靶基因在NSCLC 中的表达来调节多种细胞功能,包括上皮间质转化,而SOX2 表达受miR-590-5p 调控。因此,miR-590-5p/SOX2 轴可能作为NSCLC 的上皮间质转化调节因子,可作为NSCLC 治疗的靶点[22,25]。相信随着SOX2 基础研究的不断深入,其与NSCLC 发生发展之间的关系将会更加明朗,未来可能成为治疗靶点改善患者预后。
