高分辨率CT、常规及功能MRI对颅底低级别软骨肉瘤的诊断价值
2021-05-25姜梦达刘玉陶晓峰李开成
姜梦达,刘玉,陶晓峰,李开成,2
1上海交通大学医学院附属第九人民医院放射科,上海 200011;2海南西部中心医院放射科,海南儋州571700
颅底软骨肉瘤是一种罕见的、生长缓慢且具有局部侵袭性的恶性肿瘤,约占颅底的肿瘤6%[1]。目前已有文献对颅底软骨肉瘤的CT及常规MRI特点进行报道[2-3]。但关于其功能MRI特点,如扩散加权成像(DWI)、动态增强磁共振成像(DCE-MRI)及磁共振波普成像(MRS)的报道少见,尤其是DCE-MRI以及MRS,颅底软骨肉瘤鲜有关于这两种影像学特点的报道,而中枢系统及头颈部疾病该检查方法已经广泛应用[4-5]。本研究拟探讨10例颅底软骨肉瘤的高分辨率CT(HRCT)、常规MRI、DWI、DCE-MRI及MRS的特征,旨在加深对该病的认识,提高诊断正确率。
1 资料与方法
1.1 一般资料
回顾性分析本院2016年12月~2018年6月经病理证实的10例颅底软骨肉瘤患者的MRI资料,其中女性6例,男性4例,年龄25~64岁,中位年龄44岁。所有患者均行HRCT、常规MRI 平扫、DWI 及增强扫描,包括DCE-MRI和MRS扫描。纳入标准:患者均行手术切除及经病理证实。排除标准:图像质量差,以及曾有过外院治疗病史(手术或者放化疗)。
1.2 检查方法
1.2.1 HRCT 检查 10 例患者行术前HRCT 检查(Siemens,SOMATOM Definition Flash)和多平面重组(MPR)。具体扫描参数为:120 kV,120 mAs,螺距0.8,层厚0.6 mm,骨窗观察,窗宽4000 Hu,窗位700 Hu。
1.2.2 MRI 检查 10 例应用Siemens Magnetom Verio 3.0T MRI扫描仪。扫描序列主要包括横断位T1WI,横断位、冠状位T2WI,横断位DWI,横断位、冠状位及矢状位增强T1WI。具体扫描参数为:T1WI:TR 400 ms,TE 9 ms,层厚3 mm;T2WI:TR 3000 ms,TE 85 ms,层厚3mm;DWI:TR4000ms,TE100ms,b值为0、1000s/mm2,层厚3 mm;增强T1WI,TR 400 ms,TE 9 ms,层厚3 mm;动态增强采集8个时相,共210 s。MRS应用点分辨自旋回波波谱序列进行采集,扫描参数为:单体素TR 1500 ms,TE 35 ms,体素大小为20 mm×20 mm×20 mm,FOV 21 cm,扫描成像时间一般4~5 min。MRI 增强扫描对比剂均采用钆喷酸葡甲胺(Gd-DTPA),计量0.1 mmol/kg。
1.3 图像分析
HRCT 主要评价颅底骨质破坏情况以及钙化特点。常规MRI主要评价病灶的形状、大小、位置、累及范围及信号特点。功能MRI图像主要观察和测量病灶的表观弥散系数(ADC)值、DCE-MRI时间-信号强度曲线(TIC)类型及MRS上胆碱峰(Cho)/肌酸峰(Cr)比值和有无N-乙酰天门冬氨酸峰(NAA)。图像数据在Syngo Verio 3.0 工作站上进行测量及分析。病变ADC值的计算中,首先基于DWI使用单值数模型生成ADC图,在病灶最大层面选取实性部分作为感兴趣区,测得的均值作为病灶的ADC值。DCE-MRI图像分析时将感兴趣区置于病灶最高强化区,软件自动生成TIC曲线,然后计算最高强化率(ERmax)及达峰时间(TTP)。根据既往文献报道[6],将TIC划分为3种类型:I型,持续上升型;II型,速升平台型,速升廓清型。计算公式为ERmax=(SImax-SIpre)/SIpre,其中SIpre为增强前的信号强度,SImax为增强后的最大信号强化,TTP为SImax时所用的时间,根据采集的8个时相计算出对应的TTP。获取MRS原始图像后,由工作站对感兴趣区进行后处理分析得到代谢物分布及峰值图。
1.4 病理检查
本组10例颅底软骨肉瘤均行外科手术切除。标本经甲醛溶液固定,常规脱水,石蜡切片,HE染色,光镜观察。同时行免疫组织化学染色。
2 结果
2.1 HRCT表现
本组所有病例均可见颅底明显骨质破坏,边缘均呈虫蚀样改变,且颅底骨缝处的多骨受累。6例出现钙化,表现为点状、不规则斑片状,4例其内未见明显钙化影,其HRCT骨质改变及钙化(图1A~F)。
2.2 MRI表现
本组所有10例肿瘤形态不规则,平均大小为3.5 cm×3.0 cm×4.2 cm。10例中,8例肿瘤主体位于颈静脉孔区,2例病灶主体位于颞骨乳突部,肿瘤累及周围结构主要包括颈静脉孔(n=8)、面神经管鼓室段及乳突段(n=8)、颞骨乳突部(n=7)、中耳(n=5)、舌下神经管(n=4)、咽旁间隙及腮腺深叶(n=4)、颈动脉间隙(n=3)、桥小脑角区(n=1)。T1WI上10例呈均匀等信号,T2WI上呈明显不均匀高信号,5例T2WI上可见片状低信号,增强后呈轻中度不均匀强化。
10例肿块DCE-MRI的TIC曲线均呈持续上升型(I 型曲线),ERmax=1.20±0.44,TTP均≥210 s。10例肿块的平均ADC值为(1.96±0.10)×10-3mm2/s。10例病灶MRS 上Cho 峰/Cr 峰比值均小于1,未见明显NAA峰。具体临床资料及功能MRI结果(表1),典型颅底软骨肉瘤常规及功能MRI表现(图2~3)。
2.3 病理表现
术中所见软骨肉瘤呈红色胶冻样、分叶状肿物。光镜下可见成片软骨样细胞,细胞有异型性,部分区域间质疏松(图2 H~I)。免疫组化:10例均可见S-100(+),Vim(+),SMA(-),CK(-);部分病例EMA(-),CD34(+),PAS(+)。
3 讨论

图1 颅底低级别软骨肉瘤的HRCT表现Fig.1 HRCT findings of low grade chondrosarcoma of skull base
软骨肉瘤约占所有原发恶性骨肿瘤的10%~20%,发生于头颈部罕见,颌骨及鼻腔相对多见一些,颅内罕见,约占颅底肿瘤的6%。颅底原发的软骨肉瘤被认为起源于原始的间充质细胞或胚胎残余的软骨细胞,常发生于蝶岩缝、岩枕缝、岩斜缝附近的孔道裂隙及软骨结合处[7]。一项200例的颅底软骨肉瘤研究发现约2/3病例累及岩斜缝,1/4起源于蝶枕缝,6%中心位置在蝶筛复合体[8];另一项48例颅底软骨肉瘤的研究发现约44%累及岩骨,但只有8%累及到斜坡[9]。本研究中10例病灶均位于侧颅底,岩斜缝与岩枕缝受累多见,可符合颅底骨缝连接处起源学说。平均发病年龄40~50岁,临床症状包括听力下降、搏动性耳鸣、眩晕、头痛等,颅神经症状常见,包括复视、面部疼痛、面肌痉挛、面瘫、吞咽困难、声嘶、耸肩无力、舌肌萎缩等[10]。本组病例报道平均年龄44岁,发病年龄及临床症状与文献报道基本一致,症状和病灶所累及颅神经密切相关,颅底软骨肉瘤很少发生转移,多呈局部侵袭性生长以及推压造成邻近结构包括颅神经及血管的损伤[11]。
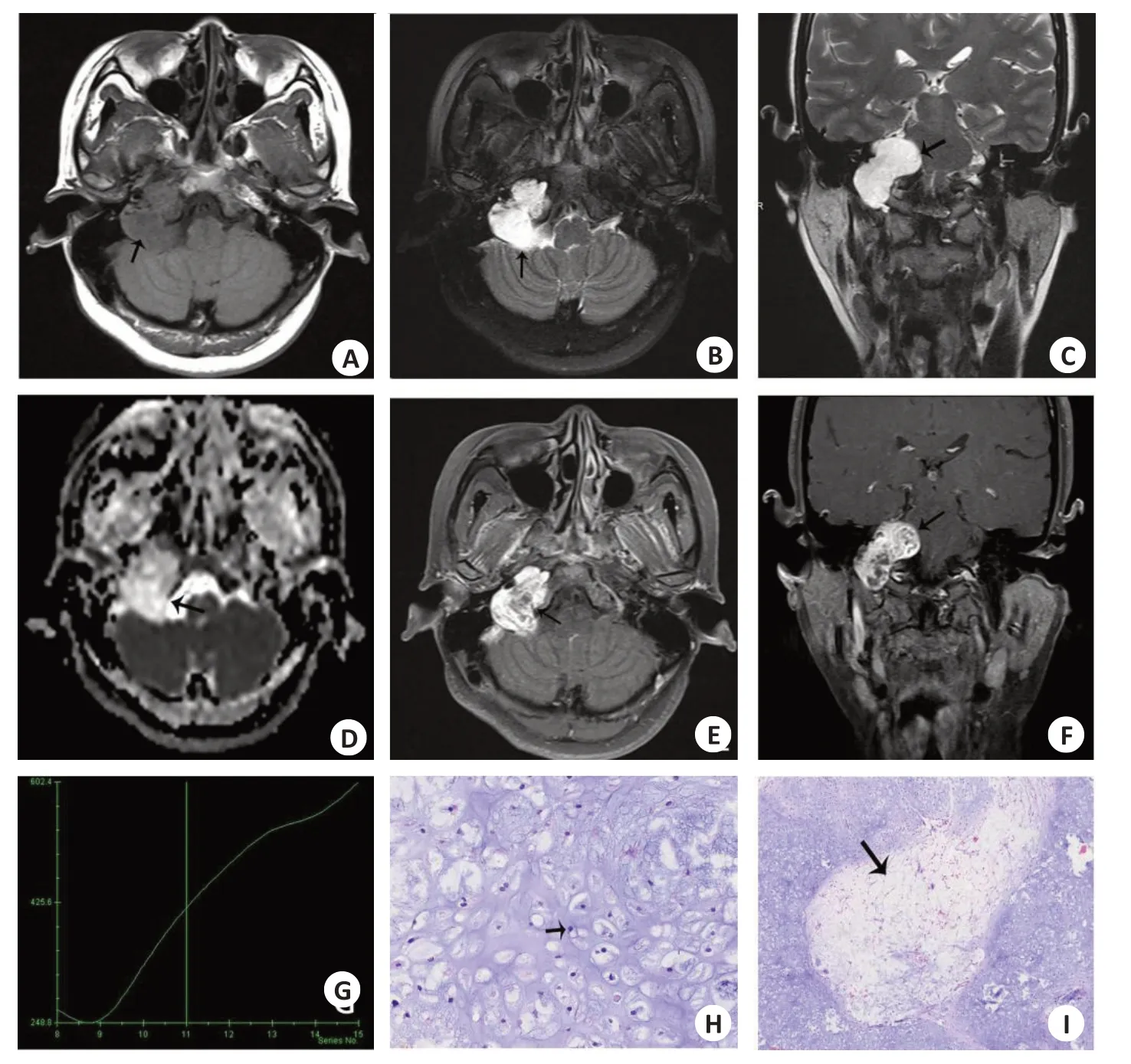
图2 女,42岁,右侧颅底、颈静脉孔区低级别软骨肉瘤Fig.2 Female,42 years old,with low grade chondrosarcoma of right skull base and jugular foramen area
病理上软骨肉瘤以下几种亚型:传统髓腔型、黏液型、分化型、透明细胞型、间质型,其中间质型和传统型软骨肉瘤是最常见的亚型[8,12]。有学者进一步将传统型软骨肉瘤分为III级:I级为高分化,II级为中等分化,III级为低分化,主要依据细胞结构、细胞核大小及异型性、软骨基质等[8]。据报道颅底软骨肉瘤约半数为I级,90%为I~II级,III级非常罕见,且预后差[2],我们所报道的病例均为I-II级软骨肉瘤。术中所见软骨肉瘤呈胶冻状,分叶状的淡红色肿物,偶可见钙化。显微镜下可见软骨样细胞、液化坏死、软骨基质及核分裂相等。
既往文献报道颅底软骨肉瘤的CT表现为不规则骨质破坏,结节状、絮状钙化,钙化边缘欠清晰[11],本组病例采用颞骨HRCT扫描,对钙化及骨质破坏显示清晰,病灶均表现为不规则骨质破坏,呈虫蚀样改变,累及范围常包括颅底骨缝连接处的多骨,钙化则呈多样性改变,可呈点状、不规则斑片状改变,钙化密度浓淡不一,这可能与钙化是否成熟有关,值得注意的是,本组钙化发生率60%,低于卢红等[3]学者的报道,推测和本研究样本量较少有一定关系。
常规MRI上颅底软骨肉瘤具有一定特点。本组10例病灶形态均不规则,呈分叶状,T1WI呈等低信号,T2WI呈明显不均匀高信号,肉眼观察几乎近似于脑脊液水样信号,增强轻中度不均匀强化,部分呈“花环状”及“蜂窝状”强化,约半数病灶内出现T1WI及T2WI低信号钙化影,与先前文献报道基本一致[2-3]。DCE-MRI的TIC及ERmax参数可反应病灶的血流动力学特征,有文献报道颅底软骨肉瘤呈延迟渐进性强化[2],与本组研究TIC曲线吻合,均呈现I型曲线(持续上升型),推测与瘤内富含大量黏液基质,黏蛋白有吸附聚积钆喷酸葡甲胺分子作用有关[13],ERmax平均为1.20±0.44,动态增强扫描8个时相共计210秒内造影剂未见流出,故TTP均≥210 s。DWI可以提供肿瘤细胞的信息,反应了细胞内外水分子运动,已经常规应用于CNS肿瘤[14],头颈部良性肿瘤的ADC值要显著高于恶性肿瘤[15-17]。DWI也用于评价颅骨病变,近来有文献表明颅骨良恶性肿瘤间的ADC值存在明显差异[17-18]。研究在ADC值评价颅骨病变中,良恶性临界值定在1.01×10-3mm2/s,但认为也并非绝对,尤其是脊索瘤及低级别软骨肉瘤,其细胞密度较低,ADC值往往偏高[18]。有学者统计的一组32例颅底软骨肉瘤中,平均ADC值约2.02×10-3mm2/s[19],与本组研究中平均ADC值1.96×10-3mm2/s接近,如此高的ADC值推测和肿瘤内部含有大量黏液成分、软骨基质等成分有关,且肿瘤细胞密度小,水分子运动不受限。MRS是利用磁共振现象和化学位移作用进行特定原子核及化合物分析的方法,是目前唯一能对活体组织代谢、生化变化、化合物定量分析的无创技术。能检测到的常见代谢产峰包括N-乙酰天门冬氨酸(NAA)、胆碱(Cho)、肌酸(Cr)等。NAA峰在2.02 ppm,主要存在成熟神经元内的标志物,所有能够导致神经元损伤和丢失的病变都可以表现NAA峰降低或消失。Cho峰反应了细胞分裂增殖活跃程度及细胞膜代谢情况,Cho峰增高说明细胞膜更新加快,细胞密度大,通常是肿瘤细胞增殖所致。Cr峰包括肌酸和磷酸肌酸,总量一般稳定,常作对照值来衡量其他代谢物含量[4-5]。本组所研究的病例当中,Cho峰/Cr峰比值均小于1,说明颅底软骨肉瘤的恶性程度低,细胞分化较好,增殖不旺盛。NAA峰的缺失能进一步说明其不含神经元组织,非中枢系统起源的肿瘤。
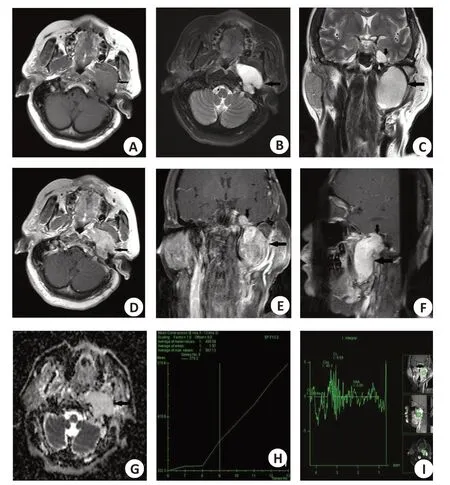
图3 女,56岁,左侧颅底、颈静脉孔区低级别软骨肉瘤Fig.3 Female,56 years old,with low grade chondrosarcoma of left skull base and jugular foramen area
影像学上,颅底软骨肉瘤需要和脊索瘤、软骨瘤、颈静脉孔区神经鞘瘤、颈静脉球瘤、脑膜瘤、静脉畸形等鉴别。文献报道脊索瘤发生部位中线斜坡附近多见,而常规MRI信号两者间无法鉴别,但脊索瘤ADC值要明显低于软骨肉瘤,约1.26×10-3mm2/s[20-21]。曾莉等[21]对颅底经典型脊索瘤、未分化型脊索瘤及软骨肉瘤的ADC值进行比较,认为3种肿瘤的ADC值存在明显差异,软骨肉瘤的ADC值要显著高于脊索瘤。软骨瘤也来源于软骨细胞,有研究报道软骨肉瘤更好发于侧颅底,而软骨瘤则颅底中部多见,软骨肉瘤的ADC值显著高于软骨瘤[22]。颈静脉孔区的神经鞘瘤一般对周围骨质呈推压吸收改变,不引起明显的骨质破坏,T2WI信号不及软骨肉瘤高,TIC曲线可类似,但ADC值要显著低于软骨肉瘤,且需要注意的是,神经鞘瘤MRS上常可明显的Cho 峰。颈静脉球瘤可引起骨质破坏,血供丰富,但T2WI信号同样不及软骨肉瘤高,ADC值显著低于软骨肉瘤,TIC曲线多呈II型曲线。脑膜瘤多宽基底与颅骨相邻,信号一般较均匀,增强明显均匀强化,邻近脑膜常增厚强化,即“脑膜尾征”,若脑膜瘤发生于颈静脉孔区,呈颅内外沟通性病变,一般颈静脉孔不扩大,骨质破坏不明显,脑膜瘤ADC值亦明显低于软骨肉瘤,TIC曲线多呈II型或者I型曲线,鉴别不难。颅底的静脉畸形不多见,T2WI抑脂图像上常常表现为与低级别软骨肉瘤相似的极高信号,但动态增强序列可见典型的由点及面的渐进性强化。
综上所述,颅底软骨肉瘤为低度恶性肿瘤,但MRI功能成像多表现为良性特征,需要引起放射科医生特别关注。临床多主张肿瘤完整切除,可辅助术后放疗,处理方式与颅底其他良恶性肿瘤有所不同,所以术前通过影像明确诊断非常重要。若HRCT出现颅底多骨虫蚀样骨质破坏,点状或不规则斑片状钙化,常规MRI看到颅底T2WI不均匀高信号的病灶,增强轻中度强化,TIC曲线均呈持续上升型,ADC值约为(1.96±0.10)×10-3mm2/s,MRS上NAA峰缺失,Cho峰/Cr峰比值小于1要考虑颅底低级别软骨肉瘤的可能。