miR-34a、HMGB1及PCNA在宫颈上皮内病变中的表达及其临床意义*
2021-05-25梁月娟
万 兵,梁月娟,王 鹤
(广西医科大学附属肿瘤医院妇瘤科,南宁 530021)
宫颈癌(cervical cancer,CC)在全球女性诊断出的恶性肿瘤中居于第4位[1],严重危害着广大女性的健康。高危型人乳头瘤病毒(high risk human papillomavirus,HR-HPV)持续感染是CC 发生的最主要危险因素[2],但并非都会发展成宫颈上皮内病变(squamous intraepithelial lesions,SIL)甚至CC。其他致病机制是近年来的研究热点,为SIL及CC的防治提供新思路。MicroRNA是一类高度保守的非编码RNA,其可结合到靶mRNA的3’-UTR,并与其他辅助蛋白降解靶mRNA 转录本/抑制其翻译成蛋白质[3]。MicroRNA 也可以作为原癌基因或抑癌基因参与癌症的发生发展[4]。miR-34家族中有miR-34a、miR-34b和miR-34c,参与p53调控途径[5]。miR-34a可调节细胞周期E2、细胞周期蛋白依赖性激酶CDK4/6、E2F转录因子、B淋巴细胞瘤2等蛋白[6],并在CC[7]等肿瘤上发现其具有抗肿瘤活性,预测其可能是癌症诊断和治疗的潜在靶标。高迁移率族蛋白B1(high mobility group box-B1,HMGB1)是一种结合在DNA上高度保守的核蛋白,其在细胞内外发挥不同作用。细胞增殖核抗原(proliferating cell nuclear antigen,PCNA)存在于细胞核中,被公认为细胞增殖的标志蛋白。HMGB1 参与组织修复、抑制凋亡、促进肿瘤血管的生成及肿瘤转移等,还可促进树突状细胞的成熟迁移和Th2 细胞的极化,引起免疫逃逸[8]。相关研究发现,HMGB1 是多种miRNA的直接靶标,PCNA和HMGB1的表达呈正相关关系[9-10],但miR-34a 在调控SIL 进展及癌变的分子机制仍不清楚。本研究探讨miR-34a、HMGB1 及PCNA基因在SIL组织中的表达及其与临床病理因素的关系。
1 材料和方法
1.1 组织标本和病例的收集
收集广西医科大学附属肿瘤医院2016 年1 月至2019 年12 月收治的158 例SIL、宫颈鳞癌(cervical squamous cell carcinoma,SCC)及因子宫肌瘤/子宫腺肌症切除子宫的患者宫颈组织标本及临床病理资料。将研究对象分为正常宫颈组(n=50)、SIL组(n=65)和SCC 组(n=43)。其中用于检测miR-34a 的正常宫颈组31 例、SIL 组织30 例、SCC 组31例,用于检测HMGB1、PCNA 的正常宫颈组38 例、SIL组52例、SCC组30例。所有标本取前患者均未行化疗、放疗及免疫治疗。本研究获得广西医科大学附属肿瘤医院医学伦理委员会批准,所有患者及其家属均已签署知情同意书。
1.2 细胞培养
SCC 细胞系SiHa 细胞由复旦大学附属上海市第五人民医院馈赠,STR鉴定匹配值为100%。SiHa细胞在含有10%胎牛血清+1%青链霉素的DMEM培养基中培养。CC前细胞系H8细胞购自中国科学院,在含有10%胎牛血清+1%青链霉素的1640培养基中培养,培养基、血清和抗生素均购自Gibco 公司。
1.3 RNA的抽提和实时荧光定量PCR(qPCR)
采用Trizol 法提取组织标本及细胞中的总RNA,并逆转录成cDNA,qPCR 检测各基因表达,Trizol、逆转录及qPCR 试剂盒均购自Takara 公司。miR-34a 引物序列为5’-UGGCAGUGUCUUAGCUGGUUGU-3’;U6上游引物为5’-AGCCACATCGCTCAGACAC-3’,下游为5’-GCCCAATACGACCAAATCC-3’;HMGB1 上游引物为5’-TATGGCAAAAGCGGACAAGG-3’,下游为5’-CTTCGCAACATCACCAATGGA-3’;PCNA上游引物为5’-CCTGCTGGGATATTAGCTCCA-3’,下游为5’-CAGCGGTAGGTGTCGAAGC-3’;GAPDH 上游引物为5’-CCTCTGACTTCAACAGCGACAC-3’,下游为5’-CACCACCCTGTTGCTGTAGCCA-3’。上述引物均由Takara公司合成。每个样品均检测3次,U6 和GAPDH 作为内参,采用2-ΔΔCT计算各样本中miR-34a 和细胞系中各基因的相对表达水平。HMGB1 和PCNA 基因在组织中的表达采用目的基因拷贝数/内参基因拷贝数进行统计学分析。
1.4 统计学方法
采用SPSS 26.0 软件对数据进行分析。正态分布的计量资料以均数±标准差()表示,组间比较采用t检验,方差不齐时选用t’检验;非正态分布的计量资料采用中位数(四分位数间距)[M(QR)]表示,组间比较使用曼-惠尼特U检验。多组之间比较采用方差分析,方差不齐的组间比较采用秩和检验,计数资料用百分率(%)表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 临床病理分析
3 组患者的年龄、孕次、绝经、HPV 感染情况比较,差异均有统计学意义(均P<0.05),见表1。以年龄、绝经、孕次、产次、HPV感染为自变量,以诊断为SIL 及SCC 为因变量分别进行Logistic 单因素分析,结果显示患者年龄、孕次及HPV 感染均与SIL有关(P<0.05),年龄、绝经、孕次、产次及HPV感染均与SCC有关(P<0.05)。同时,将年龄、绝经、孕次、产次、HPV 感染纳入多因素分析,结果显示,孕次是SIL 和SCC 发生的保护因素,而HPV 感染是SIL 和SCC发生的危险因素(P<0.05),见表2、表3。

表1 不同组别患者的临床病理分析

表2 影响SIL发生的危险因素的Logistic回归分析
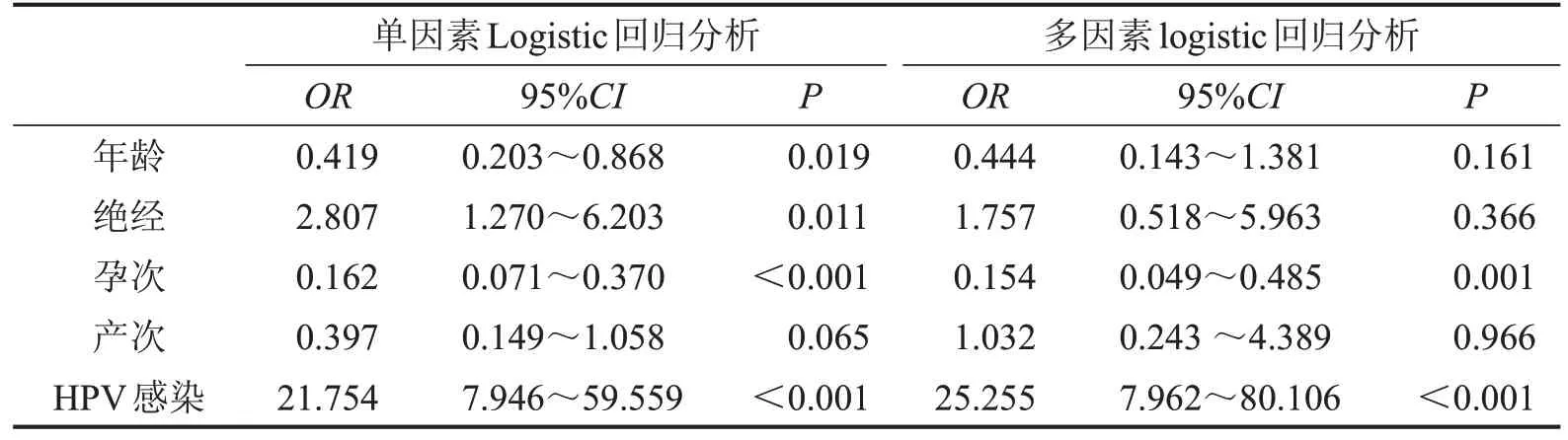
表3 影响SCC发生的危险因素的Logistic回归分析
2.2 各组组织及细胞系中miR-34a、HMGB1 mRNA及PCNA mRNA的表达
2.2.1 miR-34a 的表达 miR-34a 在SIL组 和SCC组中的表达均显著低于正常宫颈组(均P<0.001),且在SCC 组显著低于SIL 组(P=0.024)。在细胞系水平检测结果显示,miR-34a在H8细胞中的表达显著高于SiHa细胞(P<0.001),见表4。
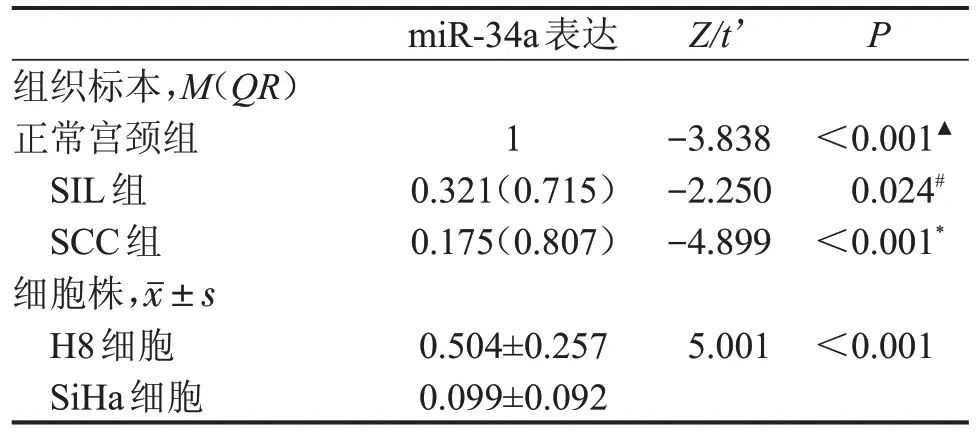
表4 各组织和细胞中的miR-34a表达
2.2.2 HMGB1 mRNA 的表达 HMGB1 在正常宫颈组和SIL 组中的mRNA 表达均显著低于SCC 组(P=0.001,P=0.038),且在正常宫颈组显著低于SIL组(P=0.039)。HMGB1在H8细胞中的mRNA水平显著低于SiHa细胞(P=0.005),见表5。
10月24日,博若莱葡萄酒行业协会(Inter Beaujolais)于东莞万达文华酒店举办大师班,特邀产区宣传大使齐绍仁从葡萄种植、酿酒工艺等方面带领葡萄酒行业专业人士深入了解博若莱产区。借此机会,产区行业协会还进一步推介了以消费场景为导向的新型发展战略 ——“博若莱的新时代”(Beaujolais Nouvelle Génération)。近百名葡萄酒进口商、经销商及当地主流媒体参加了活动。
2.2.3 PCNA mRNA的表达 PCNA在正常宫颈组和SIL组中的表达均显著低于SCC组(P=0.033,P=0.004),但在正常组和SIL组差异无统计学意义(P=0.967)。PCNA 在H8 细胞中的mRNA 水平显著低于SiHa细胞(P=0.045),见表6。

表5 各组织和细胞中的HMGB1表达
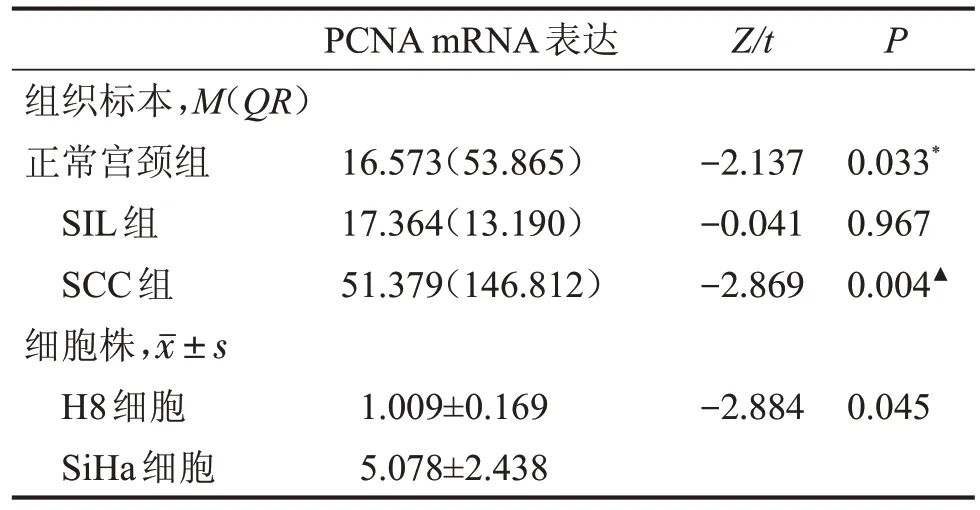
表6 各组织和细胞中的PCNA表达
2.3 不同临床病理因素的患者miR-34a 表达的差异 miR-34a在HPV阳性的SIL和SCC组织中表达均较HPV 阴性者显著下降(P=0.028,P=0.039),同时,有淋巴结转移者miR-34a 表达显著下调(P=0.015)。其余临床病理因素与各组miR-34a 的相对表达量无明显相关性,见表7、表8。
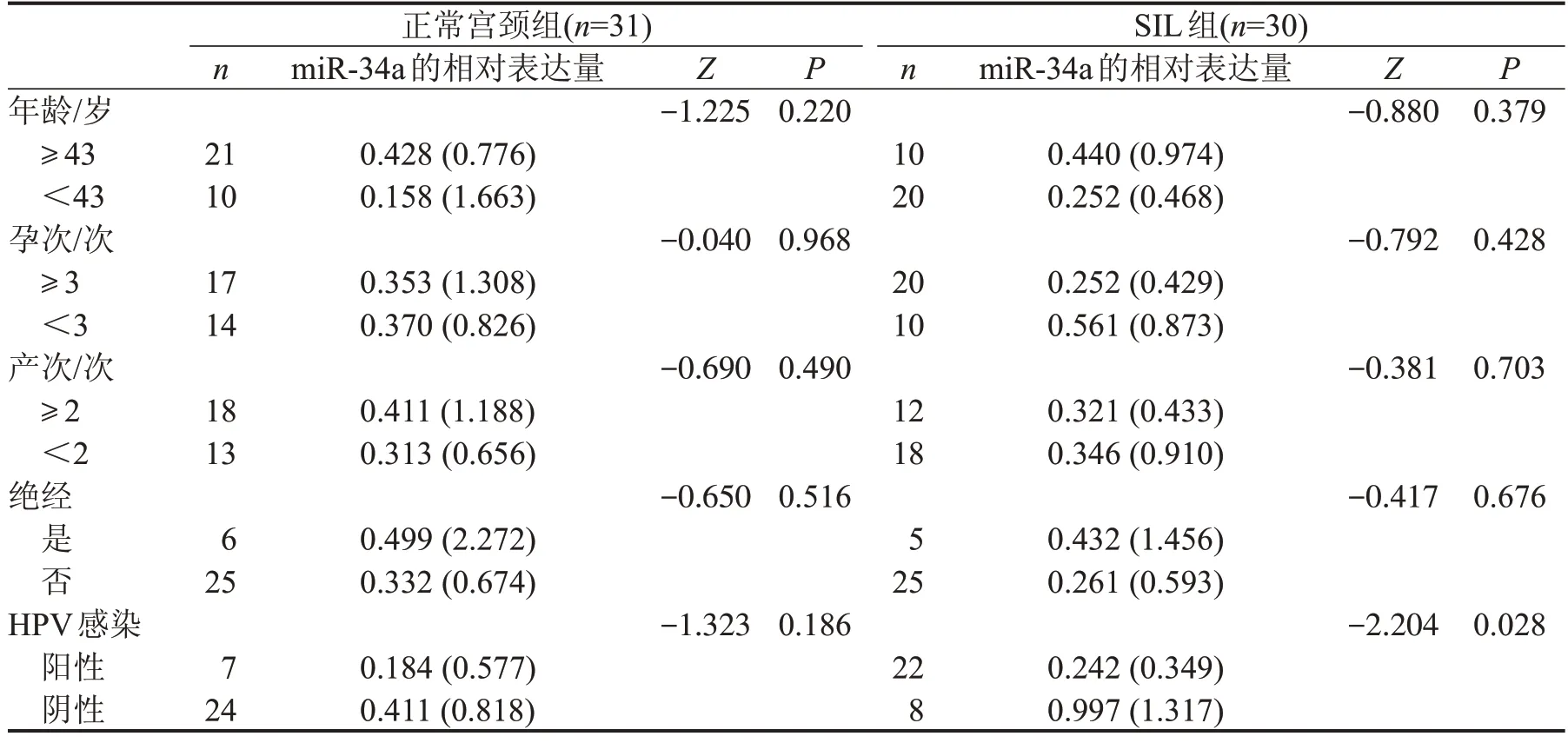
表7 患者临床病理特征与miR-34a在正常组及SIL组中表达情况的关系M(QR)

表8 患者临床病理特征与miR-34a在SIL组及SCC组中表达情况的关系M(QR)
3 讨论
3.1 miR-34a表达与SIL的关系
SIL发展为宫颈原位癌、浸润癌是一个多基因、多因素参与,经历多阶段的过程,而miRNA 在此过程中扮演着重要角色。miR-34a上游启动子存在高度保守的p53 蛋白结合位点,还可通过靶向下调E2F3 表达在p53-miR-34a-E2F3-p53 通路和靶向SIRT1增强p53表达形成p53-miR-34a-SIRT1-p53正反馈通路增强miR-34a 的表达[11-12],抑制细胞增殖,阻止细胞周期G1 期/S 期的转变和促进细胞凋亡。Gocze等[7]发现miR-34a在CIN II~III中的表达水平显著低于CINⅠ。同时miR-34a表达下调可促使肺癌[13]、乳腺癌[14]、CC[15]、前列腺癌[16]等肿瘤的发生。本研究发现,miR-34a 在SIL 和SCC 组织较正常宫颈组织表达均显著下调(均P<0.001),且SCC组显著低于SIL组(P=0.024)。同时,miR-34a在H8细胞中的表达显著高于SiHa 细胞(P<0.001)。说明miR-34a在SIL和SCC组织中、H8和SiHa细胞中的表达趋势是一致的,随着宫颈病变程度加重,miR-34a表达逐渐降低。
3.2 HMGB1表达与SIL的关系
研究表明,HMGB1 是miR-34a 的直接靶标,参与肿瘤的发生发展[9-10]。Yu 等[17]发现HMGB1 在慢性宫颈炎患者与CINs 的阳性染色率均显著低于浸润性SCC,随着宫颈病变的加重而表达升高。Pang等[8]发现HMGB1 的表达是随着宫颈病变的进展而显著性上升,与FIGO 分期、淋巴结转移显著相关。本研究结果与上述一致,HMGB1 在SCC 组中mRNA 水平均显著高于正常宫颈组和SIL 组(P=0.001,P=0.038),且SCC 组显著高于SIL 组(P=0.039)。HMGB1 在H8 细胞中mRNA 水平显著低于SiHa 细胞(P=0.005)。说明HMGB1 在SIL 和SCC 组织中、H8 和SiHa 细胞中的表达趋势是一致的,随着宫颈病变程度的加重,HMGB1表达逐渐升高。
3.3 PCNA表达与SIL的关系
研究发现,PCNA 在Base excision repair通路中是HMGB1的下游分子,敲低HMGB1可抑制PCNA表达,抑制癌细胞的增殖、迁移及侵袭[18-20]。PCNA是细胞增殖的标志蛋白,在肿瘤中可作为反映增殖程度与判断预后的重要指标。Wang 等[21]发现PCNA 在正常宫颈和炎症性宫颈为阴性表达,在CIN组(63.2%)和SCC组(100%)中表达显著增加,并预测PCNA 可能是CC 进展的临床标志物。但Branca等[22]在正常宫颈中发现PCNA 的表达,认为不可将其作为CC 筛选的潜在指标,还发现上调PCNA 表达与HR-HPV 和CIN 进展密切相关,但不能预测CIN 治疗后HR-HPV 的清除。本研究发现,PCNA在SCC组中的表达均显著高于正常宫颈组和SIL组(P=0.033,P=0.004),但正常宫颈组和SIL 组中的PCNA表达比较,差异无统计学意义(P=0.967)。H8细胞中的mRNA 水平也显著低于SiHa 细胞(P=0.045)。说明与HMGB1 的表达一致,PCNA 在SIL和SCC 组织、H8 和SiHa 细胞中的表达也是随着宫颈病变程度的加重而逐渐升高的。
3.4 miR-34a表达与患者临床病理特征的关系
本研究发现,相比HPV 阴性的SIL 及SCC 组织,HPV 阳性的组织中miR-34a 的表达显著降低(P<0.05)。Gocze等[7]报道miR-34a在CIN I进展为CIN Ⅱ~Ⅲ和CIN Ⅱ~Ⅲ进展为CC阶段均与HPV16阳性显著相关。Geng 等[11]发现HR-HPV 阳性的正常宫颈组织、CIN组织及CC组织中miR-34a均显著下调,并向Hela 和SiHa 细胞转染miR-34a,细胞活力和集落形成能力均显著下降。同时,本研究还发现,有淋巴结转移者miR-34a 表达显著下调(P=0.015)。Wang等[23]研究发现miR-34a低表达与肿瘤分化程度、淋巴结转移及FIGO 分期相关,miR-34a低表达的患者预后较差,并预测miR-34a可作为CC诊断和预后的参考指标。
综上所述,随着宫颈病变程度的加重,miR-34a的表达逐渐降低,下调的miR-34a 调控HMGB1 表达的能力下降,HMGB1 表达的增强促进其下游分子PCNA表达升高,进一步促进细胞恶性增殖,抑制P53抑癌通路,促使细胞发生癌变和转移。同时,H8细胞和SiHa细胞上验证miR-34a、HMGB1和PCNA的表达趋势与组织一致。miR-34a、HMGB1 及PCNA有望成为预警SIL进展的新靶标。
