鸭源性H6N6禽流感病毒对小鼠致病性研究*
2021-05-25李程颐林裕贵钟伟娟高灵茜张增峰
李程颐,林裕贵,钟伟娟,高灵茜,张增峰
(广西医科大学基础医学院微生物学教研室,南宁 530021)
禽流感病毒(avian influenza virus,AIV)H5N1、H7N9、H5N6 持续不断地从禽类跨越种属屏障感染人,对人类健康构成严重威胁[1-4]。同时,H6N6亚型AIV 在欧亚大陆的野生水禽、家养水禽以及陆禽广泛流行,其宿主范围逐渐扩大至哺乳动物猪[5],病毒持续进化是否演化为感染人的潜能仍未完全清楚。本文将分离到的鸭源性H6N6亚型AIV进行基因测序和分析病毒基因特点,然后将病毒感染小鼠,观察病毒对小鼠的致病性以及具有感染小鼠能力的病毒的分子特性,评估鸭源性H6N6 亚型AIV跨种属传播哺乳动物的潜能。
1 对象和方法
1.1 病毒来源 选用从水禽鸭分离到的3株H6N6亚型 AIV,包括 A/DK/KM/1135/2019(简称KM1135)、A/DK/GY/1774/2019(简称GY1774)、DK/GY/6952/2019(简称GY6952)。选择先前已证实能感染小鼠的A/CK/ZZ/346/2014(简称ZZ346)作为小鼠感染试验的阳性对照毒株。4株病毒在10 d无特定病原体的鸡胚分离培养。血凝抑制(hemagglutination inhibition,HI)试验鉴定病毒血凝素(hemagglutinin,HA)亚型,直接测序法鉴定病毒神经氨酸酶(neuraminidase,NA)亚型。
1.2 TCID50(50% tissue culture infective dose)检测病毒毒力 首先在96孔板接种MDCK细胞,第2天在37 ℃条件下,用10 倍系列病毒浓度吸附MDCK细胞1 h,然后吸掉病毒孵育液,Hank’s液清洗细胞一遍,每孔加入含有终浓度为2 μg/mL TPCK(tosylamido-2-phenyl ethyl chloromethyl ketone)-胰酶的病毒培养液DMEM,37 ℃孵育72 h,最后检测用HA试验检测病毒的滴度。根据Reed和Muench方法对病毒滴度进行计算,计算病毒的TCID50/100 mL。
1.3 基因测序和分析 RNeasy 试剂盒提取病毒RNA并逆向转录,PCR反应扩增,纯化产物,采用Illumina 的Solexa 系统上机测序病毒全基因,使用全球共享流感数据库准备相关病毒数据,用Bioedit进行序列比较和同源性分析3 株H6N6 病毒8 个基因节段氨基酸位点的变化,重点分析与受体特异性相关的HA 第224、第226、第228、第186、第190、第158、第137、第156、第263和第318位氨基酸以及与病毒复制和毒力相关的PB2 第627、第271、第701位氨基酸。
1.4 动物和动物感染试验 60 只6~8 周龄的SPF级BALB/c小鼠购自北京维通利华实验动物技术有限公司。所有动物鼻咽拭子接种MDCK 证实没有流感病毒,HI检测血清流感病毒抗体阴性。本研究获得广西医科大学动物伦理委员会的批准,动物实验在生物安全二级实验室中进行,动物实验过程中严格遵守本单位对实验动物的护理和使用指南。为探索H6N6AIV 在小鼠体内的复制,通过随机数发生器将60 只BALB/c 小鼠分为5 组(n=12),实验组分别接种1 株H6N6 病毒,阳性对照组接种鸡源H6N6 病毒,空白对照组用PBS 代替病毒液。动物麻醉后通过滴鼻的方式接种,每只动物接种0.2 mL 106EID 含病毒PBS 或0.2 mL PBS。接种后14 d 内每天记录动物体重、体温、疾病症状。接种后1 d、3 d、5 d、7 d取动物咽拭子,标本在鸡胚和MDCK分离培养病毒。接种后3 d、5 d、7 d 分别用颈椎脱臼法处死每组3 只小鼠,收集气管、肺组织,每份组织标本分成两份,一份研磨、离心取上清液,鸡胚和MDCK分离培养病毒,另一份放入10%福尔马林溶液室温下固定24 h,用于病理学检查和病毒蛋白的检测。接种后14 d,眼球采血、收集血清,HI试验检测恢复期血清抗体。
1.5 病理学检查和病毒蛋白抗原检测 取上述麻醉安乐处死小鼠的呼吸道组织,组织固定、脱水、包埋,连续切片,切片厚度为4 μm。切片常规苏木精-伊红(HE)染色,光学显微镜下观察病理变化。免疫组化法检测病毒蛋白抗原如前所述,高温高压抗原修复,阻断内源性过氧化物酶,滴加一抗抗流感病毒核蛋白(NP)的小鼠单克隆抗体(1∶2 500),4 ℃冰箱孵育过夜,然后滴加二抗(1∶50)山羊抗鼠IgG特异性生物素复合物,DAB显色,苏木精复染。
2 结果
2.1 基因测序和分析结果 3株病毒株HA连接位点为单碱性氨基酸连接点PQIETG/GL,属于低致病性模式。3 株病毒株HA 的主要的受体结合位点224、226、228、190、137 位点未发生突变,仍具有与禽源受体结合的特性。3 株病毒的NA 颈区未见突变或氨基酸缺失,具水禽源性病毒的特点。PB1-F2关键位点66以及PA关键位点38的氨基酸未发生变化,仍表现出在禽类动物复制、流行的性状,见表1、表2。
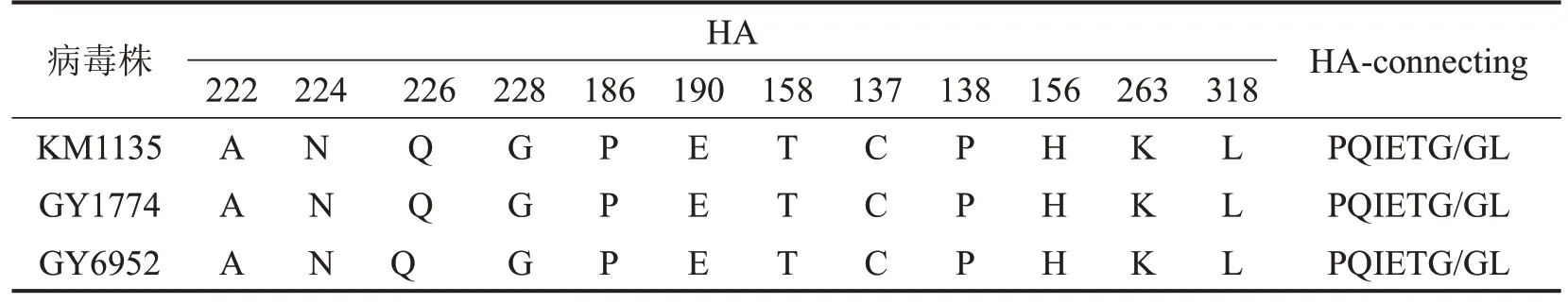
表1 3株鸭源H6N6病毒的HA氨基酸序列

表2 3株鸭源H6N6病毒的NA、PB2、PB1-F2氨基酸序列
2.2 H6N6 亚型AIV 接种BALB/c 小鼠后病毒分离培养和血清抗体检测结果 H6N6 亚型AIV 接种BALB/c 小鼠后,小鼠活动减少、饮食减退、被毛较粗乱,体温正常,未出现疾病症状和体重下降。在咽拭子标本当中,接种KM1135病毒株后,有3只(3/12)小鼠鸡胚病毒分离培养阳性,接种GY1774毒株后有1 只小鼠阳性(1/12),接种GY6952 毒株后,所有的小鼠均未分离到病毒。在小鼠鼻甲、气管、肺研磨液中,KM1135 病毒株接种的小鼠鸡胚病毒分离培养阳性,以鼻甲、肺组织最为明显;GY1774 接种的小鼠中,3只小鼠病毒分离阳性,其它动物病毒分离阴性;GY6952 仅有1 只小鼠病毒分离阳性,其它动物病毒分离阴性;MDCK 细胞分离结果为KM1135病毒株感染的小鼠鼻甲、气管、肺研磨液分离培养病毒阳性,而GY1774 和GY6952 阴性。因此,鸭源性H6N6病毒能在小鼠复制,但不同的毒株其复制能力有差异。接种病毒后第14 天,采集BALB/c 小鼠血液样本,HI 试验检测血清中流感病毒抗体滴度,结果显示3 株病毒恢复期血清样本抗体阳性,见表3。
2.3 H6N6 亚型AIV 接种BALB/c 小鼠后病理变化和病毒抗原分布 H6N6 病毒接种BALB/c 小鼠后第3、第5、第7 天分别安乐处死3 只小鼠,接种GY1774 和GY6952 的小鼠未观察到明显的大体病变,而在接种KM1135后5 d,左肺出现一个1 cm2×1 cm2的轻微充血灶。显微镜下观察组织切片,发现KM1135 和GY1774 感染小鼠的鼻甲、气管分别出现不同程度的气管黏膜充血、水肿,黏膜上皮损伤、坏死,少量炎细胞浸润。而GY6952 感染小鼠的鼻甲、气管未见明显的病变。3株病毒接种的小鼠,小鼠肺组织显示,同程度小血管扩张充血、红细胞渗出,炎症细胞浸润,肺泡壁和小叶间隔变宽等病理变化。

表3 H6N6病毒接种BALB/c后14 d血清抗体滴度
免疫组化检测组织切片病毒NP蛋白,KM1135毒株感染的细胞较GY1774 和GY6952 多(图1)。KM1135 毒株接种小鼠后3 d、5 d、7 d,大部分的小鼠的鼻甲、气管支气管以及肺组织流感病毒NP 蛋白阳性;GY1774接种的小鼠中,有1只鼻甲,另1只在气管、支气管中也能检测出的病毒NP蛋白阳性,但在肺泡组织中未见NP 蛋白抗原表达。而GY6952 接种小鼠的鼻甲、气管支气管和肺组织均未检测出NP蛋白。
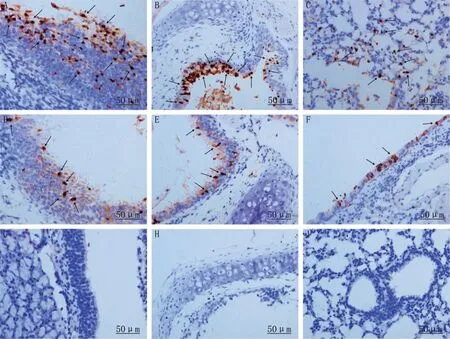
图1 免疫组化检测H6N6病毒接种BALB/c小鼠后病毒NP蛋白
3 讨论
H6亚型AIV在野生水禽和家禽广泛流行,其宿主范围已扩大到哺乳动物猪,已成为家禽、家畜地方性传染病。分子流行病学调查显示,我国2016—2019 年H6N6 亚型AIV 已在家禽(鸭、鸡、鹅)中流行,其中在鸭分离率最高,而家禽鸭在AIV 跨种属屏障传播起重要作用[6]。流感病毒HA 蛋白头部的受体结合位点可特异性地识别与结合禽型SAα-2,3Gal受体和(或)人型SAα-2,6Gal受体,但不同AIV亚型受体结合特异性转变的分子机制并不完全相同。在H6病毒中,H6N1病毒的HA一些位点突变,如S137N、E190V、G228S突变在使病毒获得人型受体结合能力过程中起到关键作用[7-8]。本研究3 株H6N6 病毒的HA 受体结合位点137、190、228 位点未发生突变,仍具有与禽源受体结合的特性。NA的突变或缺失可能有利于病毒适应新的宿主环境,从而突破宿主种间屏障[9],Li 等[10]最近报道一些H6N6亚型AIV出现NA茎区氨基酸缺失,但本文所选的3 株鸭源病毒的NA 颈区未见突变或氨基酸缺失。PB2的T271K、E627K、D701N能提高多聚酶活性,有助于增强病毒对哺乳动物的致病性和传播力,但在本实验和文献报道[5,11]中均未观察到H6N6病毒的PB2 这些位点替换。上述基因测序分析提示,鸭源H6N6病毒仍属于AIV的基因特点,特别是其HA与AIVSAα-2,3Gal受体结合。
家鸭易于接触流感病毒“基因库”—野生水禽,病毒在其体内适应后可将病毒传播给陆禽或哺乳动物,因此,家鸭在流感病毒生态系统中起非常重要作用。那么,鸭源H6N6 病毒是否在哺乳动物复制、感染?本研究选择上述鸭源H6N6 亚型AIV 接种BALB/c 小鼠。结果显示,3 株鸭源H6N6 流感病毒可感染小鼠,其中,KM1135 病毒株最为典型。KM1135 病毒株接种小鼠后其呼吸道鼻甲、气管和肺组织分离病毒阳性,组织病理检查显示小鼠气管黏膜上皮细胞坏死、脱落,肺组织出现炎症反应,呼吸道鼻甲、气管至肺泡组织细胞内病毒NP 蛋白阳性,第14 天小鼠血清样本抗体阳性,表明病毒能在小鼠体内有效复制并引起感染。GY1774病毒株接种小鼠后,少数小鼠呼吸道组织研磨液病毒分离培养阳性,病理学显示小鼠气管上皮细胞坏死脱落,但是肺组织未见明显病理改变,2 只小鼠鼻甲或气管、细支气管上皮细胞内病毒NP蛋白阳性,而肺组织NP 蛋白分布阴性。本研究结果表明,一些鸭源H6N6病毒可以直接跨种属感染小鼠,与Wu等[12]报道的一些H6N6病毒无需适应即可在小鼠有效复制的结果一致。因此,鸭源H6N6AIV 无需适应可以直接跨种属屏障感染哺乳动物,甚至可能感染人。
2013 年5 月20 日,台湾发现全球首例人感染H6N1 禽流感病例[13],人感染H6N1 患者病例的出现,表明人群中的流感病毒的不可预测性和新发病毒的潜在威胁。研究表明,引起世界性大流行的流感病毒由AIV基因片段和人(或)猪基因片段重配演变而来[14],但重配病毒中的AIV 不一定是高致病性AIV。而且,低致病性病毒感染引起的轻度症状容易被忽视,使病毒传播、适应性改变和重配的机会增加。目前,防控流感大流行主要集中在引起人类严重疾病和死亡的AIVH5N1和H7N9亚型。然而,由于不可预知性和现有相关知识的缺陷,无法预测哪类亚型的流感病毒会导致下一次流感大流行,H6N6 亚型虽属低致病性病毒,但其在禽类广泛流行,有反复感染猪并发生变异进而演变成传播人的新型流感病毒的潜能。因此,本研究证实,鸭源H6N6亚型流感病毒无需适应可跨种属间屏障直接感染小鼠。提示必须持续、密切监测家禽H6N6 病毒的进化演变,以防其传播给人。
