2-DG抑制糖酵解和线粒体自噬调控M1型巨噬细胞极化*
2021-05-25蓝春花陈成英王新航常升搏小吉袁江浪孔星星陆彩玲李习艺
蓝春花,陈成英,蓝 利,2,王新航,2,常升搏小吉,2,袁江浪,孔星星,陆彩玲,李习艺,唐 深,2△
(广西医科大学 1.基础医学院;2.广西高校基础医学研究重点实验室;3.公共卫生学院,南宁 530021)
2-脱氧-d-葡萄糖(2-deoxy-D-glucose,2-DG)是一种葡萄糖类似物,可用作葡萄糖代谢的竞争性抑制剂,通过影响细胞的糖代谢发挥调节细胞分化及周期等生物学作用[1-2],具有抗炎、抗肿瘤等作用。有研究报道,2-DG和脂多糖(LPS)共刺激小鼠腹腔巨噬细胞,抑制己糖激酶(HK)的活性和下调M1分化过程中糖酵解信号通路Glut1 的质子产生率,减少促炎因子的分泌[3]。
巨噬细胞是介导炎症的关键细胞,通过趋化聚集在不同的炎症微环境中,产生高度可塑性并极化诱导适宜的免疫反应有效调控炎症[4]。巨噬细胞极化是一个M1和M2双向的复杂过程,受多种因素调控,巨噬细胞功能状态与其代谢谱密切相关,如M1型巨噬细胞代谢主要以无氧糖酵解和磷酸戊糖途径为主,这利于M1型巨噬细胞清除细菌感染[5]。线粒体是细胞内有氧供能的主要细胞器,可调控细胞多种生理活动,其数量和功能失调会导致细胞内异常的线粒体累积和活性氧(ROS)生成增加,诱导细胞凋亡和坏死[6];线粒体自噬是细胞清除损伤线粒体,维持线粒体正常功能的主要途径[7]。文献报道,2-DG可诱导细胞自噬从而抑制嗜肺军团菌的生长,有助于提高小鼠巨噬细胞抗嗜肺炎菌感染的保护作用[8]。上述研究提示2-DG 发挥抗炎作用的机制可能是调节巨噬细胞的炎症极化,但具体分子机制仍未明确。本研究以人髓系白血病单核细胞(THP-1)构建体外M1 型巨噬细胞极化模型,初步探讨2-DG 通过糖酵解和线粒体自噬调控M1 型巨噬细胞炎症极化的分子机制。
1 材料与方法
1.1 细胞和主要试剂 人急性单核细胞白血病细胞系THP-1细胞(中国科学院典型培养物保藏委员会细胞库)。2-DG(中国MCE);佛波酯(PMA,美国Sigma);干扰素(IFN)-γ(北京Sino-Biological);RPMI1640 培养液、胎牛血清(美国Gibco);青霉素、链霉素、LPS、丙酮酸激酶(PK)、HK、乳酸脱氢酶(LDH)检测试剂盒(索莱宝生物技术);RNA逆转录试剂、TRIzol(日本TaKaRa);实时荧光定量PCR(qPCR)引物由Invitrogen 公司合成;SYBR®Green Master(美国Roche);蛋白裂解液、兔抗人微管蛋白(Tubulin)单克隆抗体购自碧云天公司;鼠抗人自噬启动蛋白Beclin-1 抗体、PTEN 诱导激酶1(PINK1)抗体购自Santa Cruz 公司;HRP 标记山羊抗兔IgG、HRP标记山羊抗小鼠IgG购自北京中杉金桥公司。
1.2 细胞培养与分组 THP-1 细胞用含10%胎牛血清、100 μg/mL 链霉素、100 IU/mL 青霉素的RPMI1640 培养基培养,置于37 ℃、5%CO2培养箱中。按1×106个/孔的细胞密度接种于6 孔板,分为3 组:M0 组(100 nmol/L PMA 刺激48 h 极化为M0 型)、M1 组(M0 组基础上用10 ng/mL LPS 和20 ng/mL IFN-γ共刺激48 h诱导极化为M1型)、M1+2-DG组(M1组基础上加入10 mmol/L 2-DG)。
1.3 qPCR法检测M1型极化相关基因表达 TRIzol提取细胞总mRNA,逆转录为cDNA,用Step One荧光定量PCR 仪(美国Thermo Fisher Scientific 公司)进行PCR扩增。PCR反应条件:95 ℃预变性10 min;95 ℃变性30 s,60 ℃退火10 s,共40 个循环。引物序列如下:β-actin 上游:5’-TCCTCTCCCAAGTCCACACAGG-3,下游:5’-GGGCACGAAGGCTC ATCATTC-3’;白介素(IL)-6 上游:5’-ACTCACCTCTTCAGAACGAATTG-3’,下游:5’-CCATCTTTGGAAGGTTCAGGTTG-3’;肿瘤坏死因子(TNF)-α上游:5’-GAGGCCAAGCCCTGGTATG-3’,下游:5’-CGGGCCGATTGATCTCAGC-3’;环氧化酶(COX)-2 上游:5’-GCCATGGGGTGGACTTAAATCATA-3’,下游:5’-CAGGGACTTGAGGAGGGTAGATCA-3’;CXC 趋化因子配体10(CXCL-10)上游:5’-TCTCCCATCACTTCCCTACA-3’,下游:5’-CAGGGTCAGAACATCCACTA-3’。以β-actin 为内参,采用2-△△Ct法计算目的基因相对表达量。
1.4 巨噬细胞内糖酵解相关酶(PK、HK、LDH)活性 检测弃去培养基后用预冷的PBS缓冲液洗2遍,每孔加入200 μL HK(PK或LDH)提取液,将细胞刮下并收集于1.5 mL EP 管内,在冰浴条件下超声裂解细胞,4 ℃离心10 min,取上清液。按照试剂说明书检测PK、HK和LDH活性,酶标仪检测吸光值。
1.5 巨噬细胞溶酶体、线粒体荧光信号强度检测按上述实验分组,每组设6个复孔,极化完成后弃上清,加入100 μL/孔荧光探针工作液,置于细胞培养箱 孵育30 min,PBS 洗3 次,加入100 μL/孔Hank’s 溶液,荧光酶标仪检测荧光信号强度(溶酶体荧光信号:激发光525 nm,发射光590 nm;线粒体荧光信号:激发光490 nm,发射光535 nm)。
1.6 Western blotting 法检测巨噬细胞线粒体自噬相关蛋白表达 提取细胞总蛋白,BCA 法蛋白定量;SDS-PAGE 分离蛋白,转移至PVDF 膜,5%脱脂牛奶封闭1 h;一抗置于4 ℃冰箱孵育过夜:Tubulin(1∶2 000)、Beclin-1(1∶1 000)、PINK1(1∶1 000),TBST 洗膜3 次;二抗(1∶2 000)室温孵育2 h,TBST洗膜3次;暗室中电化学发光法(ECL)显色,凝胶成像系统中曝光。Image J软件分析蛋白条带灰度值。
1.7 细胞内ROS 检测 按上述实验分组,每组设6 个复孔,同时设置阳性对照组(阳性对照试剂为Rosup,于37 ℃培养箱内预处理25 min);极化完后用PBS 洗3 次,加入DCFH-DA 工作液100 μL/孔,置于细胞培养孵育20 min;PBS洗3次,加入100 μL/孔Hank’s 溶液,荧光酶标仪检测荧光信号强度(激发光490 nm,发射光535 nm)。
1.8 统计学方法 所有数据采用SPSS 23.0统计软件进行分析,计量资料以均数±标准差()表示,多组间比较采用方差分析,组间两两比较采用LSDt检验,以P<0.05为差异有统计学意义。
2 结果
2.1 2-DG 对M1 型巨噬细胞极化相关基因表达的影响 与M0 组相比,M1 组TNF-α、IL-6、CXCL-10和COX-2 mRNA表达升高(均P<0.01);与M1组相比,M1+2-DG 组TNF-α、IL-6、CXCL-10 和COX-2 mRNA表达降低(均P<0.05),见图1。

图1 3 组TNF-α、COX-2、IL-6、CXCL-10 mRNA 表达水平比较
2.2 2-DG 对M1 型巨噬细胞糖酵解相关酶活性的影响 与M0 组相比,M1 组PK、HK 和LDH 活性增加(均P<0.01),与M1组相比,M1+2-DG组PK、HK和LDH活性降低(P<0.05,P<0.01),见图2。
2.3 2-DG 对M1 型巨噬细胞极化过程中线粒体和溶酶体荧光信号的影响 与M0 组相比,M1 组溶酶体的荧光信号增强,线粒体荧光信号减弱(P<0.01);与M1组相比,M1+2-DG组溶酶体荧光减弱,线粒体荧光增强(P<0.01),见图3。
2.4 2-DG 对M1 型巨噬细胞极化过程中线粒体自噬相关蛋白表达和胞内ROS 的影响 与M0 组相比,M1 组胞内ROS 升高,自噬启动蛋白Beclin-1 表达升高,线粒体自噬启动蛋白PINK1的表达也升高(P<0.05);与M1 组相比,M1+2-DG 组胞内的ROS降低,Beclin-1 和PINK1 表达均下降(P<0.05),见图4。

图2 3组巨噬细胞内糖酵解相关酶活性比较

图3 3组巨噬细胞内溶酶体和线粒体荧光强度的比较
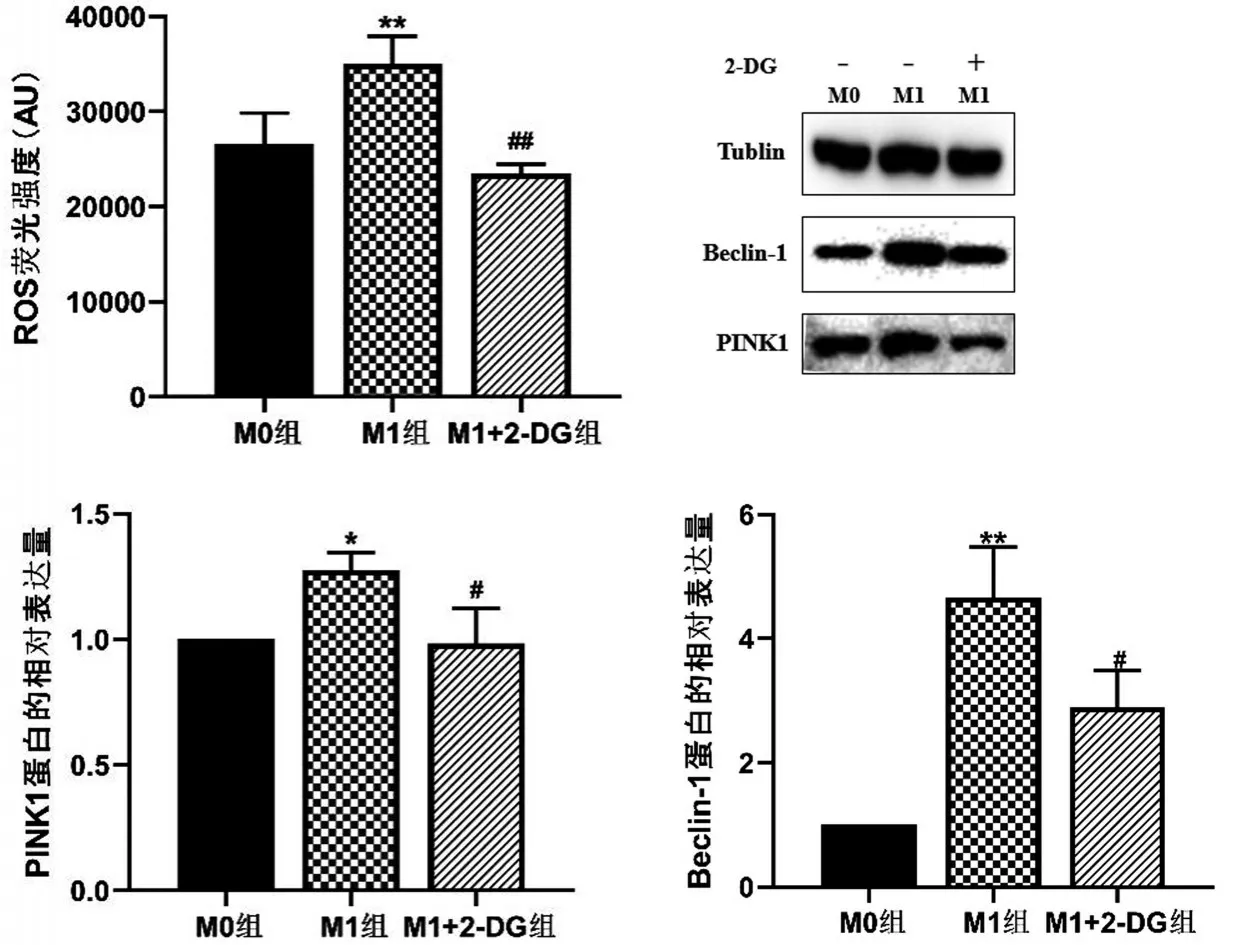
图4 3组巨噬细胞胞内ROS产生及线粒体自噬蛋白表达的比较
3 讨论
巨噬细胞是先天免疫系统中最重要的免疫细胞,负责杀伤清除入侵机体的病原体,启动炎症、清除损伤组织和炎症恢复的组织修复。巨噬细胞具有高度可塑性,通过在不同免疫微环境中极化为不同的活化亚群,主要为经典激活的M1 型和交替激活的M2型巨噬细胞,由M1执行杀伤,而M2执行免疫调节和组织修复功能。二者在执行各自特定的功能时均需巨大的能量支持,糖酵解和氧化磷酸化是免疫细胞在免疫应答中产生ATP 的重要代谢途径。线粒体是真核生物细胞内氧化磷酸化供能最重要的场所,对免疫细胞的分化有重要的调控作用[3,9]。
在LPS诱导的急性肺损伤的小鼠模型中,2-DG可显著减轻小鼠肺组织病理损伤,降低促炎因子TNF-α、IL-1β、NLRP3 的基因表达水平[10]。本研究中2-DG 可降低M1型巨噬细胞极化相关基因IL-6、TNF-α、CXCL-10 和COX-2 的mRNA 表达(均P<0.05),提示2-DG能降低M1型巨噬细胞促炎性因子的表达。有研究报道,2-DG对人血单核细胞来源的巨噬细胞进行预处理后,碱性磷酸钙(BCP)诱导的CXCL-9、CXCL-10、CD40、CD80 和CD86 的表面标记表达显著降低,提示2-DG 可抑制BCP 诱导巨噬细胞的促炎作用[11],这与本研究结果相似。巨噬细胞极化时,通过糖代谢重新编程以满足不同免疫应答微环境的需求,适应感染和肿瘤等不同性质的炎症中免疫反应过程[12]。在LPS或IL-12刺激下,极化的巨噬细胞代谢主要以无氧糖酵解途径为主[13]。本研究结果显示,巨噬细胞在LPS和IFN-γ刺激下,由M0型极化为M1型后,糖酵解关键酶HK、PK、LDH活性均增加(均P<0.05),提示细胞内糖酵解水平增加。2-DG 是糖酵解抑制剂,可被HK 磷酸化为2-DG-磷酸,该产物不能进一步代谢,累积的2-DG-磷酸可抑制细胞糖酵解[14]。本实验结果显示2-DG 处理可以抑制M1型巨噬细胞HK、PK和LDH活性,降低M1型巨噬细胞的糖酵解水平,抑制M1型极化基因IL-6、TNF-α、CXCL-10、COX-2基因表达水平(均P<0.05),这可能是2-DG抑制细胞糖酵解,改变M1型巨噬细胞代谢重编程,负调节M1 极化的重要途径。
线粒体是机体免疫应答的关键角色,在调控巨噬细胞的功能和表型方面起到重要的作用。线粒体荧光探针是一类活细胞内线粒体特异性荧光染料,溶酶体探针是一种带有弱碱性的荧光探针,可以选择性滞留在偏酸性的胞内溶酶体中,特异性标记溶酶体;二者分别能监测巨噬细胞内溶酶体和线粒体活性及数量的动态变化,线粒体自噬是细胞自噬中的一种选择性自噬,可在一系列受体和适配器分子的调控下,对功能性损伤线粒体进行快速协调的清除,主要包括PINK1/Parkin 和线粒体外膜受体介导的线粒体自噬[15]。文献报道小鼠巨噬细胞经LPS诱导分化通过Toll样受体4激活PI3K/AKT/NFκB通路产生大量ROS,进而诱导细胞内自噬及线粒体自噬的发生[16]。本研究结果显示,M0 极化为M1型时,细胞ROS升高,线粒体数量减少,溶酶体增多(均P<0.05),可能是M1极化过程中胞内ROS引起线粒体损伤,溶酶体融合受损线粒体数量增多,同时检测到M1 极化过程中线粒体自噬相关蛋白Beclin-1、PINK1 的表达明显升高(均P<0.05),提示LPS和IFN-γ诱导的M1巨噬细胞代谢重编程后,糖酵解增强,伴随细胞内产生大量ROS,功能性损伤线粒体增多,线粒体定位蛋白PINK1聚集在线粒体外膜上募集Pakin进行泛素化增加[17-18],伴随着自噬特异性Ⅲ类磷脂酰肌醇-3激酶复合物中的Beclin-1增加[19],进一步促进损伤线粒体与自噬体结合,最终导致线粒体自噬水平增加,细胞内线粒体数量明显降低,巨噬细胞向M1型极化,启动炎症反应。文献报道在敲除转谷氨酰胺酶2(TG2)的小鼠胚胎成纤维细胞和人胚胎肾细胞中,2-DG可以抑制细胞糖酵解活性,缓解羰基氰化物间氯苯腙诱导受损线粒体在细胞累积,促进细胞线粒体自噬[20]。这与本实验研究模型不同,2-DG 干预LPS 和IFN-γ 诱导的M1型极化巨噬细胞后线粒体自噬蛋白Beclin-1 和PINK1 表达明显降低,抑制M1 型极化过程中线粒体自噬(均P<0.05)。以上结果表明2-DG 在不同的细胞模型中对线粒体自噬的调控不同,提示2-DG对线粒体自噬可能存在多种调控方式。研究发现受损的线粒体功能失调会产生大量ROS,过量的ROS 可以启动线粒体自噬[18]。2-DG 可以激活AMPK 降低球形脂联素诱导小鼠巨噬细胞细胞系RAW 264.7细胞mTOR磷酸化,降低细胞内ROS的产生[21]。结合本研究结果,提示2-DG可能通过抑制细胞内糖酵解,降低LPS和IFN-γ诱导的M1极化过程产生的大量ROS,减轻线粒体的损伤,与溶酶体融合的受损线粒体减少,从而降低线粒体自噬水平,抑制M1型巨噬细胞的炎症极化,防止过度极化造成的炎症反应。
综上所述,2-DG通过抑制M1型巨噬细胞糖酵解水平,引起细胞体内代谢发生重编程,减少ROS生成,减轻线粒体的损伤,降低细胞线粒体自噬水平,抑制促炎性因子分泌,负调控M1型巨噬细胞炎症极化,本研究为2-DG 作为新免疫调节剂治疗炎症性疾病和肿瘤提供新的理论依据。
