有机金属骨架Mil-88a纳米酶定向清除ROS修复骨关节炎的作用研究*
2021-05-25胡文文王嘉伟张盛清
胡文文,王嘉伟,张盛清,高 明,郑 立
(1.广西医科大学生命科学研究院,南宁 530021;2.广西医科大学第一附属医院,南宁 530021;3.广西生物医药协同创新中心 广西-东盟重大疾病预防协同创新中心,南宁 530021)
骨关节炎(OA)也被称为退行性骨病,其临床症状通常表现为关节肿痛、活动受限等,严重甚至导致关节畸形和肌肉萎缩[1]。在临床上,针对OA主要是缓解疼痛、减少畸形等对症治疗[2]。目前大量基础研究的开展对OA的发生发展有了更近一步的认识,但其具体发病机制仍不清楚。主要认为OA 发病最重要的原因是活性氧(ROS)失衡[3]。因此,一种新型安全有效靶向ROS 失衡的药物亟待被开发。纳米酶是一种与蛋白质类似具有酶活性的纳米材料,Mil-88a 属于金属-有机骨架材料(MOFs)纳米酶家族的一员,具有过氧化物酶模拟物活性和良好的生物相容性[4],因此被认为是清除ROS,促进OA 修复,具有前景的纳米酶修复系统。本研究探讨Mil-88a 纳米酶通过清除ROS 促进OA 修复的作用。
1 材料与方法
1.1 材料和试剂
1.1.1 动物 新生3~5 d 龄、体重约12 g 清洁级SD大鼠,来自广西医科大学实验动物中心,许可证号为SYXK桂2020-0004,已取得广西医科大学实验动物伦理委员会批准。
1.1.2 试剂 无水氯化铁(FeCl3)(阿拉丁试剂有限公司,上海);富马酸(fumaric acid)(Sigma,美国);无水乙醇(国药集团化学试剂有限公司,上海);纳米四氧化三铁(Fe3O4)(上海麦克林生化科技有限公司,上海);超氧化物歧化酶(SOD)检测试剂盒(Sigma,美国);羟自由基检测试剂盒(北京索莱宝科技有限公司);细胞增殖-毒性检测试剂盒(CCK-8)(赛国生物科技有限责任公司,广州);钙黄绿素(Calcein-AM)、碘化丙啶(PI)(Sigma,美国);过氧化氢(H2O2)(成都金山化学试剂有限公司);组织细胞RNA 小量提取试剂盒(Magon,美国);95%乙醇(广西博恒医疗用品有限公司);抗体白细胞介素-1β(IL-1β)(博士德生物工程有限公司,美国);山羊血清(北京中杉金桥生物技术有限公司);FITC标记山羊抗兔IgG(博士德生物工程有限公司,美国);胎牛血清、高糖培养基(卡迈舒生物科技有限公司,中国)。
1.1.3 仪器与设备 扫描电子显微镜、X 射线多粉末衍射仪(XRD)(Rigaku,美国);热重分析仪(林赛斯上海科学仪器有限公司);纳米粒度及Zeta 电位分析仪(Zetasizer Nano ZS,中国);全波长酶标仪(Thermo Fisher Scientific,美国);梯度PCR仪、定量PCR仪(赛默飞世尔科技中国有限公司);真空离心浓缩仪、多功能台式告诉冷冻离心机(艾本德中国有限公司);电热鼓风干燥箱(上海博迅实业有限公司医疗设备厂);Mili-Q 纯水机(广西南宁市博美生物科技有限公司);傅里叶红外光谱仪、荧光成像分析系统显微镜(OLYMPUS,日本)。
1.2 材料合成
Mil-88a 的制备过程在已有文献的技术上进行改进。首先,称取0.974 4 g(8.4 mmoL)富马酸与2.272 2 g(8.4 mmoL)Fecl3,即n(富马酸/FeCl3)=1∶1。将上述物质溶解于42 mL 的超纯水中后,经过1~2 h 的搅拌,转移到100 mL 的内衬聚四氟乙烯的反应釜中,将反应釜放置在鼓风干燥箱中,在85 ℃下反应2 h。2 h 后取出反应釜,将反应釜置于室温冷却。待反应釜冷却后,将溶液在10 000 r/min条件下离心10 min得到砖红色固体,随后将其倒入烧杯中,用无水乙醇洗涤3 次,再次离心得到固体后,放入真空干燥箱在100 ℃干燥6 h,干燥所得固体即为所述的金属有机骨架Mil-88a,并留作备用。
1.3 Mil-88a的表征
将上述干燥的材料,取一部分粉末分别用于SEM、XRD、TGA、FTIR 表征,另取少量粉末超声分散于超纯水中,用于粒度分析和ZETA电位测量。
1.4 Mil-88a的SOD清除率检测
利用黄嘌呤/黄嘌呤氧化酶体系产生超氧阴离子的原理,按照试剂盒说明书,分别配置WST 工作液和酶工作液。另取一定量的样品粉末配制成一定浓度的母液,在1.5 mL EP 管内与纯水按不同比例混合得到不同浓度的样品溶液,先后加入一定量的WST 工作液与酶工作液,充分混匀后于37 ℃下孵育20 min,充分离心去除材料后测量上清液450 nm处吸光值并与对照组进行比较和计算,每组重复3次。
1.5 Mil-88a的羟自由基清除率检测
利用芬顿反应产生羟自由基,羟自由基与显色剂互相作用的原理,按试剂盒说明书配制不同浓度的Mil-88a 溶液,测量不同浓度下Mil-88a 的羟自由基清除效率,每组重复3次。
1.6 软骨细胞原代培养
软骨组织从5 d 龄的SD 大鼠分离,用含10%双抗的PBS 冲洗去除血块。在37 ℃,用0.25%胰蛋白酶孵育消化1.5 h 后,更换0.02%Ⅱ型胶原酶消化过夜,分离出游离细胞。待游离细胞贴壁后,每两天更换一次培养基,传至P3~P5代使用。
1.7 生物相容性检测
(1)CCK-8法:将100 μL 5×104/mL P3~P5软骨细胞接种于96 孔板中过夜,待细胞贴壁后,更换培养基分别加入100 μL 1 μg/mL、2 μg/mL、5 μg/mL,10 μg/mL、20 μg/mL、50 μg/mL和100 μg/mL培养基重悬的Mil-88a。继续细胞培养箱内培养24 h 后彻底移除培养基,PBS冲洗两遍彻底去除材料,加入按1∶10 配置好的含培养基的CCK-8 110 μL,在37 ℃下培养1 h。孵育完成后小心吸取上清培养基移至新的96 孔板内,用酶标仪测量450 nm 处吸光度。每组重复3 次。(2)细胞活死染色:将5 000 个P3~P5 软骨细胞接种于96 孔板中过夜,待贴壁后更换1 μg/mL、2 μg/mL、5 μg/mL、10 μg/mL、20 μg/mL、50 μg/mL和100 μg/mL Mil-88a共孵育24 h后,去除培养基PBS 冲洗2 次。100 μL Calcein-AM/PI 染色工作液被加入避光培养20 min,PBS去除多余染料,在共聚焦显微镜100倍下随机选取3视野观察。
1.8 PCR检测
将每孔30×104/mL 细胞接种于6 孔板内,培养24 h 后去除旧培养基并用PBS 彻底冲洗,随后加入浓度为450 μmol/L 用无血清培养基配制的H2O2诱导液1 mL,充分诱导细胞后加入等体积的不同浓度的无血清培养基配制的Mli-88a 溶液,继续培养24 h。随后PBS 彻底冲洗去除材料与培养基,提取RNA用于PCR实验。各引物序列,见表1。

表1 PCR的引物序列
1.9 免疫荧光
每孔种植75000个同代软骨细胞于已放置爬片的24孔板中,贴壁过夜后用0.25 mL混有H2O2的无血清培养基37 ℃下对细胞进行氧化应激诱导20 min 后,加入浓度分别为1 μg/mL、2 μg/mL、5 μg/mL、10 μg/mL、20 μg/mL、50 μg/mL 和100 μg/mL Mil-88a 和培养基混合和溶液0.25 mL,再孵育24 h后,用PBS 缓冲液清洗3 次细胞,4%多聚甲醛固定25 min,再用PBS 清洗3 次,然后加入3%的H2O2孵育15 min,PBS 清洗3 次,再与山羊血清一同孵育30 min。封闭处理之后,将稀释后的IL-1β 的一抗(1∶200),滴加在爬片上,4 ℃冰箱过夜孵育。随后,用生物素标记的山羊抗兔二抗(1∶500)和稀释液孵育1 h。最后,用4',6-二脒基-2-苯基吲哚(DAPI)标记细胞核,黑暗条件下孵育10 min,缓冲液清洗3次后,吸走爬片上的水分,用中性树脂封片后,通过荧光显微镜观察和拍照。
1.10 统计学方法采用SPSS统计软件分析数据,计量资料以均数±标准差()表示,组间比较采用t检验。多组间比较采用ANOVA 单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 扫描电镜
电镜显示合成的Mil-88a呈六角杆状,见图1。

图1 Mil-88a电镜图
2.2 XRD表征
Mil-88a 在整个图谱中整体主峰并未出现较大偏移。在6°~15°中出现3 个特征峰,分别是2.8°、10.4°和12.9°,见图2。
2.3 TGA与FTIR表征
Mil-88a 在100 ℃至300 ℃范围中,质量保持率基本不变。FTIR 显示Mil-88a 具有FeCl3与富马酸所有特征峰,见图3。

图2 XRD表征
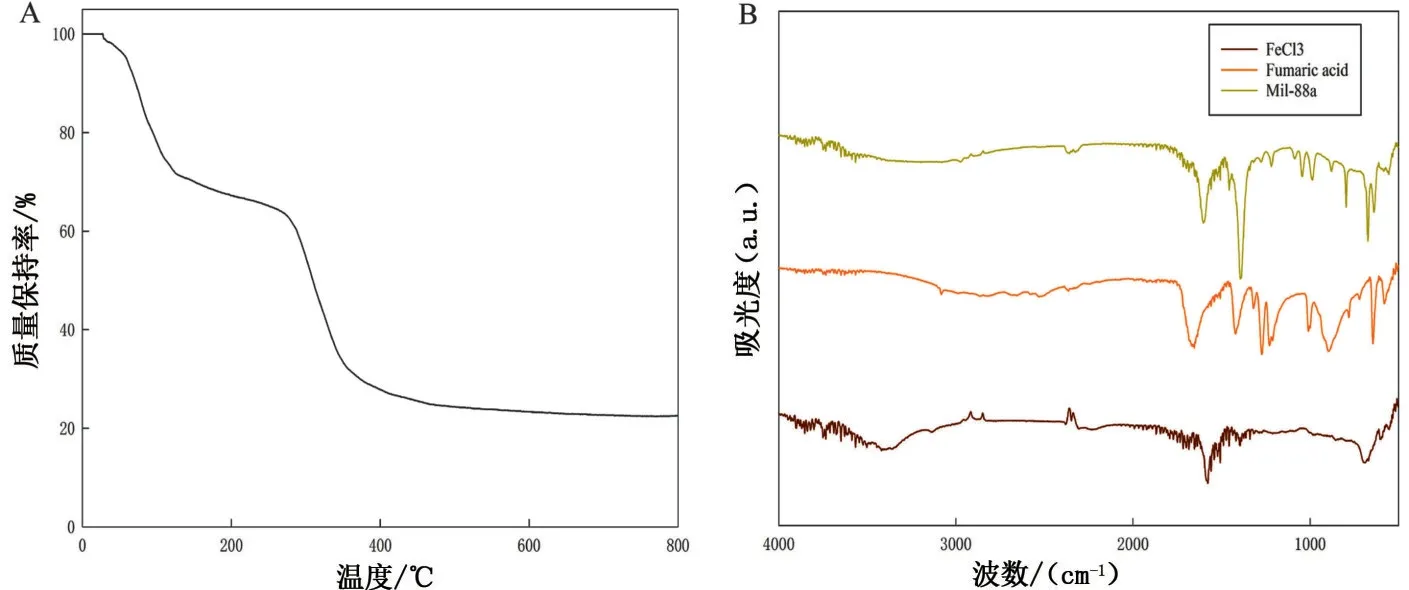
图3 TGA与FTIR表征
2.4 Mil-88a的生物相容性评价
2.4.1 CCK-8 法 当Mil-88a 浓度在1~10 μg/mL时,软骨细胞存活率维持在80%以上,见图4。

图4 Mil-88a不同浓度干预24 h软骨细胞增殖影响
2.4.2 细胞活死染色 当浓度大于10 μg/mL时,对软骨细胞表现较强的毒性(P<0.001),见图5。
2.5 Mil-88a的ROS清除作用
伴随着Mil-88a 浓度升高,Mil-88a 的SOD 清除率逐渐升高(P<0.001),羟自由基清除率与Fe3O4相比具有差异,但清除效率不随Mil-88a 改变(P<0.05),见图6。
2.6 PCR 检测IL-1β、TNF-α、SOD1、SOD2 表达情况
Mil-88a浓度依赖性下调IL-1β、SOD1、SOD2的表达(均P<0.05)。TNF-α 的表达下降(P<0.05),但是不随Mil-88a浓度改变,见图7。
2.7 免疫荧光染色
H2O2诱导软骨细胞IL-1β 表达随着Mil-88a 浓度上升逐渐下降,见图8。
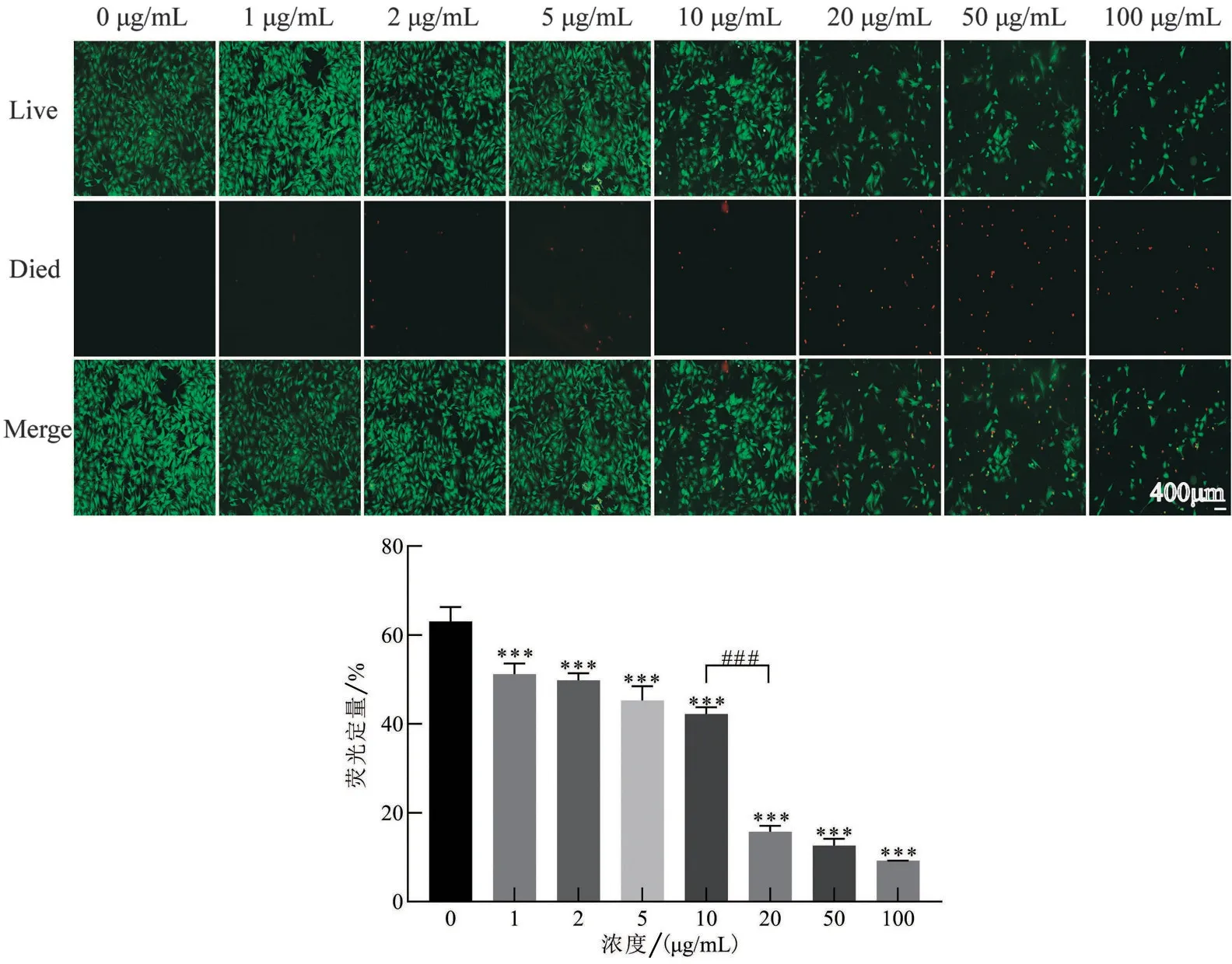
图5 Calcein-AM/PI染色检测Mil-88a不同浓度干预24h软骨细胞活死影响
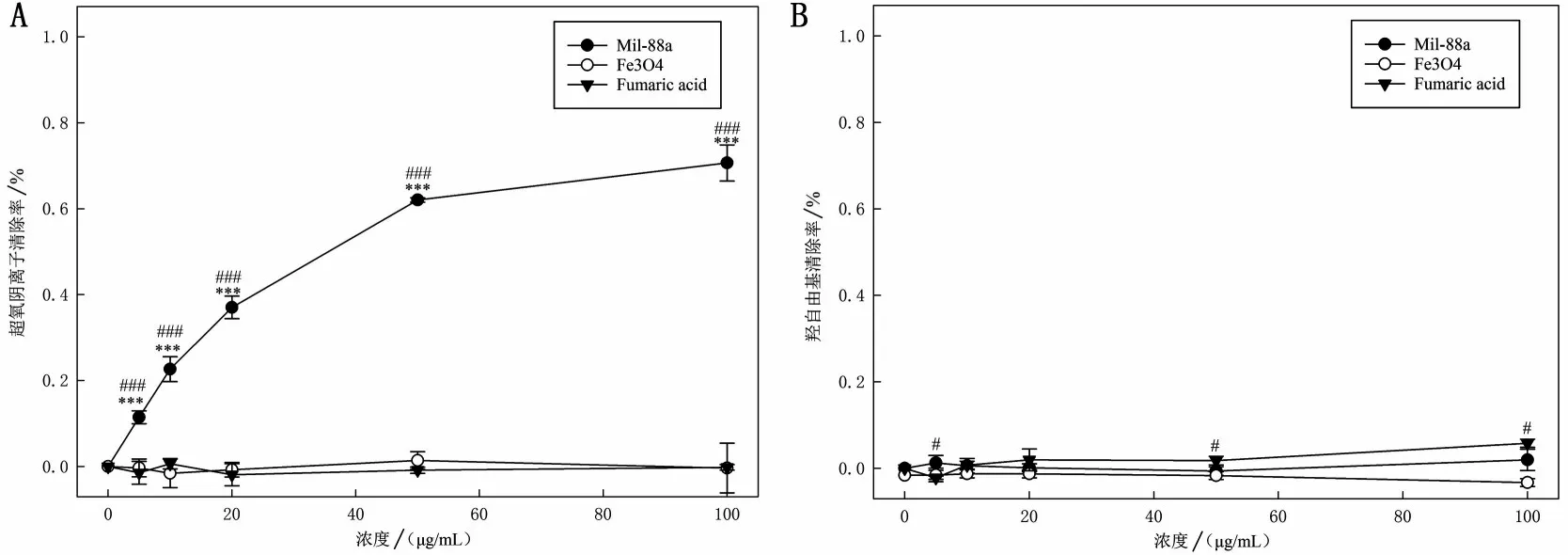
图6 Mil-88a不同浓度24 h对SOD、OH清除率影响
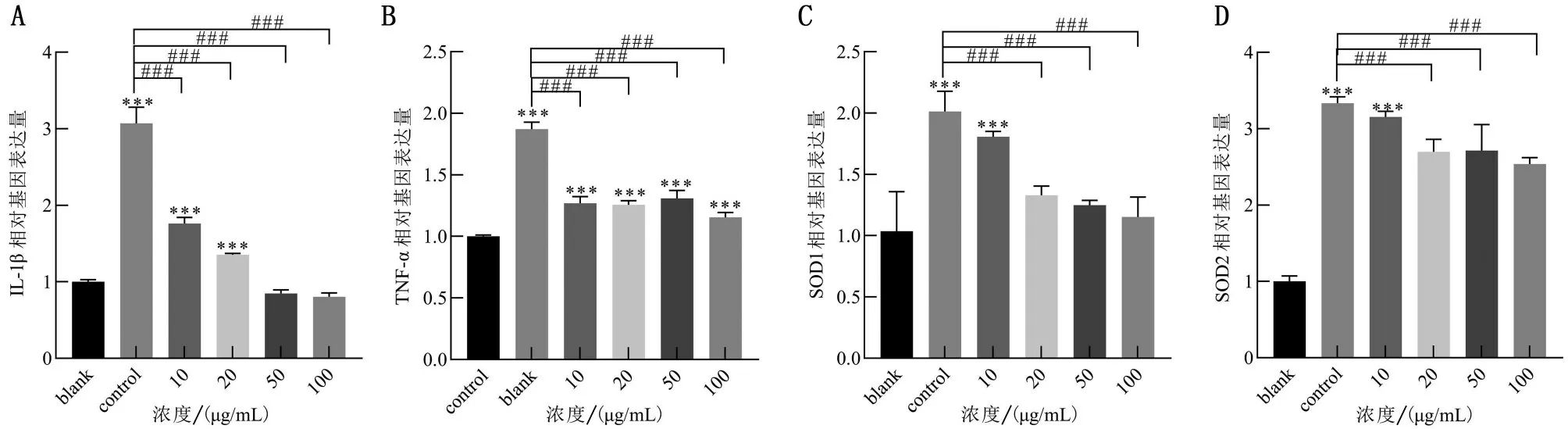
图7 Mil-88a对软骨细胞IL-1β、TNF-α、SOD1、SOD2表达影响
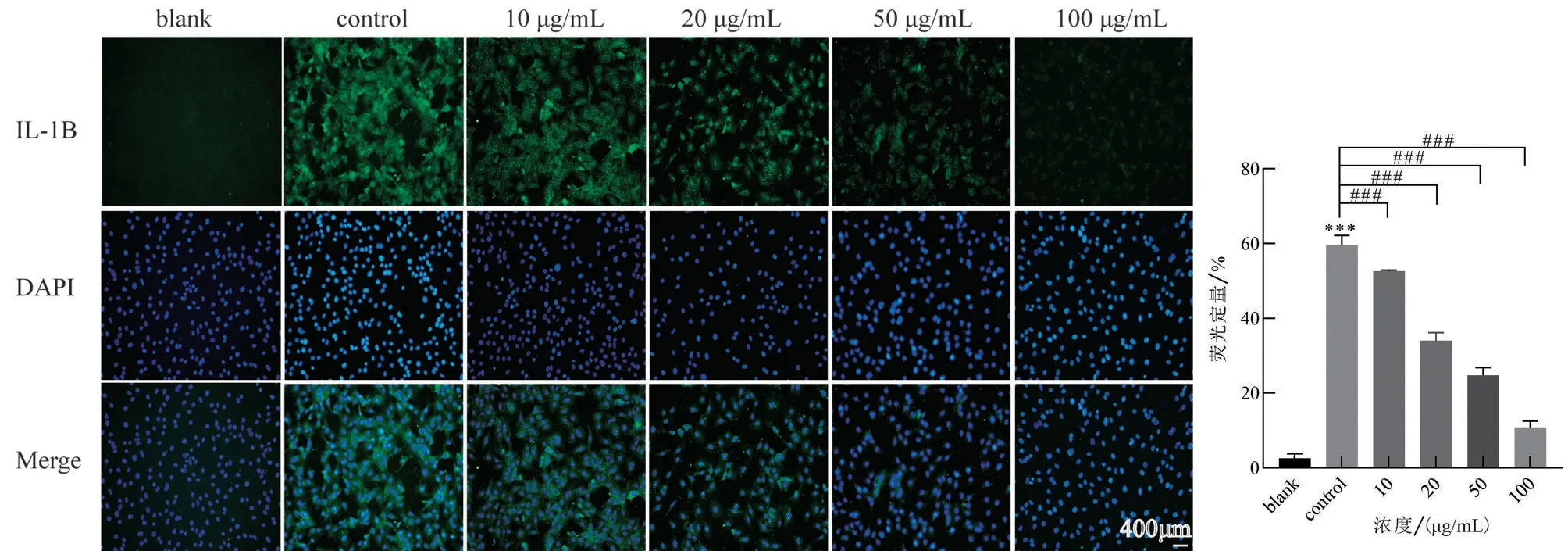
图8 免疫荧光染色观察不同浓度下IL-1β表达情况
3 讨论
在中国大约有16.2%患者长期遭受OA的困扰,难以忍受的疼痛与极高致残率严重影响患者生活质量,破坏影响家庭社会的稳定[5]。虽然进行了大量的基础研究,目前对OA 的病因和发病机制尚无定论,主要认为与年龄、职业、劳损和内分泌等因素有关[6-7],其中过量的ROS是导致关节炎炎性病变的重要因素之一,作为治疗OA的潜在靶点,如何逆转ROS失衡已经成为治愈OA的关键[8]。
MOFs是一种由金属节点和有机配体通过化学键自组装形成具有特殊3D 网络结构的纳米粒子。具有比表面积大,可调节的孔径,稳定的物化性质被认为具有前景的仿生纳米酶[9]。Wu 等[10]报道MOFs 的特殊金属节点结构具有氧化酶类似物活性,被认为清除ROS 的理想纳米酶。在本研究中,Mil-88a 电镜显示呈六角杆状,XRD 在6°~15°出现3个特征峰与先前报道吻合[11]。FTIR具有所有原材料特征峰,TGA证实在100~300 ℃左右Mil-88a仍具有良好的稳定性。为了验证Mil-88a 的细胞毒性,CCK-8 与活死染色提示当Mil-88a 浓度小于10 μg/mL 时基本没有细胞毒性(P<0.001)。总而言之,Mil-88a成功被合成且具有良好的生物相容性。
OA 主要表现为软骨的缺损,减轻软骨细胞的氧化应激与清除过量活性氧的产生将有利于软骨的再生[12-13],ROS包括SOD和OH等[14]。进一步验证Mil-88a的ROS清除率,结果显示,Mil-88对SOD清除率程浓度依赖性(P<0.001),OH清除率不随浓度改变但仍高于Fe3O4(P<0.05),提示可能并不是单单归结于其多孔物理结构清除ROS,具体机制仍有待进一步研究。结局表明,Mil-88a具有作为清除关节腔ROS纳米酶的潜力。
ROS作为调控炎症的重要信号分子,ROS的失衡导致TNF-α 与IL-1β 炎症因子的异常表达,先前文献报道TNF-α与IL-1β与软骨破坏与滑膜炎的发生密切相关[15-17],TNF-α作为软骨胶原生成关键性抑制剂,促进软骨细胞的凋亡,TNF-α的激活通过上调IL-1β的炎症扳机,引起炎症级联瀑布的发生[18]。在本研究中,伴随着Mil-88a 浓度升高下调了软骨细胞炎症因子TNF-α的表达(P<0.001),而IL-1β下调并不随Mil-88a浓度改变(P<0.001)。当Mil-88a浓度大于20 μg/mL 时下调了软骨细胞氧化因子SOD1、SOD2 的表达(P<0.001),然而当浓度大于20 μg/mL 时,SOD1、SOD2 基因的表达并没有进一步的下降。在免疫荧光中与PCR结果一致,Mil-88a下调H2O2诱导软骨细胞IL-1β炎症因子的表达(P<0.001)。
综上所述,本研究成功合成了一种具有抗ROS酶活性的纳米酶Mil-88a,具有良好的生物安全性,能够下调H2O2诱导软骨细胞中氧化和炎症因子的表达,下一步我们将在动物体内治疗关节炎症其安全性和疗效,并探明其清除ROS的潜在机制为临床转化提供可靠的实验依据。
