慢性肾脏病患者血清人附睾蛋白的临床研究
2021-05-24张婷卢发强宗成国丁艳
张婷 卢发强 宗成国 丁艳
在全球范围,CKD的起病逐年提高。CKD的早期诊断及治疗,对于减少CKD并发症的发生,并延缓CKD发展至终末期肾病(ESRD)起着重要的作用。CKD会导致Ca、P代谢紊乱,进而诱发甲状旁腺功能亢进、甲状旁腺激素增加、电解质和骨代谢异常,还能引起免疫功能下降、其他组织异常钙化,其中包括肺、心肌、心脏瓣膜和血管等继发性钙化[1]。本研究通过比较CKD患者血清HE4及Ca、P指标变化,了解CKD相关实验室检查的临床特点。
1 资料与方法
1.1 一般资料 选取2019年1~12月在大连市大连大学附属中山医院住院治疗的各型CKD患者40例作为观察组,另选择40例正常体检者作为对照组。对照组中,男16例,女24例;年龄20~61岁,平均年龄(44.7±8.3)岁。观察组中,男17例,女23例;年龄18~63岁,平均年龄(45.2±9.1)岁。两组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 纳入及排除标准 纳入标准:所有患者近期未服用过会对Ca、P代谢造成影响的药物以及病情加重的情况。排除标准:①急性肾损伤的患者;②存在较为严重的心脑血管性疾病;③患有恶性肿瘤的患者;④不能按时随访。
1.3 方法 所有项目的测定严格按照《全国临床检验操作规程》第3版的要求进行[2]。抽取空腹血液标本,尽快分离血清。采用雅培i2000全自动化学发光免疫分析仪及强生VITROS 5600全自动生化免疫分析仪,HE4测定为雅培公司配套试剂;Ca、P、Scr测定为强生公司配套试剂,相应的校准品、控制品均购自所用仪器公司配套试剂。
1.4 观察指标 比较两组血清HE4、P、Ca、Scr浓度及恶心、水肿症状发生情况。
1.5 统计学方法 采用SPSS19.0统计学软件处理数据。计量资料以均数±标准差()表示,采用t检验;计数资料以率(%)表示,采用χ2检验。P<0.05表示差异有统计学意义。
2 结果
2.1 两组血清HE4、P、Ca、Scr浓度比较 观察组血清P、Ca水平均低于对照组,血清Scr、HE4水平均高于对照组,差异具有统计学意义(P<0.05)。见表1。
2.2 两组恶心、水肿发生情况比较 观察组恶心、水肿发生率均高于对照组,差异有统计学意义(P<0.05)。见表2。
表1 两组血清HE4、P、Ca、Scr浓度比较()
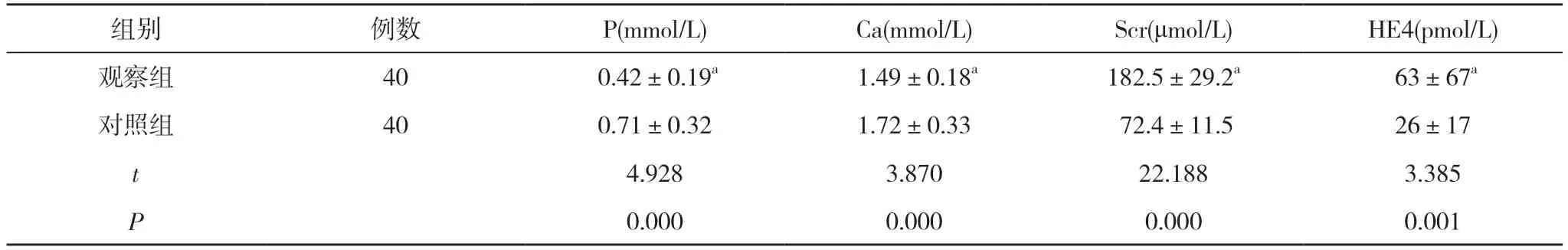
表1 两组血清HE4、P、Ca、Scr浓度比较()
注:与对照组比较,aP<0.05

表2 两组患者恶心、水肿发生情况比较 [n(%)]
3 讨论
CKD临床主要表现为连续性的蛋白尿、肾脏结构改变、排泄性能障碍,证明肾小球功能受损。CKD患者发生心血管疾病的风险和死亡的几率明显增大。对于进展至ESRD的患者来说,肾脏替代治疗(RRT)是最终治疗手段,但其供体的局限性却是一个世界性的问题。出生时肾小球数量偏少,随着年龄增加致使肾小球减少,以及受损于肾毒性药物或某些疾病(比如肥胖和2型糖尿病等)所导致的急性或慢性肾损害为导致CKD病情发展的危险因素。处置CKD患者的关注点主要集中在早期预防、及早发现、避免危险因素、阻止病情恶化,并延缓致使肾小球不断减少的其他因素。而调整血压、克制肾素-血管紧张素(RAS)系统和干扰疾病特异性,是治疗CKD的根本条件。由CKD所导致的并发症,比如贫血、代谢性酸中毒和继发性甲状旁腺功能亢进等,也会导致心血管疾病并危害身体健康,必须予以诊治。CKD是肾功能或肾脏结构或两者兼有的连续的病变并损害机体健康的一组综合征。肾功能异常可表现为继发性高血压、水肿、蛋白尿、尿液排出异常等;这些改变往往能通过检测血清尿素氮、血清Scr、半胱氨酸蛋白酶抑制剂C(CysC)的变化而诊断。肾脏结构的变化则在影像学中所表现的囊肿、肿瘤,或者肾脏形态的畸形和萎缩。若排除初始病因或疾病,CKD最常发生的病理现象就是肾脏的纤维化。世界各地CKD的发病率在6%~13%,中国为1.6%,加拿大为5.3%,澳大利亚为5.7%,美国为7.1%,德国为2.2%,英国为5.3%。中低收入国家由于缺乏大样本研究和标准化的诊断措施,致使CKD的流行病学不甚详细。但医学界注意到,大多数的流行病学调查仅是以肾小球滤过率(GFR)为基础,但忽略了蛋白尿的表现。因为缺乏登记并忽略针对儿童人群的调查,所以临床对儿童的CKD知之甚少。在欧洲,2015年0~13岁儿童ESRD的患病率为5.5每百万年龄相关人口(pmarp)。根据之前的评估,0~13岁儿童的患病率为7.8 pmarp,低于美国0~13岁年龄段的儿童患病率为13.3 pmarp[3]。在发达国家中,先天性尿路疾病(CAKUT)是绝大多数儿童CKD发病的因素;相反的,在中低收入国家中,感染和肾小球的病变等后天原因占据绝大部分。虽然CKD在>60岁人群中更为多见,但年轻人却是更容易进展成为ESRD。而且,尽管女性CKD发病率比男性高,但男性却更轻易进展成为ESRD。与CKD有关的多见的基础疾病是高血压和糖尿病。糖尿病患者中,CKD的发病率约为35%~45%,但至今仍未明确是因为糖尿病直接导致的CKD,还是继发于糖尿病的微小血管硬化所导致的。但在中低收入国家中,CKD与感染、肾小球肾炎以及治疗不当关系密切。随着人口老龄化的不断进展,中低收入国家的CKD患者将显著增加。另外,早产儿和低体重儿的晚期CKD发病率关系密切。CKD高风险的人群中包括澳大利亚土著人、非洲裔美国人、中南美洲的西班牙人、加拿大土著人、南亚人、东亚人和太平洋岛民,这些人群因为遗传因素和环境因素的互相反应形成高危因素。特定类型的CKD提示地域特点的发病原因,但通常很难判断,但怀疑有特殊的感染、毒素、生活方式或气候等有关原因。在拉丁美洲、斯里兰卡、印度、喀麦隆、墨西哥和澳大利亚的甘蔗园和其他从事农业活动的人群中,CKD就来源不明[4]。CKD作为致死的一个主要因素在过去的30年里死亡率明显增多(从1990年的第22位上升至2020年的第16位),现在占全球致残致死性疾病的1.47%,并以每年0.8%的速度增加[5]。这些数据主要来自于肾功能的检查统计,而排除了蛋白尿在CKD的诊断意义。但死亡率跟随表皮生长因子受体(eGFR)的下降而升高,与蛋白尿的水平呈正相关性,接受RRT治疗的死亡率更高。接受透析治疗的患者,其5年生存率是45%~55%,其中血透和腹透的生存率无明显差异。接受肾脏移植治疗后的患者,接受尸体供源的患者其5年生存率是84%,而接受活体供源的患者则升高到94%,其预后更好。透析患者的预期寿命是一般健康人群的35%~40%。Ca、P代谢的紊乱是CKD主要的并发症,尤其是终末期肾病患者。磷主要经肾脏排泄,约75%的磷经肾脏排泄,因此,当GFR下降时,就会出现磷潴留。HE4是乳清酸型的拥有4个二硫键核心域(WFDC)的蛋白,HE4基因编码蛋白的分子量为13 KD,而糖化后的HE4蛋白是含有2个WFDC结构域的单肽,分子量约为20~25 KD。目前研究HE4与组织器官纤维化的仅有肾脏,目前暂时没有HE4与其他组织器官纤维化的有关报道。研究发现,HE4是肾纤维化时,肌成纤维细胞中上升最多的因素。肌成纤维细胞会在导致肾纤维化的进程中起主要作用。HE4来自于纤维化有关的成纤维细胞产生的[5]。肾纤维化患者中血清HE4浓度显著上升,并且还在纤维化的肾组织中的肾小管和肾间质也测量到了HE4。在CKD早期,血P浓度由于PTH的Ca、P调节作用可以保持正常,因此,CKD早期患者血P表现正常。本组研究结果显示,CKD患者中的血清P、Ca浓度产生明显的变化,这说明了在CKD期,可以根据血清P浓度干扰Ca、P代谢紊乱的方法,对病情进行判断,对调整高血P具有显著的价值。同时CKD患者,其血清HE4浓度均增高,血清HE4浓度与Scr关系密切,随着其升高而上升。血清HE4的异常灵敏性和检出率显著优于Scr。
综上所述,在临床上常规检测Scr、P、Ca,联合检测HE4浓度具有重要性的指导意义。目前,坚持合理的Ca、P代谢平衡,已经作为改良CKD患者的存活率与下降死亡率的主要检测方式。但是,对是否能将血清HE4作为一种评估肾小球滤过功能的早期指标,还必须等待大量临床应用研究的证实。
