血管生成素2在脓毒症及肺损伤儿童中的应用研究
2021-05-24陈艳瑛罗兰隆彩霞
陈艳瑛,罗兰,隆彩霞
脓毒症属于一种全身性炎症反应,由感染病原微生物而引起,随疾病进一步发展,会发展成为脓毒症性休克,影响患儿身心健康的同时危及其生命安全。近年来,在多因素的联合作用下,该病临床发生率各病死率显著增高,其中又以儿科最为严重。调查发现,脓毒症现已成为儿科重症监护病房最严重疾病之一[1]。据美国流行病学资料显示,全球脓毒症发病率高达15%~17%,而每年超过10万儿童死于脓毒症,病死率高达48%。据我国权威数据显示,北上广深等一线城市,脓毒症病率为14.5%~35.9%,其中年龄<3岁的患儿,约占75.5%;而随年龄增长,患病比例呈下降趋势[2-3]。自肺损伤被报告以来,就成为了全球医学界关注的焦点,因此也证实了肺损伤的严重性;儿童肺损伤患儿,具有起病急、病情重、病死率高等特征,而脓毒症并发肺损伤儿童,病情更加危重,临床死亡率高达40%~80%[4-5]。经临床研究证实,血管生成素2水平的高低,与内皮细胞功能紊乱等因素密切相关[6]。为进一步探讨血管生成素2在脓毒症及肺损伤儿童血清中的变化情况及临床意义,特择我院2019年7~12月的90例脓毒症患儿进行研究,现分析如下。
1 对象与方法
1.1 研究对象 选择我院2019年7~12月的脓毒症患儿90例,按病情严重程度分为脓毒症组63例和脓毒性休克组27例。脓毒症组中男30例,女33例;年龄3.5~11岁,平均(7.25±2.45)岁。脓毒性休克组中男14例,女13例;年龄3~11岁,平均(7.00±2.55)岁。同期选取健康体检儿童30例为对照组,其中男15例,女15例;年龄3.5~12岁,平均(7.36±2.59)岁。三组研究对象在性别、年龄方面比较差异无统计学意义(P>0.05),具有可比性。
1.2 诊断标准 参照《2012国际严重脓毒症和脓毒性休克诊疗指南》中脓毒症、脓毒性休克、肺损伤的诊断标准[7]。
1.3 纳入标准 (1)临床资料完整、符合脓毒症、脓毒性休克以及肺损伤的诊断标准;(2)年龄3~12岁;(3)家属对此次研究知情且为自愿参加。
1.4 排除标准 (1)凝血功能障碍;(2)严重肝肾功能损伤者;(3)合并严重急性感染者;(4)精神疾病者;(5)呼吸功能不全者。
1.5 方法 提前做好家长宣教,通过家长安抚来确保取样和后期工作顺利开展。当日采集受检者5 mL静脉血,后注入真空采血试管(2%乙二胺四乙酸钠)给予离心处理,转速3 000 r/min,分离血浆并保存-20 ℃冰箱;借助酶联免疫吸附法测定血管生成素2水平。
1.6 观察指标 各组研究对象血管生成素2水平情况及脓毒症、肺损伤患儿血管生成素2水平情况。
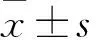
2 结果
2.1 各组研究对象血管生成素2水平情况 见表1。
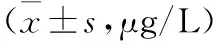
表1 各组研究对象血管生成素2水平情况
表1结果表明,脓毒症、脓毒性休克患儿血管生成素2水平显著高于健康儿童,差异有统计学意义(P<0.05)。脓毒症组血管生成素2水平显著低于脓毒性休克组,差异有统计学意义(P<0.05)。
2.2 脓毒症患儿有无肺损伤血管生成素2水平比较 见表2。
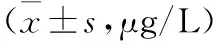
表2 脓毒症患儿有无肺损伤血管生成素2水平比较
表2结果表明,脓毒症并发肺损伤时,患儿机体血管生成素2水平显著高于无肺损伤患儿,差异有统计学意义(P<0.05)。
3 讨论
经临床研究证实,脓毒症由感染而引起,随疾病进一步发展,会诱发全身出现炎症反应;且疾病后期极易引起多器官功能障碍,因此该病严重威胁和挑战患儿生命安全[8]。据报道,约有178种生化指标可在脓毒症患儿体内检测到,但就早期诊断以及预后判断指标而言,目前临床尚未明确。因此对脓毒症患儿,早期开展特异性生物学标志物检测至关重要,是提高临床疗效、改善预后的关键[9]。
血管生成素2及受体作用:血管生成素是近年来临床发现的特异生长因子,参与了血管的生成,可有效促进胚胎心血管发育;不仅如此,血管生成素还与炎症、创伤、肿瘤关系密切。经研究,发现血管生成素共有4个成员,其中参与机体炎症免疫应答的是血管生成素1和血管生成素2,因此血管生成素2也成为目前临床研究的重点[10]。血管生成素2由内皮细胞合成分泌,机体在静息状态下,血管生成素2表达量明显减少,若受炎症刺激,血管生成素2在短时间内会被大量释放,且与血管生成素1竞争并结合含有免疫球蛋白和表皮生长因子同源结构域的酪氨酸激酶2对内皮完整性产生破坏,导致血管渗漏,从而直接影响血管生成素1的作用(减轻血管炎症、稳定内皮细胞)。
借助血管生成素2可有效判断脓毒症病情严重程度和预后:目前临床尚未完全阐明脓毒症发病机制,但有研究表明,脓毒症的发生和发展,与血管内皮细胞功能紊乱因素密切相关。而血管内皮细胞功能紊乱,会导致屏障受损、组织液体外渗,从而引发组织水肿、低蛋白血症等症状。而脓毒症并发肺损伤,是多种损害因素共同作用导致的结局。因此,早期识别脓毒症及其并发症,积极采取防治措施有助于降低脓毒症病死率。脓毒症患儿血液内肿瘤坏死因子α、白细胞介素-6等细胞因子水平表达会上调,增加血管通透性,因此可借助血管生成素2水平来有效判定患儿病情严重程度预后。有研究表明,脓毒症、非脓毒症患儿体内血管生成素2浓度相较,脓毒症患儿体内血管生成素2浓度可升高50倍左右,但血管生成素1并没有明显变化,且脓毒症患儿体内酪氨酸激酶2水平呈明显升高趋势[2,11]。Giuliano等[12]研究发现对脓毒症、脓毒症休克儿童血浆血管生成素2水平进行检测,发现与健康儿童相较,脓毒症休克患儿,体内血管生成素2水平升高明显,血管生成素1水平则出现明显降低。本研究资料中脓毒症组血管生成素2水平高于对照组,脓毒性休克组血管生成素2水平明显高于脓毒症组,3组间血管生成素2水平差异具有统计学意义,这与Giuliano等[12]研究结果一致。本研究结果显示脓毒症并发肺损伤时,患儿机体血管生成素2水平显著高于无肺损伤患儿,证实了借助血管生成素2可有效判断脓毒症并发肺损伤严重程度和预后。提示严重脓毒症患儿血管生成素2水平会呈升高趋势,因此发现血管生成素2是脓毒症血管损伤的重要标志物;而调转录因子可有效抑制血管生成素1对血管的稳定作用,在降低受体含有免疫球蛋白和表皮生长因子同源结构域的酪氨酸激酶2表达的同时抑制血管生成素2作用,减少临床死亡率[13]。
综上所述,血管生成素2现已成为临床新的生物标志物,参与了血管内皮损伤以及血管通透性机制,因此采取有效措施和手段对血管生成素2进行动态检测,可早期评估脓毒症并发肺损伤患儿的病情严重程度,为临床后续治疗提供研究方向。
