伊马替尼致药物性肺损伤一例
2021-05-24樊凤娇何继祥李章坤姜义荣
樊凤娇 何继祥 李章坤 姜义荣
患者,男,31岁。因“咳嗽5天,咯血2天”于2019年2月20日入院。半年前患者于外院确诊为慢性粒细胞白血病(CML,慢性期,Sokal评分低危),3个月前开始口服伊马替尼(每日0.4 g)靶向治疗,未动态监测血常规及BCR/ABL融合基因水平。服药后患者诉有咳嗽,以干咳为主,未予随访。2天前出现咯血,每日1~2次,每次约5 ml,1天后咯血加重,每日约5次,咳血量较前稍增多,无发热、胸闷、胸痛、气促、心悸、腹痛、呕血及黑便等。否认肺结核、支气管扩张等病史及吸烟史。入院体格检查:T 36.0 ℃,P 86次/分,R 20次/分,Bp 135/74 mmHg,贫血貌,皮肤、黏膜未见瘀点、瘀斑,全身浅表淋巴结未扪及肿大,胸骨无压痛,双肺呼吸音清,双下肺闻及少许湿啰音,心率86次/分,律齐。腹平软,无压痛及反跳痛,脾脏肋下2横指可触及。双下肢无水肿。入院查血常规:WBC计数正常,Hb 100 g/L(130~175 g/L),PLT计数92×109/L(125~350×109/L);凝血功能:活化部分凝血活酶时间(APTT)53.3 s((28.0~44.0 s)),纤维蛋白原(Fib)1.94 g/L((2.00~4.00 g/L)),D-二聚体正常;凝血因子全套活性、Ⅷ因子及Ⅸ因子抑制物、血管性血友病相关检查结果均未见异常;多次痰细菌、真菌、结核菌培养结果均为阴性;红细胞沉降率(ESR)、C反应蛋白、降钙素原、真菌D-葡聚糖、曲霉菌抗原、巨细胞病毒、EB病毒、疱疹病毒、甲型(H1N1、H7N9、H5N6)流感病毒检测结果均为阴性;肺炎支原体抗体阴性;结核菌素试验(PPD试验)、结核菌荧光定量、结核感染T细胞试验(T-SPOT)检测结果均为阴性;抗核抗体谱、抗磷脂抗体、狼疮抗凝物、抗中性粒细胞胞浆抗体(ANCA)、抗肾小球基底膜抗体、风湿三项(类风湿因子、红细胞沉降率、抗链球菌溶血素O)、免疫球蛋白、补体等均正常;肿瘤标志物未见异常;胸部CT检查结果示:双肺静脉、支气管动脉未见明显异常,双肺多发阴影,以左下肺为明显,考虑肺泡积血、待排肺部感染(图A)。骨髓穿刺细胞涂片示:骨髓增生活跃,未见原始细胞;骨髓流式细胞学检查结果示:未见表型异常的髓系原始细胞;BCR/ABL(P210)IS定量为0.131%;BCR-ABL1激酶区突变检测结果为阴性;骨髓染色体核型:46,XY,t(9;22)(q34;q11)。入院后予莫西沙星联合伏立康唑抗感染、止血、输注血浆等治疗,但患者咯血症状无改善,2月23日复查血常规示:Hb 68 g/L,PLT计数60×109/L。予患者输注红细胞2 U纠正贫血治疗。期间风湿科会诊考虑不除外ANCA相关性血管炎可能。2月24日开始予患者甲泼尼龙(80 mg每日4次静脉滴注,连续4 d)治疗,但患者咯血症状改善不明显,并出现呼吸困难。2月27日复查胸部CT提示:双肺渗出较前增多(图B)。经科内讨论考虑患者存在药物(伊马替尼)相关性肺损伤可能,予停用伊马替尼,调整为甲强龙(120 mg每日4次)联合环磷酰胺(每日1 g,第1、4 d)治疗,同时予血浆置换(每日1次,共7次)。患者咯血量逐渐减少,呼吸困难好转,3月3日、3月13日复查胸部CT示:双肺渗出较前明显减少(图C、D)。经治疗后患者咯血次数逐渐减少,复查血常规提示Hb 83 g/L,PLT计数39×109/L。出院后继续服用泼尼松(30 mg/d)治疗,规律减量,动态复查Hb、PLT较前进一步升高。3月31日患者再次服用伊马替尼(0.4 g/d)靶向治疗,4月18日再次出现咯血症状,复查血常规示:WBC计数7.75×109/L,Hb 79 g/L,PLT计数71×109/L;复查肝肾功能、凝血功能、自身免疫抗体等指标均未见异常;完善电子纤维支气管镜检查示:所见支气管通畅,双上肺管腔见陈旧性血迹。复查胸部CT示:双肺少许炎症,部分较前减少,部分新发病变,余肺炎症基本消失。予患者停用伊马替尼,改为尼洛替尼(300 mg每日2次)靶向治疗,咯血症状缓解,继续于门诊随诊。至2020年2月12日,患者对尼洛替尼耐受良好,未再出现咯血症状。
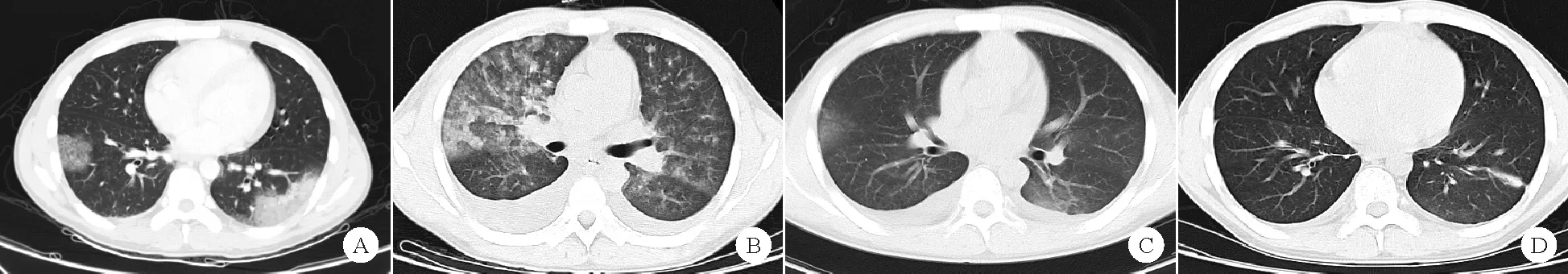
图1 患者肺部CT检查结果(A:入院时;B:2019年2月27日;C:2019年3月3日;D:2019年3月13日)
讨 论
CML是一种造血干细胞异常克隆的骨髓增殖性肿瘤。甲磺酸伊马替尼是国际上第一个批准用于CML一线治疗的酪氨酸激酶抑制剂(TKI),可明显改善CML患者的长期预后。临床发现,伊马替尼通常耐受性良好,其3级和4级非血液学毒性并不常见。文献报道伊马替尼治疗CML慢性期患者的3级和4级肺部不良事件发生率仅为0.2%和1.3%[1]。而伊马替尼致肺出血为突出表现的肺损伤症状更为罕见[2]。药物性肺损伤临床表现多样,而肺出血是药物性肺损伤的一种致命性并发症,其起病时间不定,可于用药后数分钟至数月甚至数年后发生,病情严重时可出现呼吸衰竭甚至死亡[3]。药物性肺损伤尚无明确的诊断标准,其诊断一般通过对比用药与肺损伤发生、转归之间的关系来确定。如停用某种可能导致肺损伤的药物后肺损伤改善,但再次服药后又出现同样的肺损伤症状,在排除其他可导致肺损伤的病因后,可考虑为该药致肺损伤[4]。本例患者既往无基础肺部疾病史,应用伊马替尼治疗后出现肺出血,而停用伊马替尼及强化免疫抑制治疗后肺出血缓解,而再次服用伊马替尼治疗后又出现肺出血,在排除了CML肺部浸润、肺部实体肿瘤、肺血管疾病、自身免疫性疾病、凝血功能障碍及可能的病原体引起的肺部感染后,符合临床上药物性肺损伤的诊断。
迄今为止,关于伊马替尼致肺损伤的机制仍不明确,但非细胞毒性反应或细胞毒性反应被认为是其可能机制[5]。非细胞毒性反应表现为嗜酸性粒细胞性肺炎、过敏性肺炎或阻塞性细支气管炎,而细胞毒性反应表现为间质性肺炎。伊马替尼通过抑制血小板衍生因子(PDGF)受体磷酸化,阻碍Ⅱ型肺泡上皮增生、肺泡上皮修复,从而导致肺损伤。此外,除伊马替尼的直接毒性外,自身免疫因素可能也参与了肺损伤的发生[6-7]。因此,在作出诊断时应根据病史、临床症状、影像学检查及病理结果综合考虑。胸部X线或胸部CT检查可出现多种表现,如超敏反应、间质性肺炎、隐源性组织性肺炎、结节性或支气管血管病变及弥漫性肺泡损害[1]。病理表现也各不相同,包括弥漫性肺泡损伤、非特异性间质性肺炎、嗜酸性粒细胞性肺炎及肺出血[8]。日本的一项研究结果显示,27例接受伊马替尼治疗的CML患者出现了肺损伤出血,有7例患者进行支气管镜活检,其中5例活检结果提示为间质炎症伴组织纤维化,另外2例观察到嗜酸性粒细胞浸润。27例患者均停用伊马替尼,其中24例接受泼尼松治疗(包括19例接受大剂量泼尼松治疗,5例接受中等剂量泼尼松治疗),绝大多数接受泼尼松治疗的患者肺部症状得到改善并恢复[1]。上述结果提示应用糖皮质激素治疗CML有效,间接证明了伊马替尼通过免疫机制诱发肺损伤的可能性。
至今为止,药物性肺损伤无统一的治疗方案。Müller等[4]提出,一旦出现药物相关肺损伤,首先应停用引起肺损伤的可疑药物,对于呼吸衰竭的患者,通常采用大剂量甲强龙(250 mg每6 h 1次)连续治疗3~5 d,若症状好转,调整其剂量为0.5~1.0 mg·kg-1·d-1持续数周,再逐渐减少剂量;当糖皮质激素治疗效果欠佳时,可适当加用其他免疫调节剂,如环磷酰胺、硫唑嘌呤,也可应用新型生物制剂,如利妥昔单抗、肿瘤坏死因子(TNF)-α拮抗剂等,病情危重者可进行血浆置换、免疫吸附、大剂量免疫球蛋白治疗等。该患者入院后咯血症状进行性加重,并出现呼吸困难,胸部CT检查提示双肺渗出及肺泡积血,予及时停用伊马替尼、大剂量甲强龙联合环磷酰胺强化免疫抑制及血浆置换治疗后,患者咯血量逐渐减少,呼吸困难好转,复查胸部CT示双肺渗出较前明显减少,最终咯血症状完全缓解,疗效显著。所以对于病情危重的患者,及时停用致肺损伤的可疑药物是关键,而尽早强化免疫抑制治疗及血浆置换是治疗成功的保障。
因药物性肺损伤经治疗缓解后,再次应用该药物治疗仍可出现同样的肺损伤表现,所以患者在停用伊马替尼后的后续治疗非常关键。相关文献报道患者服用伊马替尼后出现肺损伤,在停药4个月后,继续减量服用伊马替尼后仍出现肺损伤及严重的皮疹,所以伊马替尼所致肺损伤的机制类似Ⅰ型超敏反应[9]。若该患者对伊马替尼已经致敏,即使减少剂量仍不能阻止肺损伤的发生。而尼洛替尼作为二代TKI,已被批准用于对伊马替尼耐药或不耐受的CML患者进行治疗,与伊马替尼不同,尼洛替尼靶向作用于酪氨酸激酶的先后顺序为BCR-ABL>PDGFR>c-kit,因此理论上尼洛替尼的肺毒性最为少见。本例患者在更换为尼洛替尼治疗后未再出现咯血症状,表明在药物性肺损伤的不良事件方面,尼洛替尼更为安全。
总之,临床上伊马替尼致肺损伤的发生率较低,一旦发生,可表现为致命性的肺出血,其机制可能与伊马替尼的直接药物毒性或与药物诱导的免疫损伤相关,及时停药,予强化免疫抑制治疗及血浆置换可显著缓解症状,而一旦症状缓解后应避免再次服用伊马替尼,可更换为肺毒性较小的尼洛替尼替代治疗。
