隐花色素1基因在肿瘤坏死因子α诱导的肾小管上皮细胞凋亡中的作用研究
2021-05-24李锴朱志辉
李锴 朱志辉
急性肾损伤是临床上常见多发的疾病,其发病机制复杂,主要病理变化为肾小管上皮细胞凋亡,因此,减少肾小管上皮细胞凋亡可延缓急性肾损伤的发生发展[1-2]。肾小管上皮细胞损伤时可合成和分泌炎性因子,而炎性因子反过来可加重急性肾损伤,抑制肾小管上皮细胞中炎性因子的产生是延缓急性肾损伤的有效方法[3-4]。隐花色素1(CRY1)属于生物钟基因家族,可调控小鼠昼夜节律,CRY1和CRY2的靶向突变延缓了p53无效突变小鼠的早期肿瘤形成[5]。有研究发现,CRY1在大肠癌患者组织中异常表达,影响其总体生存率[6]。CRY1过表达减轻了小鼠模型中睡眠剥夺引起的血管炎症[7]。p38丝裂原活化蛋白激酶(p38 MAPK)信号通路是MAPK的重要通路之一,介导多种转录因子的表达,参与炎症介质的产生,与肾小球疾病的发生发展相关[8]。p38 MAPK信号通路的活化可诱导肾小球内皮细胞内炎性因子的表达[9]。抑制p38 MAPK信号通路活化可减轻肾小管上皮细胞凋亡及纤维化,发挥肾脏保护作用[10]。CRY1虽属于生物钟基因家族,但其也可调节炎症反应,但CRY1对肾小管上皮细胞凋亡的影响及其机制还尚未清楚。研究发现肿瘤坏死因子α(TNF-α)是一种由单核巨噬细胞产生的可诱导细胞凋亡和免疫调节的细胞活性因子,可诱导肾小管上皮细胞凋亡[11]。本实验通过用TNF-α诱导肾小管上皮细胞凋亡,研究CRY1基因对TNF-α诱导的肾小管上皮细胞凋亡的影响、机制及与p38MAPK信号通路的相关性。
材料与方法
1.材料:人肾小管上皮细胞HK-2购自上海名劲生物科技有限公司。胎牛血清、Dulbecco改良Eagle培养基(DMEM)购自美国Gibco公司;TNF-α购自上海生博生物医药科技有限公司;蛋白提取试剂盒、二辛可宁酸(BCA)试剂盒、膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)和碘化丙锭(PI)试剂盒均购自碧云天生物技术研究所;Cleaved caspase-3、Bax、Bcl-2、CRY1、p-p38 MAPK和p38 MAPK等抗体均购自美国Abcam公司;酶联免疫吸附试验(ELISA)检测试剂盒购自上海联科生物技术有限公司;RNA提取试剂盒、反转录试剂盒和荧光定量试剂盒购自日本Takara公司;LipofectamineTM2000转染试剂盒购自美国Invitrogen公司;CRY1干扰质粒(si-CRY1)及其阴性对照质粒(si-con)均购自北京源生思创生物科技有限公司。Thermo FC酶标仪购自美国Thermo公司;FACS caliber流式细胞仪购自美国BD公司。
2.方法
(1)细胞培养:人肾小管上皮细胞HK-2培养于含10%胎牛血清的DMEM培养基,置于37 ℃、5%CO2的恒温箱,每2 d换液一次,当细胞融合至90%时用胰蛋白酶消化传代。
(2)细胞转染和分组:取对数生长期细胞无血清培养12 h后加入10 ng/ml的TNF-α分别培养0 h(0 h组)、12 h(12 h组)、24 h(24 h组)、48 h(48 h组),其中24 h组也为TNF-α组,以正常培养的细胞作为对照(NC)组。用50 μl无血清培养基稀释1.0 μg的CRY1干扰质粒(si-CRY1)及其阴性对照质粒(si-con),轻轻混匀。将3 μl脂质体用50 μl无血清培养基稀释,轻轻混匀,室温孵育5 min。将稀释的si-con、si-CRY1质粒和稀释的脂质体轻轻混合,室温孵育20 min,形成脂质体复合物。6 h后将复合物加入到含HK-2细胞和培养基中,震荡培养板轻轻混合,在37 ℃ CO2孵箱中培养,分别记为si-con组及si-CRY1组。将si-con组、si-CRY1组细胞加入10 ng/ml的TNF-α培养24 h,分别记为TNF-α+si-con组及TNF-α+si-CRY1组。转染按照LipofectamineTM2000试剂盒说明书进行操作。
(3)蛋白质免疫印迹法(Western blot)检测裂解半胱氨酸天冬氨酸蛋白酶-3(Cleaved caspase-3)、Bcl-2相关X蛋白(Bax)、B细胞淋巴瘤/白血病-2(Bcl-2)、CRY1、p38 MAPK和磷酸化p38 MAPK(p-p38 MAPK)蛋白表达水平:提取各组细胞蛋白,采用BCA试剂盒测定蛋白浓度。各组细胞蛋白上样量50 μg,经电泳将蛋白转移至PVDF上,5%脱脂牛奶室温封闭90 min,加入一抗,于4 ℃孵育过夜,PBS洗涤3次,加入二抗室温孵育2 h,PBS洗涤3次,暗室中曝光显影,定影,将胶片用Quantity One凝胶分析软件处理,测定各组蛋白条带的灰度值,以目的条带和肌动蛋白(β-actin)条带的比值作为Cleaved caspase-3、Bax、Bcl-2、CRY1、p-p38 MAPK和p38 MAPK蛋白表达水平。
(4)流式细胞术检测细胞凋亡率:采用不含乙二胺四乙酸(EDTA)的胰酶消化各组细胞,然后离心收集细胞,PBS漂洗2次,加结合缓冲液重悬细胞。依据试剂盒说明书先后分别加入Annexin V-FITC和PI避光孵育15 min。流式细胞仪检测激发波长488 nm和发射波长530 nm处的荧光强度,实验重复3次。细胞凋亡率为AnnexinV+PI-和AnnexinV+PI+两个象限的细胞数占总细胞数的比例。
(5)ELISA检测白细胞介素-1β(IL-1β)、干扰素γ(IFN-γ)及IL-6水平:收集各组细胞离心取上清液,按照ELISA试剂盒说明书检测IL-1β、IFN-γ、IL-6水平。
(6)实时荧光定量聚合酶链反应(RT-qPCR)检测CRY1 mRNA表达水平:提取各组细胞RNA,用反转录试剂盒将RNA反转录成cDNA,按照荧光定量试剂盒使用说明进行PCR,每个样品设3个重复,循环条件为95 ℃ 5 min,95 ℃ 30 s,60 ℃ 30 s;72 ℃ 30 s,共40个循环;60 ℃延长5 min。相对表达水平用2-△△Ct法计算。CRY1以β-actin为内参进行PCR扩增,CRY1上游引物序列:5’-CCGGCAGAAGTAACCTTTGA-3’,下游引物序列:5’-TAAGTCGCTTCGCATGTTTG-3’;β-actin上游引物序列:5’-GATCATTGCTCCTCCTGAGC-3’,下游引物序列:5’-ACTCCTGCTTGCTGATCCAC-3’。

结 果
1.不同时间点TNF-α对肾小管上皮细胞凋亡、炎症因子及CRY1表达的影响:与0 h组相比,12 h、24 h、48 h组肾小管上皮细胞细胞凋亡率、Cleaved caspase-3、Bax、CRY1表达水平显著升高,Bcl-2表达水平降低、IL-1β、IFN-γ、IL-6水平显著升高(P<0.05)。见图1。
2.抑制CRY1表达对TNF-α诱导的肾小管上皮细胞凋亡率和炎症因子水平的影响:与si-con组相比,si-CRY1组肾小管上皮细胞凋亡率、CRY1、Cleaved caspase-3、Bax表达水平、IL-1β、IFN-γ、IL-6水平显著降低,Bcl-2表达水平显著升高(P<0.05)。与NC组相比,TNF-α组肾小管上皮细胞凋亡率、CRY1、Cleaved caspase-3、Bax表达水平、IL-1β、IFN-γ、IL-6水平显著升高,Bcl-2表达水平显著降低(P<0.05)。与TNF-α+si-con组相比,TNF-α+si-CRY1组肾小管上皮细胞细胞凋亡率、CRY1、Cleaved caspase-3、Bax表达水平、IL-1β、IFN-γ、IL-6水平显著降低,Bcl-2表达水平显著升高(P<0.05)。见图2。
3.抑制CRY1表达对TNF-α诱导的肾小管上皮细胞中p38 MAPK通路的影响:与si-con组相比,si-CRY1组肾小管上皮细胞中p-p38 MAPK表达水平显著降低(P<0.05);与NC组相比,TNF-α组肾小管上皮细胞中p-p38 MAPK表达水平显著升高(P<0.05);与TNF-α+si-con组相比,TNF-α+si-CRY1组肾小管上皮细胞中p-p38 MAPK表达水平显著降低(P<0.05)。而p38 MAPK表达水平在各组间差异无统计学意义(P>0.05)。见图3。
讨 论
肾小管上皮细胞凋亡和炎症反应是导致急性肾损伤的主要原因[12]。研究发现,高水平的TNF-α可介导肾脏损伤和肾纤维化[13],且TNF-α可诱导肾小管上皮细胞上皮间质转化[14]。因此,本实验采用TNF-α处理肾小管上皮细胞,结果显示TNF-α处理后12 h、24 h、48 h肾小管上皮细胞中Cleaved caspase-3、Bax表达水平显著升高,Bcl-2表达水平显著降低,细胞凋亡率显著升高,说明TNF-α可诱导肾小管上皮细胞凋亡。此外,本实验还检测了炎性因子水平,结果显示,TNF-α处理的肾小管上皮细胞中IL-1β、IL-6及IFN-γ水平显著升高。IL-1β、IL-6、IFN-γ均是促炎细胞因子,说明TNF-α可诱导肾小管上皮细胞炎症反应的产生。综上,TNF-α可诱导肾小管上皮细胞凋亡和炎症反应的产生,说明肾小管上皮细胞损伤模型建立成功。
有研究发现,TNF-α增强了类风湿性滑膜细胞中CRY1 mRNA的表达水平[15]。CRY1是隐花色素家族成员之一,而隐花色素可通过上调促炎性细胞因子TNF-α的表达影响关节炎的发生[16]。白藜芦醇可通过靶向昼夜节律调节剂CRY1预防丙烯酰胺诱导的肝细胞线粒体功能障碍和炎症反应[17]。抑制CRY1可通过抑制Toll样受体(TLR)/核因子-κB(NF-κB)通路减轻慢性肾脏病大鼠的肾小球硬化和肾小管上皮损伤[18]。以上研究结果均表明CRY1与细胞炎性反应有关。本实验结果显示,TNF-α处理的肾小管上皮细胞中CRY1高表达,说明高CRY1可能与肾小管上皮细胞凋亡和炎症反应的产生有关。因此,本实验为进一步研究CRY1对肾小管上皮细胞凋亡和炎症反应的影响,转染CRY1的抑制表达载体si-CRY1至肾小管上皮细胞及TNF-α处理的肾小管上皮细胞中,然后检测细胞凋亡情况、凋亡相关蛋白表达及炎性因子水平,结果显示,肾小管上皮细胞中Cleaved caspase-3、Bax表达水平显著降低,Bcl-2表达水平显著升高,细胞凋亡率显著降低,IL-1β、IFN-γ、IL-6水平显著降低。说明抑制CRY1表达可抑制肾小管上皮细胞凋亡和炎症因子分泌,并可减轻TNF-α诱导的肾小管上皮细胞凋亡和炎症因子分泌。本实验结果提示抑制CRY1表达具有减轻肾小管上皮损伤的作用,与Liu等[18]的研究结果相符。
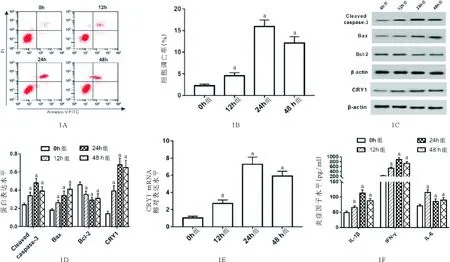
注:与0 h组比较,aP<0.05图1 TNF-α诱导处理不同时间组肾小管上皮细胞凋亡率、Cleaved caspase-3、Bax、Bcl-2蛋白、CRY1表达水平和炎症因子水平的比较(A:流式细胞术检测不同时间组肾小管上皮细胞凋亡率;B:不同时间组细胞凋亡率比较;C:Western blot检测不同时间组Cleaved caspase-3、Bax、Bcl-2、CRY1表达水平;D:不同时间组Cleaved caspase-3、Bax、Bcl-2、CRY1蛋白表达水平比较;E:不同时间组CRY1 mRNA表达水平比较;F:不同时间组炎症因子IL-1β、IFN-γ、IL-6水平比较)

注:与si-con组比较,aP<0.05;与NC组比较,bP<0.05;与TNF-α+si-con组比较,cP<0.05图2 抑制CRY1表达后TNF-α诱导肾小管上皮细胞凋亡率、cleaved cospase-3、Bax、Bcl-2蛋白、CRY1表达水平及炎症因子水平比较(A:流式细胞检测不同组别细胞凋亡率;B:不同组别细胞凋亡率比较;C:Western Blot检测不同组别CRY1、cleaved cospase-3、Bax、Bcl-2表达水平;D:不同组别CRY1、Cleaved caspase-3、Bax、Bcl-2蛋白表达水平比较;E:不同组别炎症因子IL-1β、IFN-γ、IL-6水平比较)

注:与si-con组比较,aP<0.05;与NC组比较,bP<0.05;与TNF-α+si-con组比较,cP<0.05图3 抑制CRY1表达后TNF-α诱导肾小管上皮细胞p-p38 MAPK和p38 MAPK蛋白表达水平比较(A:Western Blot检测不同组别p-p38 MAPK和p38 MAPK蛋白表达结果;B:不同组别p-p38 MAPK和p38 MAPK蛋白表达水平比较)
研究发现抑制p38 MAPK信号通路可减轻缺氧复氧肾小管上皮细胞炎症反应[19],抑制p38 MAPK信号通路可减少肾小管上皮细胞凋亡[20]。说明p38 MAPK信号通路可能与炎性反应及肾小管上皮细胞凋亡有关。本实验为研究CRY1对肾小管上皮细胞炎症反应和凋亡的影响机制及与p38 MAPK信号通路的相关性,转染CRY1的抑制表达载体si-CRY1至肾小管上皮细胞及TNF-α处理的肾小管上皮细胞中,然后检测p-p38 MAPK及p38 MAPK蛋白表达水平,结果显示,TNF-α处理的肾小管上皮细胞中p-p38 MAPK表达水平显著升高,说明TNF-α激活了p38 MAPK信号通路。而抑制CRY1表达后,正常肾小管上皮细胞及TNF-α处理的肾小管上皮细胞中p-p38 MAPK表达水平均显著降低,说明抑制CRY1表达可抑制p38 MAPK信号通路激活。CRY1可能通过抑制p38 MAPK信号通路激活抑制TNF-α诱导的肾小管上皮细胞凋亡和炎症反应。
综上,CRY1可抑制TNF-α诱导的肾小管上皮细胞凋亡和炎症因子分泌,其机制可能与p38 MAPK信号通路有关。可以为保护肾小管上皮细胞损伤、减少肾损伤疾病的发生提供理论参考依据。
