急性心肌梗死患者血清超敏C反应蛋白、组织蛋白酶S、可溶性细胞表面分化抗原40配体水平与病情程度及预后的相关性
2021-05-24郝增光杨晓红韩兆帅葛慧敏
郝增光 杨晓红 韩兆帅 葛慧敏
急性心肌梗死(AMI)是由急性、持续性冠状动脉(简称冠脉)缺血、缺氧引发的部分心肌急性坏死,具有起病急、病情凶险等特征,若未予以及时有效干预,可诱发心律失常、心力衰竭或休克等不良事件,甚至死亡[1-2]。相关研究发现,炎症反应贯穿动脉粥样硬化发生、发展进程,是急性冠脉综合征发生的主要始动机制。而超敏C反应蛋白(hs-CRP)是反映机体炎症反应的敏感指标,也是介导动脉粥样斑块破裂及局部血栓形成的主要因素之一[3-4]。同时,血小板急性刺激下产生的可溶性细胞表面分化抗原40配体(sCD40L)可刺激血管内皮,增加血管内皮生长因子含量,间接促进新生血管形成,进而影响动脉粥样硬化斑块的稳定性[5]。另外,组织蛋白酶S(CatS)具有较高蛋白溶解活性,可能参与动脉粥样硬化斑块形成、发展及进展至不稳定斑块的病理过程[6]。基于此,本研究综合分析AMI患者血清hs-CRP、CatS、sCD40L水平与病情程度及预后的相关性,现报道如下。
对象与方法
1.对象:2017年5月~2019年10月我院收治的AMI患者102例作为观察组,其中男56例,女46例,年龄49~75岁,平均年龄(60.35±5.11)岁,发病时间2.5~22.9 h,平均发病时间(11.40±3.11)h;冠脉病变数量:单支病变37例,双支病变36例,多支病变29例;Gensini评分:<40分24例,40~60分26例,61~80分27例,>80分25例;心电图QRS积分:<3分35例,3~4分47例,>4分20例;killip心功能分级:Ⅰ~Ⅱ级52例,Ⅲ~Ⅳ级50例。纳入标准:(1)符合《急性心肌梗死诊断和治疗指南》[7]中AMI相关标准;(2)冠脉造影结果显示冠脉狭窄>50%;(3)典型胸痛持续时间>30 min;(4)血清肌酸激酶同工酶、高敏肌钙蛋白增高且均>正常上限的2倍。排除标准:(1)合并肝、肾等重要脏器器质性病变;(2)合并急性或慢性感染;(3)近期有静脉溶栓治疗史;(4)脑血管及周围血管病变;(5)凝血功能紊乱或活动性出血;(6)合并严重心肌病、心力衰竭或心律失常等心脏疾病;(7)患有感知障碍的精神性疾病。另选取97例我院健康体检者作为对照组,其中男57例,女40例,年龄48~77岁,平均年龄(59.97±4.85)岁。两组受试者性别、年龄比较差异均无统计学意义(P>0.05)。本研究经我院医学伦理委员会审核批准,所有研究对象均签署知情同意书。
2.方法:空腹取4 ml静脉血,3 000 r/min离心12 min(离心半径15 cm),分离血清,置于-80 ℃低温保存:(1)采用免疫荧光分析仪(型号:i-CHROMA Reader)以免疫散射比浊法检测血清hs-CRP水平,仪器购自韩国Boditech MED Inc公司,试剂盒购自上海康朗生物科技有限公司;(2)采用酶联免疫吸附试验(ELISA)检测血清CatS、sCD40L水平,试剂盒购自北京科瑞美科技有限公司,具体方法:①设空白孔、标准孔、待测样品孔。其中空白孔加样品稀释液100 μl,剩余孔加标准品或待测样品100 μl,混匀,酶标板覆盖覆膜,37 ℃条件下反应120 min;②弃去液体,甩干;③每孔均加入生物素标记抗体工作液100 μl,37 ℃条件下反应60 min;④温育60 min后,弃去孔内液体,甩干,洗板3次,每次浸泡1~2 min;⑤每孔加入辣根过氧化物酶标记亲和素工作液100 μl,37 ℃条件下反应60 min;⑥洗板,方法同步骤④;⑦依序在每孔中加入底物溶液90 μl,37 ℃避光显色;⑧每孔逐一加入终止溶液50 μl,终止反应;⑨15 min内采用酶标仪测量各孔的光密度。心血管事件包括:恶性心律失常(室性心动过速、心室颤动、新发心房扑动或心房颤动、二度Ⅱ型或三度房室传导阻滞)、心力衰竭、心源性休克、心肌梗死后心绞痛及死亡。

结 果
1.两组受试者血清hs-CRP、CatS、sCD40L水平比较:观察组受试者血清hs-CRP、CatS、sCD40L水平均高于对照组,差异有统计学意义(P<0.05)。见表1。

表1 两组受试者血清hs-CRP、CatS、sCD40L水平比较
2.血清hs-CRP、CatS、sCD40L水平与AMI的相关性分析:Logistic多因素回归分析结果显示,血清hs-CRP、CatS、sCD40L水平升高是AMI发生的独立危险因素(P<0.05)。见表2。
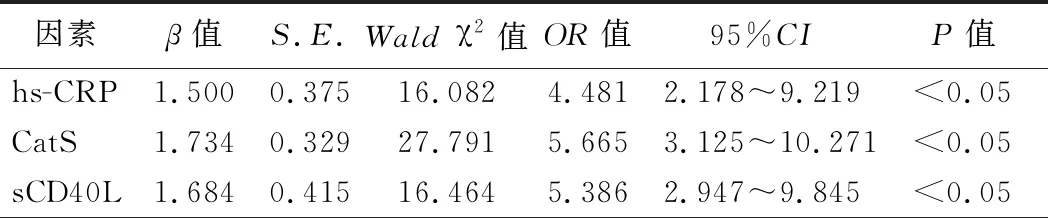
表2 血清hs-CRP、CatS、sCD40L水平与AMI的相关性分析
3.AMI患者血清hs-CRP、CatS、sCD40L水平间的相关性:Spearman相关分析结果显示,AMI患者血清hs-CRP水平与CatS、sCD40L水平均呈正相关(r=0.709、0.560,P均<0.05),CatS水平与sCD40L水平呈正相关(r=0.367,P<0.05)。
4.不同临床病理参数AMI患者血清hs-CRP、CatS、sCD40L水平比较:不同冠脉病变数量、Gensini评分、心电图QRS积分、killip心功能分级AMI患者血清hs-CRP、CatS、sCD40L水平比较,差异均有统计学意义,且随冠脉病变数量、Gensini评分、心电图QRS积分、killip心功能分级增加,血清hs-CRP、CatS、sCD40L水平明显升高(P<0.001)。见表3。

表3 不同临床病理参数AMI患者血清hs-CRP、CatS、sCD40L水平比较
5.血清hs-CRP、CatS、sCD40L水平与AMI患者临床病理参数的相关性分析:Spearman相关分析结果显示,血清hs-CRP、CatS、sCD40L水平与AMI患者冠脉病变数量、Gensini评分、心电图QRS积分、killip心功能分级均呈正相关(P<0.001)。见表4。
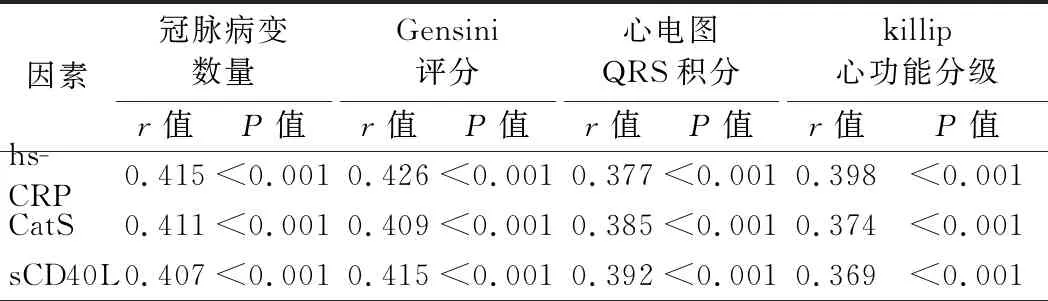
表4 血清hs-CRP、CatS、sCD40L水平与AMI患者临床病理参数的相关性分析
6.发生心血管事件组与未发生心血管事件组AMI患者血清hs-CRP、CatS、sCD40L水平比较:102例AMI患者中,发生心血管事件者28例(发生心血管事件组),未发生心血管事件者74例(未发生心血管事件组)。发生心血管事件组患者血清hs-CRP、CatS、sCD40L水平均明显高于未发生心血管事件组(P<0.05)。见表5。

表5 发生心血管事件组与未发生心血管事件组AMI患者血清hs-CRP、CatS、sCD40L水平比较
7.血清hs-CRP、CatS、sCD40L水平对AMI患者心血管事件发生风险的预测价值:ROC曲线分析结果显示,血清hs-CRP、CatS、sCD40L水平三者联合预测AMI患者心血管事件发生风险的ROC曲线下面积(AUC)为0.885(95%CI0.807~0.940),高于血清hs-CRP、CatS、sCD40L单一指标的AUC[0.793(95%CI0.701~0.867)、0.767(95%CI0.673~0.845)、0.826(95%CI0.739~0.894)],敏感度为82.14%,特异度为81.08%。见图1。
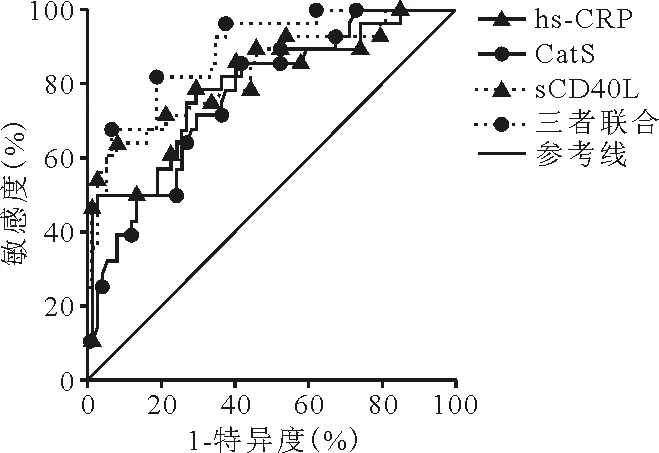
图1 血清hs-CRP、CatS、sCD40L水平预测AMI患者心血管事件发生风险的ROC曲线
讨 论
多项研究发现,单核细胞、淋巴细胞等在其趋化蛋白作用下,迁移至血管内膜,可促进组织蛋白酶、基质金属蛋白激酶、细胞因子等炎症因子分泌,诱导细胞外基质降解,进而增加斑块易损性及斑块破裂、血栓形成风险,最终引发AMI[8-9]。目前临床诊断AMI多以肌酸激酶同工酶、高敏肌钙蛋白等心肌损伤标志物为主[10-11],但其仅适用于诊断与评估已发生的心血管事件。因此,寻找有效诊断AMI及评估患者预后的血清学指标是目前临床的研究重点。
sCD40L是CD40的可溶性配体,而CD40与CD40L组成信号传导通路可调节冠脉粥样硬化斑块内巨噬细胞、内皮细胞、平滑肌细胞等细胞成分炎性反应[12-13]。相关研究表明,sCD40L是预测心血管事件的独立危险因素,也是识别高危动脉粥样硬化斑块或冠脉血栓形成的外周血标志物[14]。本研究中Spearman相关分析结果显示,血清sCD40L水平与AMI患者冠脉病变数量、Gensini评分、心电图QRS积分、killip心功能分级均呈正相关,提示血清sCD40L水平可能对AMI病情进展产生重要影响。分析其机制可能为血清sCD40L水平大量释放,可介导斑块局部炎性反应,激活血小板,上调基质金属蛋白酶表达,促进间质胶原降解,影响斑块稳定性,最终形成恶性循环。推测下调血清sCD40L水平可能是抑制AMI病情进展的重要环节。
在白细胞介素(IL)、肿瘤坏死因子(TNF)或干扰素(IFN)等炎症介质刺激下,血管平滑肌细胞及巨噬细胞可分泌CatS,导致胶原蛋白及弹性蛋白降解,纤维帽完整性破损,动脉粥样斑块不稳定性加剧[15]。本研究结果显示,血清CatS水平在AMI患者中呈异常高表达,与曾庆淦等[16]观点一致,这可能归因于炎症因子刺激可损伤细胞,抑制胱抑素C分泌,导致CatS与胱抑素C失调,增加CatS水平,进而抑制高密度脂蛋白-3诱导的胆固醇流出,加快细胞外基质降解,降低斑块稳定性,引发AMI。
hs-CRP是一种急性时相蛋白,由IL-6等炎症细胞因子产生,是反映全身炎症的生物标志物,可参与动脉粥样硬化斑块形成的整个病理生理过程[17]。Logistic多因素回归分析结果显示,血清hs-CRP水平升高是AMI发生的独立危险因素之一,与国内某些研究结果相似[18-19],并随冠脉病变数量、Gensini评分、心电图QRS积分、killip心功能分级增加呈升高趋势。分析其机制在于,一方面,hs-CRP水平升高不仅能激活补体系统,增强巨噬细胞黏附力,还能结合单核细胞系统与淋巴细胞受体,活化单核细胞、淋巴细胞,进而直接损伤血管内皮[20];另一方面,hs-CRP能促进单个核细胞释放组织因子,启动外源性凝血途径,促进粘附因子分泌,产生一系列炎症反应,从而导致斑块破裂、血管痉挛,引发AMI。既往研究结果显示,hs-CRP与冠脉不良事件发生风险呈正相关[21]。本研究中,血清hs-CRP在发生心血管事件的AMI患者中过度上调,可能与hs-CRP能抑制一氧化氮分泌,诱导血管内皮细胞死亡,阻碍血管生成,引发一系列组织器官改变有关。
本研究结果还发现,AMI患者血清hs-CRP水平与CatS、sCD40L水平均呈正相关,提示三者在AMI发生、病情进展过程具有协同作用,推测机制在于血清hs-CRP、CatS、sCD40L水平均参与脉粥样硬化斑块破裂的病理过程,但hs-CRP易受饮酒、吸烟等因素的影响,预测价值有限,故本研究选取联合预测模式,结果显示,血清hs-CRP、CatS、sCD40L联合预测AMI患者发生心血管事件的AUC为0.885,均大于血清各指标单一预测的AUC,推测三者联合有望成为预测AMI患者心血管事件发生的潜在有效手段,指导临床选择合理治疗方案,改善患者预后。
综上可知,血清hs-CRP、CatS、sCD40L高表达与AMI发生独立相关,可辅助临床评估病情程度,且在预测心血管事件发生方面具有较高应用价值,有助于指导临床开展针对性防治措施。
