2型糖尿病伴下肢血管病变患者血清人血管生成素样蛋白4、脂蛋白相关磷脂酶A2、脂联素与其病情程度的关系及相关影响因素
2021-05-24邵欣李艳丽陈思思孙倩舒丁洪成
邵欣 李艳丽 陈思思 孙倩舒 丁洪成
血管病变是2型糖尿病(T2DM)常见的并发症之一,也是导致T2DM患者死亡的主要原因之一。最常见的血管病变包括心血管病变、脑血管病变、肾脏病变、视网膜病变及下肢血管病变(LVD)等[1-2],其中LVD属大血管病变,而糖尿病足正是LVD的常见合并症,若不及时治疗可能会引起下肢皮肤及肢体坏疽。近年来随着T2DM患者数量增加,LVD患者也相应增加[3]。LVD早期患者可无明显改变,随着病程进展,患者可逐渐出现相关症状,如动脉硬化引起周围小动脉闭塞症或皮肤微血管病变及细菌感染导致的足部疼病、足部溃疡及足坏疽等病变[4]。一旦发生严重LVD合并症,治疗效果不甚理想。若能早期预测T2DM患者LVD的发生发展及其严重程度,做好预防工作,能有效提高其生存质量,改善其预后。近年来,血清学指标的不断深入研究,为临床疾病的诊断及评估提供了良好的帮助。血清人血管生成素样蛋白4(ANGPTL4)是血管生成素样蛋白家族成员,直接参与糖代谢,并在糖尿病微血管病变中发挥作用;脂蛋白相关磷脂酶A2(LP-PLA2)作为一种特殊的脂蛋白,结构中富含大量的胆固醇,其浓度与炎症反应程度相关,并参与动脉粥样硬化发展和破裂的各个阶段;脂联素(APN)作为脂肪细胞分泌的特异性血清蛋白,可以增加胰岛素敏感性,调节糖、脂代谢,有抗动脉粥样硬化的作用[5],可预示冠状动脉是否发生病变。我们对我院收治的T2DM伴LVD患者进行研究,评估血清ANGPTL4、LP-PLA2、APN水平等血清因子与LVD的相关性。
对象与方法
1.对象:2018年6月~2019年6月我院收治的T2DM伴LVD患者96例。纳入标准:(1)符合第八版内科学中关于糖尿病足[6]的诊断标准;(2)不合并其他原因引起的血管病变。排除标准:(1)合并糖尿病高渗性高血糖状态;(2)合并糖尿病酮症酸中毒;(3)合并精神或神经系统病变;(4)合并下肢血管外伤病史。根据LVD严重程度将96例患者分为轻度组(24例)、中度组(24例)及重度组(48例)。本研究经我院伦理委员会审核批准,所有患者及家属均知情同意。
2.方法
(1)一般资料收集:收集患者的一般资料,包括性别、年龄、BMI、收缩压(SBP)。
(2)实验室检查:患者入院后次日清晨空腹状态下抽取肘前正中静脉血5 ml,静置30 min,以3 000 r/min离心10 min,取上层血清液保存待检。采用聚乙烯硫酸盐化学沉淀法测定低密度脂蛋白胆固醇(LDL-C)水平。采用HOMA calculator 2.0软件计算稳态胰岛素抵抗指数(HOMA-IR)。采用美国Bio-Rad Ⅱ糖化血红蛋白仪检测糖化血红蛋白(HbA1c)水平。采用酶联免疫吸附试验测定血清空腹胰岛素(FINS)、ANGPTL4、LP-PLA2及APN水平。
(3)下肢血管超声检查:所有患者依次取平卧、俯卧、侧卧位,采用德国西门子ACUSON S2000彩色多普勒超声诊断仪扫描其下肢血管(股深、浅动脉、双侧股动脉、腘动脉、足背动脉、腓动脉及胫前、胫后动脉),测量血管内径及血管内膜厚度,检测血流峰值数及血流频谱。下肢血管病变诊断标准:(1)有狭窄;(2)有单发、多发或弥漫的斑块;(3)动脉内膜增厚,厚度≥1 mm;(4)动脉内膜未增厚,但回声增强。根据以上病变标准,满足其中1种情况表示有轻度病变,满足其中2种情况表示有中度病变,满足其中3种及以上情况表示有重度病变。下肢血管超声检查由我院两名超声科高年资医师根据检查结果对LVD进行诊断,若诊断不一致,则申请第三位医生进行协助诊断。

结 果
1.3组患者临床资料比较:随着LVD严重程度的增加,轻、中、重度组患者年龄、BMI、HbA1c、FINS、HOMA-IR、血清ANGPTL4、LP-PLA2水平依次增加,而血清APN水平依次降低(P<0.05)。见表1。

表1 3组患者临床资料比较
2.重度LVD的单因素分析结果:单因素分析结果显示,不同年龄、BMI、HbA1c、HOMA-IR、血清ANGPTL4、LP-PLA2、APN水平患者LVD发生率比较差异均有统计学意义(P<0.05)。见表2。
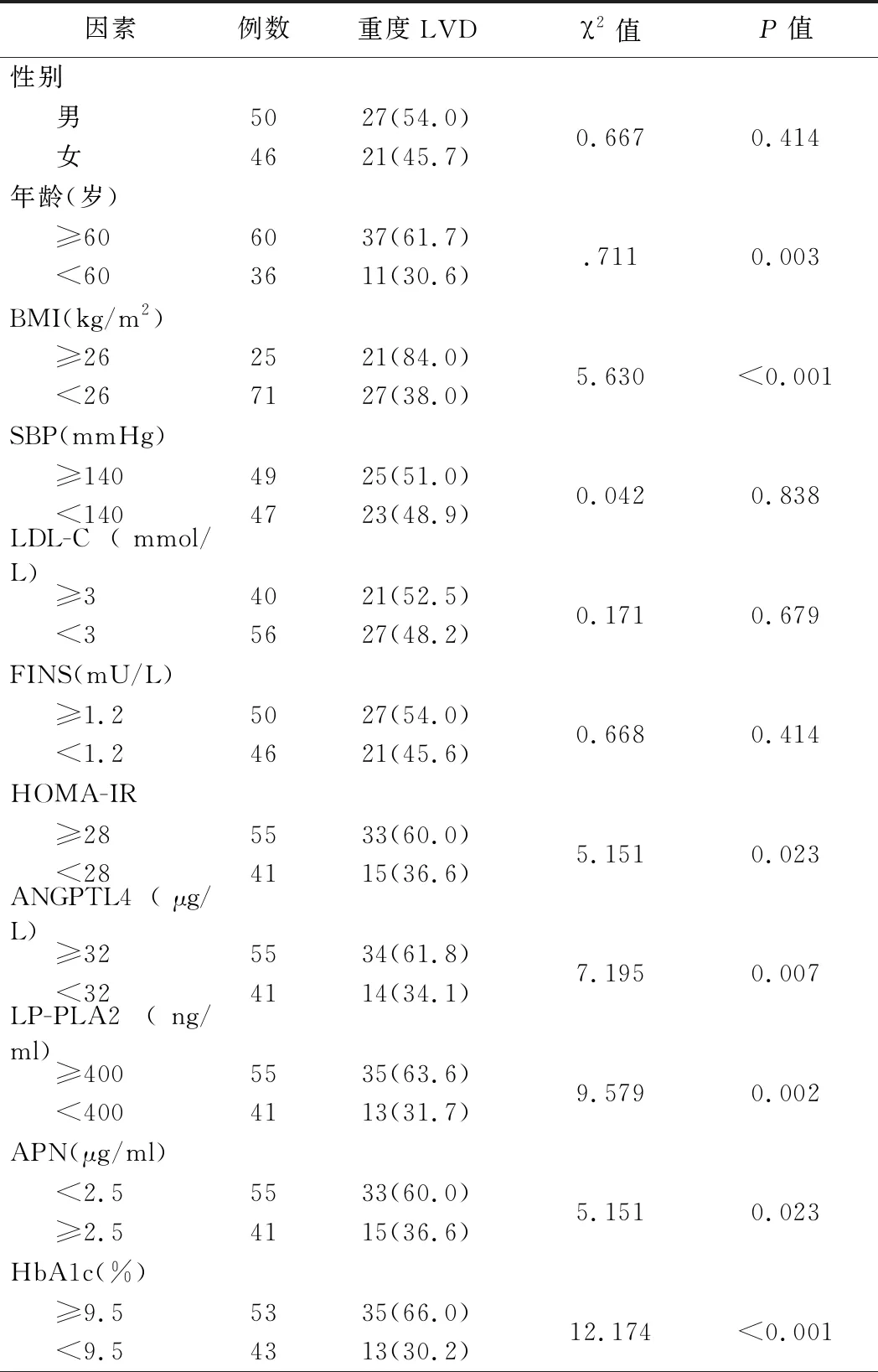
表2 重度LVD的单因素分析结果[例,(%)]
3.T2DM患者LVD的影响因素分析:Logistic回归分析结果显示,APN水平升高为T2DM患者发生LVD的保护因素,而高龄及HOMA-IR、ANGPTL4、APN、LP-PLA2水平升高为T2DM患者发生LVD的危险因素(P<0.05)。见表3。

表3 T2DM患者LVD的影响因素分析
讨 论
LVD是T2DM晚期常见的并发症,也是影响患者生活质量及预后的重要因素[7]。T2DM患者比正常人群更容易产生动脉粥样硬化,且发展迅速,从而导致冠心病、脑血管意外和下肢坏疽等。相关研究结果报道,在过去患有周围血管疾病的患者中,20%发现合并T2DM,而在T2DM患者中发现有间歇性跛行、肌肉和皮肤萎缩及下肢坏疽等症状的患者也比正常人群高[8]。因此,及时发现T2DM并根据患者具体情况采取针对性预防措施尤为重要。
ANGPTL4是血管生成素样基因家族成员,在肝脏、肾脏、肌肉和肠道组织中均有表达,但在肝脏中表达水平最高。ANGPTL4在不同组织具有不同功能表现,其作为基质细胞蛋白能够促进皮肤伤口愈合,ANGPTL4缺陷小鼠表现出伤口上皮形成,角质形成细胞迁移,血管生成和炎症反应改变延迟。ANGPTL4通过整合素/JAK/STAT3介导的上皮中iNOS表达上调诱导一氧化氮的产生,并增强血管生成以加速T2DM小鼠的伤口愈合[9]。ANGPTL4诱导成纤维细胞中的β-链蛋白(β-catenin)介导的分化抑制因子3(ID3)上调,以减少瘢痕胶原蛋白表达。ANGPTL4能够逆转成纤维细胞向成肌纤维细胞分化。然而,ANGPTL4在增生性糖尿病视网膜病变及LVD患者血清和玻璃体中表达增加,可能与T2DM血管病变有关[10]。LP-PLA2是一种炎性细胞分泌的能促使氧化磷脂水解的磷脂酶,是磷脂酶A2(PLA2)超家族中的一员。动脉粥样硬化斑块中Lp-PLA2表达上调,且在易损斑块纤维帽的巨噬细胞中强表达。Lp-PLA2可水解氧化低密度脂蛋白(ox-LDL)中的氧化磷脂,生成脂类促炎物质,如溶血卵磷脂和氧化游离脂肪酸,进而发挥多种致动脉粥样硬化作用,包括内皮细胞死亡和内皮功能异常,刺激粘附因子和细胞因子的产生。这些物质可通过趋化炎症细胞进一步产生自我强化的循环,生成更多促炎物质[11]。APN是脂肪细胞分泌的一种内源性生物活性多肽或蛋白质,具有类似于胰岛素增敏激素的效果,能改善T2DM患者胰岛素抗性和动脉硬化症。相关研究结果发现,APN水平能预示T2DM和冠心病的发展,并在临床试验表现出抗T2DM、抗动脉粥样硬化和炎症的潜力[12]。
本研究中,不同程度LVD T2DM患者年龄、BMI、FINS、HOMA-IR、HbA1c、血清ANGPTL4、LP-PLA2及APN水平比较差异均有统计学意义,随着LVD病变程度的加重,年龄、BMI、FINS、HOMA-IR、HbA1c及血清ANGPTL4、LP-PLA2水平逐渐升高,而APN水平逐渐降低,表明年龄、BMI、HOMA-IR、HbA1c、血清ANGPTL4、LP-PLA2、APN水平可能与T2DM患者发生LVD具有一定相关性。牟芝群等[13]和王莲地等[14]也在研究中得出相似结论,并认为可能与T2DM患者血清炎症因子激活引起动脉内皮细胞破坏的加重有关。单因素分析及logistic回归分析结果显示,年龄、HOMA-IR、ANGPTL4、APN、LP-PLA2与T2DM患者LVD显著相关,其中APN水平升高为T2DM患者LVD的保护因素,而高龄、HOMA-IR、ANGPTL4、APN、LP-PLA2水平升高为T2DM患者LVD的危险因素。单因素分析结果提示BMI与LVD具有一定相关性,而logistic回归分析结果中并未提示两者具有相关性,说明BMI并不能作为评价LVD程度的独立因素。年龄、HOMA-IR、ANGPTL4、APN、LP-PLA2水平与LVD的发生发展显著相关,其中高龄及HOMA-IR、ANGPTL4、LP-PLA2水平的升高提示患者下肢病变预后不良或病程进展,需要引起临床重视。Kuo等[15]及Biro等[16]也在研究结果中发现,胰岛素抵抗及血清炎症相关因子(包括血清ANGPTL4、LP-PLA2等)的释放与T2DM伴LVD患者病情有关,而APN在其中具有积极的意义。
综上,年龄、HOMA-IR、ANGPTL4、APN、LP-PLA2与T2DM患者发生LVD显著相关,可为LVD的预防及预后评估提供参考价值。
