间充质干细胞移植治疗系统性红斑狼疮骨质疏松效果分析
2021-05-24刘瑞霞许文英通讯作者
刘瑞霞,许文英(通讯作者)
(苏州市立医院本部 江苏 苏州 215000)
系统性红斑狼疮(SLE)是可累积全身各系统的自身免疫病,累及骨骼肌肉系统可导致骨量流失出现骨质疏松。由研究证实初发SLE 患者也可存在骨质疏松[1],现阶段研究证实SLE 患者体内的炎症因子在其骨质疏松的发生发展中尤为重要[2]。有研究发现,SLE 患者体内TNF-α、IL-1、IL-6 等炎症因子水平异常[3-4]。近年来,越来越多的研究证实T 细胞产生的IL-17 在多种自身免疫性疾病中起重要作用[5-7]。在SLE 患者TNF-α可促进破骨前体细胞的增值,活化NF-KB 受体活化因子(RANK)促进破骨细胞生成,促进破骨细胞分泌RANK和成骨细胞分泌RANKL,二者结合可激活进一步NF-KB及其下游相关蛋白,这些蛋白分子促进破骨细胞的活化及分化成熟,从增加骨吸收[8-10]。目前研究已发现多条信号通路参与MSCs 成骨分化,如Wnt/β-catenin、BMP-Smads、Notch、Hedgehog、FGF,且相互调节,其中BMP/Smad 信号通路最早发现且最为重要[11]。间充质干细胞有多向分化潜能,具有免疫调控作用,通过临床行USMSCs 输注后评估骨代谢相关信号通路表达水平的变化。
1.资料与方法
1.1 一般资料
选取2015 年1 月—2016 年1 月住院SLE 并发骨质疏松患者8 例,均符合美国风湿病学会(ACR)1997 年SLE 分类标准,其中女性7 例,男性1 例,年龄30 ~50岁。入组患者分别与移植前、移植后1 月、3 月、6 月随访,使用PCR 方法检测患者外周血单个核细胞骨代谢基因表达水平。
1.2 方法
(1)分离外周血单个核细胞(PBMC),提取测定RNA。
(2)设计及合成引物:应用Primer Primier 5.0软件设计内参基因GAPDH 及目的基因的引物序列,上海生工生物工程技术公司合成。
(3)反转录及荧光定量:PCR 对RNA 进行反转录,同时对产物进行普通PCR 扩增,琼脂糖凝胶电泳检验引物特异性并选取最佳退火温度。对各组标本的基因行荧光定量PCR。
1.3 统计学分析
应用SPSS 16.0 软件行统计学分析,以均数±标准差(±s)表示计量资料,各组数据符合正态性分布与方差齐性,采用单向方差分析进行多组之间的均数比较。P<0.05 认为具有统计学差异。
2.结果
(1)对 比 移 植 后1 月、3 月SLE 患 者PBMC 的TNF-α、NF-κBp50 和NF-κBp65 mRNA 水平下降(P<0.05),移植后6 月NF-κBp65 mRNA 水平仍较处于低水平,逐渐接近移植前水平且有统计学差异(P<0.05)。详见表1。
表1 移植前后TNF/NFκB 信号通路mRNA 表达水平(± s)
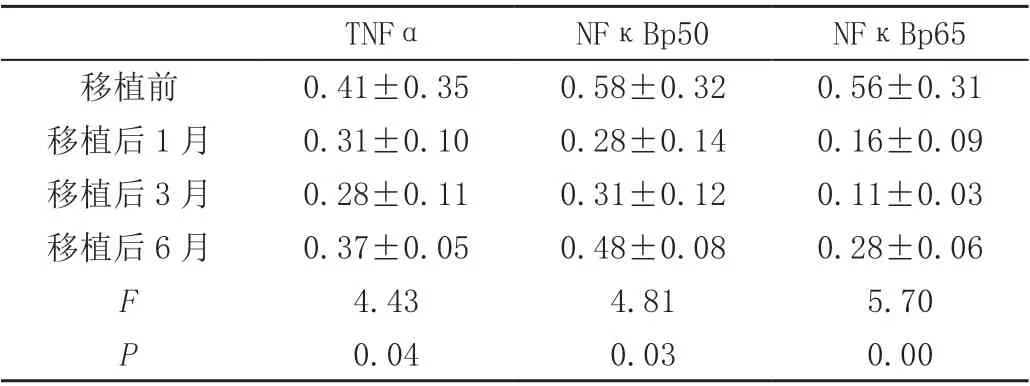
表1 移植前后TNF/NFκB 信号通路mRNA 表达水平(± s)
TNFα NFκBp50 NFκBp65移植前 0.41±0.35 0.58±0.32 0.56±0.31移植后1 月 0.31±0.10 0.28±0.14 0.16±0.09移植后3 月 0.28±0.11 0.31±0.12 0.11±0.03移植后6 月 0.37±0.05 0.48±0.08 0.28±0.06 F 4.43 4.81 5.70 P 0.04 0.03 0.00
(2)移植前后BMP2、Smad1、Smad5 和Smad8 的mRNA 水平无统计学差异(P<0.05),移植后6 个月逐渐接近移植前水平。详见表2。
表2 移植前后BMP/Smad 信号通路mRNA 表达水平(± s)
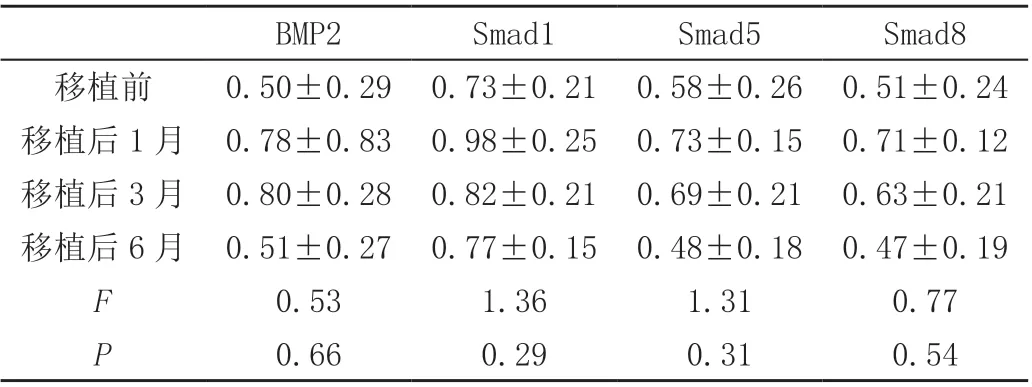
表2 移植前后BMP/Smad 信号通路mRNA 表达水平(± s)
BMP2 Smad1 Smad5 Smad8移植前 0.50±0.29 0.73±0.21 0.58±0.26 0.51±0.24移植后1 月 0.78±0.83 0.98±0.25 0.73±0.15 0.71±0.12移植后3 月 0.80±0.28 0.82±0.21 0.69±0.21 0.63±0.21移植后6 月 0.51±0.27 0.77±0.15 0.48±0.18 0.47±0.19 F 0.53 1.36 1.31 0.77 P 0.66 0.29 0.31 0.54
3.讨论
系统性红斑狼疮是以T、B 淋巴细胞等免疫功能异常为主要发病机制[12-13],近年来随着SLE 生存率的增加,继发骨质疏松已成为影响患者生活质量的严重并发症[14-15]。
目前的研究认为TNF-α 水平异常诱导破骨细胞的分化和成熟是导致SLE 患者发生炎症介导骨质疏松的重要因素。本研究拟通过检测移植前后TNF-α/NF-κB 信号通路基因表达水平的变化评估脐带间充干细胞移植治疗SLE 骨质疏松有效性。在骨代谢中,偶联骨形成和骨吸收两个过程的重要信号通路是OPG/RANK/RANKL[17],RANK/RANKL 在破骨细胞的生成调节中起重要作用,二者结合后入核启动NF-κB 的活化,进一步与NFAT-c1 结合启动破骨基因活化,诱导破骨细胞分化成熟[18],而OPG与RANKL 竞争性结合科阻断上述过程,抑制下游信号转导,从而抑制破骨细胞分化成熟。
已有研究证实狼疮患者MSCs 成骨分化能力较正常人减弱[16],近年来行MSCs 移植治疗难治性SLE 已有研究,本次试验我们经外周静脉移植,意在探讨MSCs治疗SLE 骨质疏松的可能机制。结果发现,在静脉输注MSCs 后的狼疮患者体内BMP/Smad 中基因表达水平变化虽无统计学差异,但整体水平有升高,且TNF-α/NF-κB 通路中各基因表达下降;据此有理由推测,UCMSCs 移植可能通过调节BMP/Smad 及TNF/NF-κB 信号通路治疗骨质疏松。
综上,本实验通过体内实验证实了UCMSCs 移植对骨代谢信号通路调节,一定程度上说明MSCs 移植治疗骨质疏松可能是通过抑制TNF-α,作用于MSCs BMP/Smad 信号通路。
