颅神经损伤面颈部肌萎缩纤维化中环状RNA差异表达分析△
2021-05-22高轶昳刘菲郑宏良周义德陈世彩黄卫于阅尽郝亚楠
高轶昳 刘菲 郑宏良 周义德 陈世彩 黄卫 于阅尽 郝亚楠
长期失神经支配喉肌再生能力受损,致使喉肌发生不可逆的萎缩纤维化是导致晚期声带麻痹神经修复术后喉功能恢复不良的重要原因[1]。目前,针对这一问题仍无有效的干预方法;因此,寻找延缓和减轻失神经骨骼肌萎缩纤维化的分子靶标是一项重要基础研究内容。环状RNA(circular RNA,circRNA)是新近研究发现的一类特殊的内源性环形非编码RNA(non-coding RNA,ncRNA),其由特殊的可变剪切产生,通过转录后水平的调控机制,在基因调控中发挥着重要作用,参与疾病的发生和发展[2]。研究表明circRNA的作用不仅与神经损伤后反应[3]及神经再生调控[4]密切相关,还参与了肌肉的生成与分化[5,6],并且在骨骼肌相关疾病的发生发展中起关键作用[7];已证实 circRNA在心肌纤维化、肺纤维化和肝脏纤维化等过程中均有发挥重要调控功能[8,9],但其在失神经支配骨骼肌尤其是颅神经损伤面颈部骨骼肌萎缩纤维化中的作用和机制尚不清楚。
本研究拟通过建立小鼠颅神经损伤面颈部骨骼肌萎缩纤维化模型,采用RNA测序(sequencing,RNA-seq)技术筛选出差异表达的circRNA,并对其可能的生物学功能及信号通路进行分析。由于C57小鼠喉体较小,喉返神经极细小、喉肌量少,形态观察及后期实验不够方便准确。因此本研究改用同为面颈部的失副神经支配胸锁乳突肌模型,且根据前期研究[1]选取失神经支配后1、2、3、4周作为分组标准,旨在为寻找预防或延缓失神经支配面颈部肌萎缩纤维化的新靶点,为提高晚期喉返神经修复的疗效提供参考。
1 材料与方法
1.1实验动物及分组 清洁级健康雄性12周龄C57BL/6雄性小鼠共50只,体重20~30 g,由海军军医大学附属长海医院中心实验室提供。随机分为5组,包括正常对照组和失神经支配1、2、3、4周组,每组10只小鼠。
1.2建立失神经支配胸锁乳突肌萎缩纤维化动物模型及骨骼肌样本采集 失神经支配1、2、3、4周组小鼠腹腔注射 4%水合氯醛行全身麻醉,仰卧位,颈部正中切口,分离出右侧胸锁乳突肌并在颅底处充分暴露出副神经主干,沿其根部剪除一段长约5 mm 副神经,使胸锁乳突肌失去神经支配;用5-0丝线结扎神经残端,缝合皮肤。对照组小鼠仅行右侧副神经探查后取胸锁乳突肌标本。失神经支配各组10只小鼠在相应时间点(失神经支配1、2、3、4周)于全身麻醉后取右侧胸锁乳突肌,收集到的每份标本均三等分,1/3用4%多聚甲醛固定后切片用作形态学观察,1/3匀浆后提取总RNA用作高通量测序,剩余1/3立即冻存于液氮备用。
1.3Masson染色 将固定后的肌肉标本常规脱水、浸蜡、包埋,制作6 μm的石蜡切片,脱蜡和水化后切片在蒸馏水中漂洗;根据Masson染色试剂盒(南京建城生物)的说明行Masson三色染色,染色显示细胞核呈黑色,肌肉呈红色,胶原呈蓝色;于40×光镜下用NikonEclipse600显微镜(日本东京)拍照,并使用IPP5.0软件测量胶原纤维组织截面积和肌纤维直径。每个样本取1张切片,随机选取5个独立的视野,分别计算各平均值。
1.4circRNA高通量测序 使用Magen Hipure Total RNA Mini Kit(Magen,Guangzhou,China)试剂盒,分别提取失神经支配4组及对照组样本总RNA,总RNA质检合格后,经探针去除核糖体RNA、核糖核酸外切酶 R去除线性RNA。采用Illumina Total RNA-seq(H/M/R)Library Prep Kit(Kapa Biosystems, Inc.Woburn, MA)文库制备试剂构建RNA-Seq文库,文库质量要求为最终文库有效浓度大于3 nM。文库构建合格后采用第二代高通量测序技术,以获得5组样本中所有的circRNA表达谱,测序平台为HiSeq X10 PE150。
1.5circRNA相关生物信息学分析 对原始数据进行过滤,获得有效数据后与参考基因组进行比对,比对结果用于下一步circRNA 的鉴定,采用DCC软件综合鉴定circRNA,得到高可信circRNA,筛选差异表达circRNA(P<0.05及|Fold chang|≥1.5)。使用R软件(clusterProfiler)对差异circRNA的亲本基因进行基因本体(gene ontology,GO)和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)富集分析。GO功能分析由生物过程(biological process,BP)、细胞组分(cellular component,CC)及分子功能(molecular function,MF)三部分组成,以失神经支配各组对比对照组的差异表达circRNA的亲本基因为集合,进行GO功能分析,计算每个GO条目中差异基因富集的显著性,以判定差异基因主要影响或涉及的生物学功能。生物通路富集分析主要依赖于KEGG数据库,以探讨差异表达的circRNA亲本基因参与各个信号通路的情况。显著富集标准:用超几何检验的方法计算GO条目(GO term)、KEEG条目(KEGG term)P值(P<0.05),overlapGeneCount(差异表达基因集合与 GO term 或KEGG term的交集基因数目)。
1.6统计学方法 通过TMM(trimmed mean of M-values)算法过滤表达过低的 circRNA(CPM>1),利用EdgeR软件工具进行差异表达circRNA的鉴定,通过检验的P值和倍数变化值筛选各个时间点相对于基线时的差异circRNA,差异表达分析标准为P<0.05及|Fold chang|≥1.5。(EdgeR软件提供)形态学研究统计方法采用统计软件SPSS 18.0进行分析,所有数据均以均数±标准差表示。
2 结果
2.1失神经支配胸锁乳突肌形态学观察结果 肉眼观察对照组及各失神经支配组胸锁乳突肌大体样本形态,随着失神经支配时间的延长,肌肉萎缩逐渐明显,Masson三色染色结果显示:随着失神经支配时间的延长,肌纤维平均直径及肌肉截面积逐渐缩小,胶原纤维截面积逐渐积聚增多(图1)。在神经损伤早期,肌肉萎缩纤维化尚不明显,失神经支配1周、2周组胶原纤维截面积、肌肉截面积及肌肉纤维直径与对照组相比差异无统计学意义(P>0.05);而失神经支配3周、4周组与对照组相比,以上指标差异明显(P<0.05)(表1);证明神经损伤后期骨骼肌组织萎缩纤维化显著,小鼠失神经支配胸锁乳突肌模型造模成功。

图1 失神经小鼠胸锁乳突肌Masson 染色形态学观察(40×) a.对照组;b.失神经支配1周组;c.失神经支配2周组;d.失神经支配3周组;e.失神经支配4周组

表1 对照组及失神经支配小鼠胸锁乳突肌Masson 染色定量分析比较
2.2失神经支配胸锁乳突肌中circRNA表达谱的差异分析 本研究在5组样本中共测序发现了3 090种不同的circRNA。具有差异性表达的circRNA共有1 386个,其中上调686个,下调700个。与对照组相比,失神经支配4组分别存在circRNA的差异表达(P<0.05及|Fold chang|≥1.5)(图2)。在神经损伤的早期,circRNA的表达谱即发生了显著变化,同时存在表达上调及下调的circRNA;并且随着失神经支配时间的延长,circRNA的表达谱持续发生变化,与对照组相比,上调的差异表达circRNA在失神经损伤1周有83个,失神经损伤2周有138个,失神经损伤3周组有314个,失神经损伤4周有151个;下调的差异表达circRNA在失神经损伤1周有103个,失神经损伤2周有149个,失神经损伤3周有204个,失神经损伤4周有244个。

图2 差异表达circRNA的火山图 a.失神经支配1周组 vs 对照组;b.失神经支配2周组vs 对照组;c.失神经支配3周组 vs 对照组;d.失神经支配4周组vs 对照组,横坐标为对应circRNA的倍数变化,纵坐标为对应circRNA差异表达的统计学意义。红点和绿点表示差异表达具有统计学意义的circRNA(P<0.05),其中红色表示显著上调的,绿色表示显著下调的;灰点表示差异表达不显著的circRNA(P>0.05)
2.3差异表达circRNA 亲本基因的功能富集分析结果 亲本基因GO分析结果显示:在生物学过程中,失神经损伤早期主要涉及肌损伤、肌原纤维组装、肌动蛋白丝过程的调节、肌细胞分化和发育等;而失神经损伤后期主要涉及肌细胞肥大、肌细胞程序性凋亡、骨骼肌收缩、细胞核固定、结缔组织增生等。在细胞成分方面,失神经损伤后差异circRNA亲本基因主要存在于肌原纤维、肌丝、收缩纤维、肌节内的肋状带(costamere)等,而costamere主要富集在失神经损伤4周组。在分子功能方面,失神经损伤后差异circRNA亲本基因主要参与了肌肉结构组成、蛋白质丝氨酸/苏氨酸激酶活性、与纤维化过程中重要的调节因子SMAD结合等,其中与SMAD结合这一分子功能富集在失神经损伤3周、4周组(图3)。

图3 差异表达circRNA 亲本基因的GO富集分析 a.失神经支配1周组 vs 对照组;b.失神经支配2周组vs 对照组;c.失神经支配3周组 vs 对照组;d.失神经支配4周组vs 对照组;横坐标表示差异表达circRNA亲本基因富集到的功能类别,纵坐标表示富集显著性,数字代表富集到该条目的差异表达circRNA亲本基因数目
KEGG通路富集分析结果表明,在失神经损伤后各时间点可同时受到多种机制的调控,在不同损伤时间点涉及的信号通路互有差别。分别总结了各实验组富集程度较高的前10条通路(失神经支配1周组总共预测到7条通路),结果显示失神经损伤早期主要在Apelin信号通路、钙信号通路、细胞周期、cGMP-PKG信号通路、局灶性粘连、泛素介导的蛋白水解等富集最显著;而失神经损伤晚期主要涉及泛素介导的蛋白水解、TGF-β信号通路、cGMP-PKG信号通路、紧密连接、FoxO信号通路、Apelin等信号通路,其中TGF-β信号通路、Apelin信号通路、FoxO信号通路与纤维化调控密切相关(图4)。
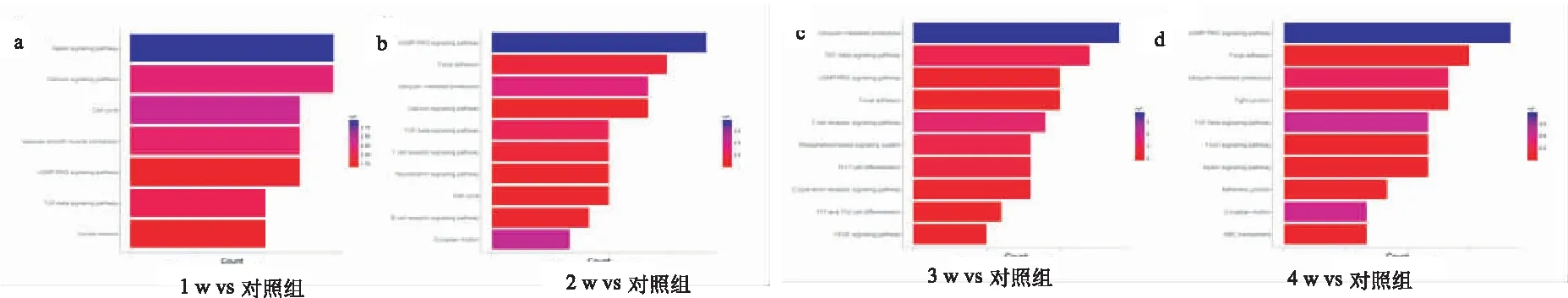
图4 差异表达circRNA 亲本基因的KEGG分析 a.失神经支配1周组 vs 对照组;b.失神经支配2周组vs 对照组;c.失神经支配3周组 vs 对照组;d.失神经支配4周组vs 对照组;纵坐标表示差异表达circRNA亲本基因富集到的信号通路名称,横坐标(count)表示富集到的差异表达circRNA亲本基因数目,颜色代表富集显著性(logP)
3 讨论
骨骼肌长期失神经支配后由于细胞外基质(extracellular matrix,ECM)成分大量聚集和肌细胞的萎缩纤维化,从而导致不可逆的病理改变,影响骨骼肌的神经再支配。这是导致晚期神经修复肌功能恢复不佳的的主要原因[10]。
circRNA广泛存在于真核细胞中,是一类具有一个闭合圆环形结构的非编码RNA。circRNA结构稳定,能够抵抗核糖核酸酶或核酸外切酶的降解,并且在组织发育阶段、不同疾病中具有特异性的表达[11],越来越多研究显示circRNA在基因网络调控中是至关重要的调节因子,在人类多种疾病的发生和发展中起重要作用。circRNA相较于miRNA(microRNA 微小RNA)或小干扰RNA,具有更稳定的结构和更低的脱靶作用,使得circRNA具有成为生物标志物和治疗靶标的潜力[2]。circRNA在周围神经损伤后修复的病理生理过程中参与调控轴突再生、神经修复[12];而circZfp609、circLMO7、circFUT10等在维持正常肌功能、调节肌发生、增殖、分化中发挥关键作用[13,14]。另有最新研究显示,多个circRNA参与多种组织器官,如:肝、肺、心的纤维化病变,其中hsa_ circ_0071410与辐射诱导的肝纤维化(RILF)相关,抑制hsa_ circ_0071410的表达可上调miR-9-5p并减弱辐射诱导的肝星状细胞(HSC)活化[15];circRNA-000203 和circRNA-010567可通过海绵状结合相应的miRNA,促进心肌成纤维细胞纤维化转型的发生[16];circZC3H4及其下游产物ZC3H4与巨噬细胞中的二氧化硅(SiO2)刺激呈正相关,可通过circZC3H4 RNA/ZC3H4途径激活肺成纤维细胞增殖和迁移[17]。Jeng 等(2009年)发现miRNA在失神经骨骼肌萎缩纤维化中起着重要作用。而circRNA存在多个miRNA互补结合位点,其对miRNA的“海绵样作用”暗示着circRNA可能参与调控失神经骨骼肌萎缩纤维化进程。本研究建立小鼠副神经损伤模型,应用RNA-seq技术检测失神经支配后1、2、3、4周胸锁乳突肌萎缩纤维化过程中circRNA的差异性表达,结果表明失神经支配各组胸锁乳突肌较对照组均存在大量差异表达的circRNA;提示差异表达circRNA可能在失神经损伤骨骼肌中发挥重要作用。进一步的生物信息学分析显示,这些差异候选circRNA 的亲本基因(来源基因)在失神经损伤的早期可能与肌损伤、肌细胞分化和发育等生物学功能相关;而后期主要与肌细胞的凋亡、结缔组织增生相关。差异表达circRNA亲本基因主要存在于肌原纤维、收缩纤维、肋状带等细胞组分。肋状带重点富集在失神经损伤后期,研究表明肋状带与肌萎缩过程密切相关[18]。这些差异表达circRNA亲本基因主要参与蛋白丝氨酸/苏氨酸激酶活性、SMAD结合等分子功能;SMAD蛋白可作为TGF-β1的底物,是促进TGF-β1介导组织纤维化的主要下游调节因子(Puisters,2009)。以上功能在失神经损伤的早期可能通过cGMP-PKG信号通路、血管平滑肌收缩等通路调控;其次通过泛素介导的蛋白水解、Apelin信号通路、神经营养蛋白信号等通路来调控。失神经损伤的后期则涉及TGF-β信号通路、Apelin信号通路、FoxO信号通路的介导。TGF-β信号通路除了涉及肿瘤、神经系统等疾病外,其异常激活更是组织细胞纤维化转型的重要病理机制[19]。研究表明神经损伤后可激活骨骼肌 TGF-β1/Smads 信号通路,在转录水平调控下游纤维化因子结缔组织生长因子(connective tissue growth factor,CTGF)等的表达,从而促进失神经支配骨骼肌萎缩纤维化[1]。近期发现Apelin信号通路激活后可增加成纤维细胞的增殖迁移,最终导致骨骼肌萎缩纤维化[20]。FoxO信号通路则与肌管的肌纤维萎缩有着密切的关系[21]。这些差异表达的circRNA在面颈部颅神经损伤后肌萎缩纤维化的具体作用以及是否确实通过以上信号通路调控该进程,有待进一步的深入研究和验证。
