电针对失神经骨骼肌萎缩大鼠自噬相关因子的影响
2021-05-21王晓玲范晓艳赵俊龙刘丽华李惠
王晓玲,范晓艳,赵俊龙,刘丽华,李惠
(1.渭南市中心医院,渭南 714000;2.陕西省康复医院,西安 710065;3.成都市温江区中医医院,成都 611130)
骨骼肌约占体质量的 40%,在氨基酸和葡萄糖代谢、蛋白质的储存和运动中发挥作用,骨骼肌的神经支配在决定肌肉结构和功能方面起着至关重要的作用[1]。失神经不仅导致肌肉萎缩和复杂的级联反应,而且预后很差,甚至会增加死亡率。完全失神经后,骨骼肌没有收缩活动,肌肉纤维迅速萎缩,肌肉质量丧失,导致功能受损[2]。研究认为萎缩肌肉中自噬负责在溶酶体中降解所有活细胞中不必要的或功能失调的细胞器和蛋白质,由此产生的分解产物会产生新的能量来维持细胞和组织的健康[3]。电刺激、伸展和强化运动等,被广泛用于神经再支配发生之前防止失神经肌肉萎缩[4]。电针作为有效缓解失神经骨骼肌萎缩的一种方法,被认为可有效促进周围神经损伤后功能的恢复及改善神经损伤的症状[5]。因此,本研究探讨电针对失神经骨骼肌萎缩大鼠自噬相关因子的影响,以期为失神经骨骼肌萎缩治疗提供理论依据。
1 材料与方法
1.1 实验动物与分组
健康SD雄性大鼠30只,体质量(260±10)g,8周龄,购自成都硕达实验动物有限公司,生产许可证号SCXK(川)2019-031,使用许可证号 SYXK(川)2018-119。大鼠适应性饲养1周,随机分为假手术组、模型组、电针组,每组10只。
1.2 主要试剂和仪器
HE染色试剂盒(上海碧云天生物),蛋白裂解试剂盒(江苏凯基生物),PCR引物(上海生工),RNA Miniprep试剂盒(上海西宝生物),总RNA提取试剂(北京天根),p62、LC3Ⅱ/LC3Ⅰ、Beclin-1抗体(英国Abcam),华佗牌电针仪SDZ-V型(苏州医疗用品厂),凝胶成像系统(美国Bio-Rad)。
1.3 模型制备
通过暴露并切断坐骨神经的方法制作失神经性腓肠肌萎缩动物模型。具体方法[6]为采用2.5%戊巴比妥钠(35 mg/kg)麻醉大鼠,将大鼠固定,充分暴露大鼠右后肢,使用已高压消毒的手术器械沿臀大肌间隙钝性分离、暴露坐骨神经,剥离坐骨神经后,用手术剪将模型组与电针组的大鼠坐骨神经中段切断,同时使两游离段反折产生2.0 mm的神经缺损,而假手术组只暴露但不切断坐骨神经。
1.4 电针干预
造模后第2天开始,每日9: 00将电针组的大鼠固定于柔软型大鼠固定器上,电针术侧足三里、承山两穴,针刺深度为5~7 mm,每日1次,每次10 min。穴位定位参照《大鼠穴位图谱的研制》以及李忠仁主编的《实验针灸学》[7];电针参数参考文献[8],强度1.5 mA疏波,频率为 5 Hz,以大鼠下肢稍震动为宜。为了避免强制固定时所导致的应激反应误差,假手术组和模型组每日只固定不做任何处理,连续21 d。
1.5 样本采集
实验过程中,电针组大鼠死亡2只,模型组和假手术组未出现死亡,样本采集过程中模型组和假手术组随机剔除 2只大鼠,样本均按每组8只采集分析。经2.5%戊巴比妥钠(35 mg/kg)将大鼠麻醉,迅速剥离双侧腓肠肌,称重,保留术侧腓肠肌,迅速采用 PBS缓冲液冲洗后,分 2部分,一部分采用多聚甲醛,一部分﹣80 ℃冰箱保存,待测。
1.6 观察指标
1.6.1 各组大鼠腓肠肌湿重比计算
取材时用电子天平称重并记录双侧腓肠肌湿重,计算腓肠肌湿重比为(术侧肌湿重/健侧肌湿重)×100%。
1.6.2 腓肠肌组织病理观察
HE染色,腓肠肌组织石蜡包埋,切片(约3~5 µm),脱水,苏木精染色,后用伊红染色,然后用乙醇梯度脱水、二甲苯透明、中性橡胶密封,显微镜下观察组织形态学变化。Masson染色,常规石蜡切片脱蜡至水洗,酸性高锰酸钾氧化,冲洗,草酸漂白,冲洗后放入蒸馏水中洗涤,用变色酸2R试剂染色,冰醋酸洗涤,磷钨酸分化,倾去余液放入 1%~2%苯胺蓝染色,再用冰醋酸水洗涤,封片,镜检观察。
1.6.3 Western blot检测
采用裂解试剂盒从腓肠肌中提取蛋白,总蛋白样品进行SDS-PAGE电泳,然后将蛋白转移到PVDF膜,用5%的脱脂牛奶溶于 Tris-Buffered生理盐水(TBS)进行封闭。将膜与下列一抗在4 ℃下孵育过夜,p62、LC3Ⅱ/LC3Ⅰ、Beclin-1(均1:1 000)。经3次洗涤后,在37 ℃孵育2 h,用辣根过氧化物酶(HRP)标记的羊抗鼠抗体孵育。取出聚偏氟乙烯膜,化学发光法获得胶片后进行图像采集,目标条带A值采用Quantity One凝胶图像软件分析,结果以p62、Beclin-1与β-actin INT值的比值及LC3Ⅱ/LC3Ⅰ INT值的比值进行分析。
1.6.4 qRT-PCR检测
采用总 RNA Miniprep试剂盒从腓肠肌中提取总RNA,用逆转录酶合成cDNA,采用TaqMan miRNA检测试剂盒进行 qRT-PCR。以 GAPDH 作为内参,用 2-∆∆CT分析相关基因表达。qPCR引物为Beclin-1,正向5'-GCTCCT ATTCCATCAAAACCCA-3',反向 5'-GTGAGGACACCCAAGCAA GAC-3';Vps34,正向5'-GAAAATATGGCATGTT TCGCC-3',反向5'-GTTCGTGTGGGTTCGGAGC-3';LC3,正向5'-AGAG CGATACAAGGGTGAGAAGC-3',反向 5'-CAGGAGGAAGAAGGC TTGGTTAG-3';GAPDH,正向5'-CGGAGTCAACGGATTTGGTC GTAT-3',反向5'-AGCCTTCTCCATGGTGGTGAAGAC-3'。
1.7 统计学分析
采用SPSS20.0软件进行统计处理。符合正态分布的数据以均数±标准差表示,组间比较采用单因素方差统计分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 各组大鼠腓肠肌湿重比变化
与假手术组相比,模型组腓肠肌湿重比明显降低(P<0.01);与模型组相比,电针组的腓肠肌湿重比明显升高(P<0.01)。详见表1。
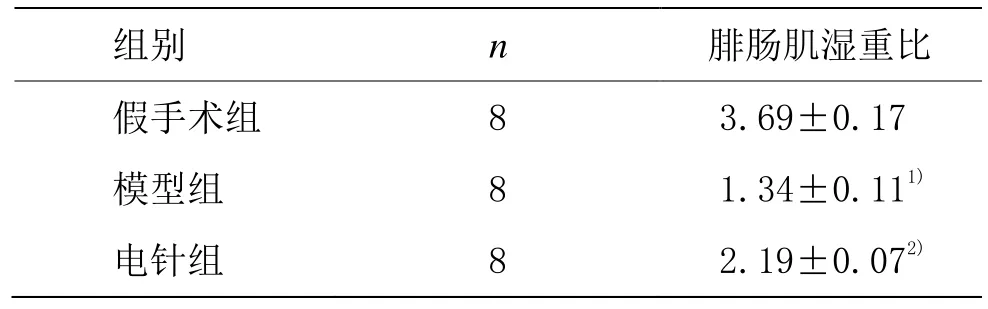
表1 各组大鼠腓肠肌湿重比变化
2.2 各组大鼠腓肠肌组织形态学变化
HE染色,假手术组肌肉组织内肌纤维排列较整齐,肌束结构较清晰,呈扁圆形或椭圆形,核位于边缘,肌纤维胞质染色较均匀;肌间可见丰富的血管、神经等分布;局部肌纤维排列较稀疏,肌束大小不一,未见明显纤维组织增生。模型组肌肉组织内部分肌纤维严重萎缩变形,体积变小,细胞坏死或溶解;肌间较多纤维组织增生。电针组肌肉组织内少量肌纤维轻微萎缩;肌间少量纤维组织增生(图1)。
Masson染色,假手术组腓肠肌肌纤维排列整齐且形态较规则,并无明显萎缩。模型组与电针组术侧腓肠肌萎缩明显,其形态较假手术组明显缩小,胶原纤维逐渐增多且肌纤维间距因胶原纤维的增生而变宽。但电针组与模型组相比,腓肠肌萎缩明显减轻(图1)。
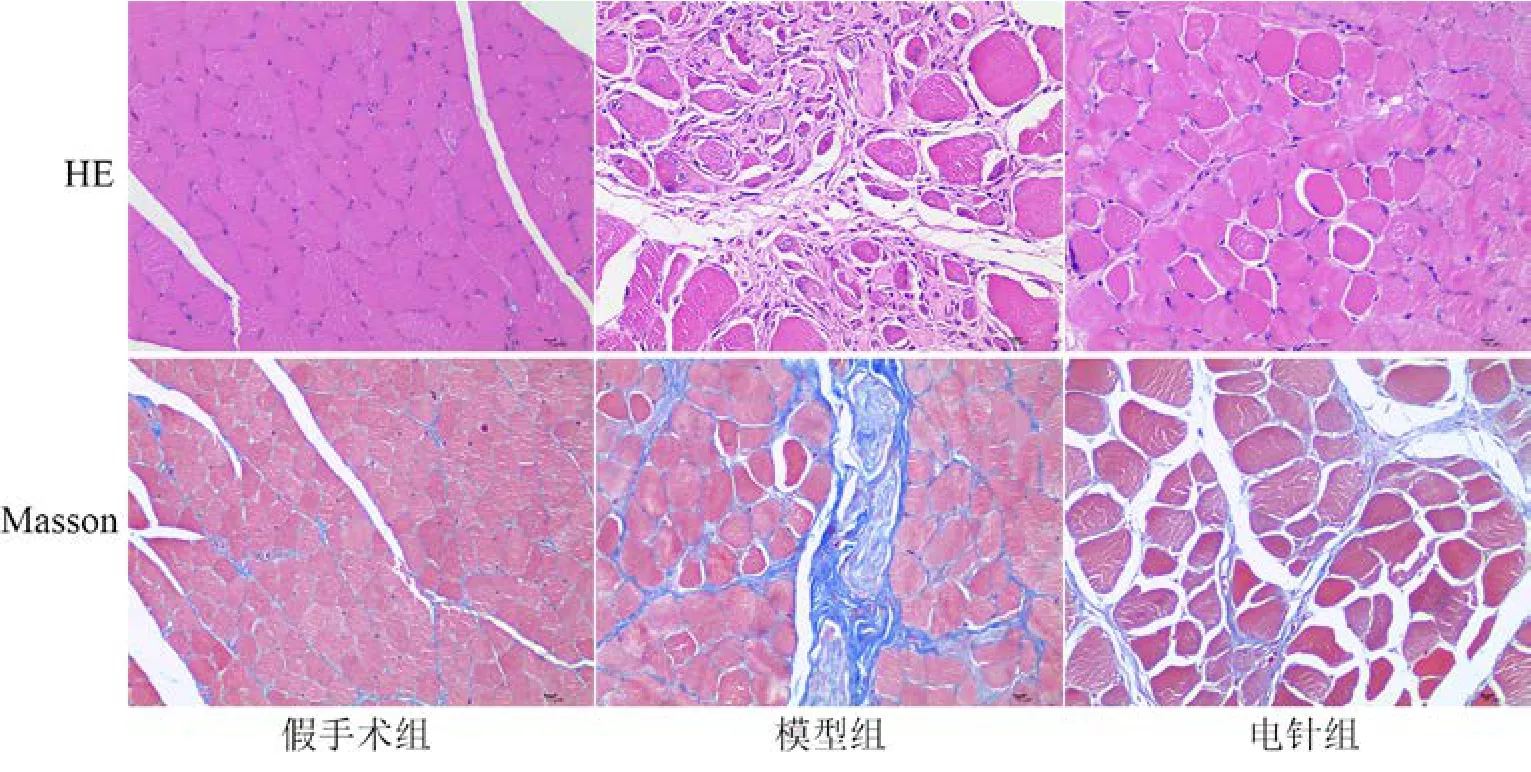
图1 各组大鼠腓肠肌组织形态学变化(×400)
2.3 各组大鼠腓肠肌组织 p62、LC3Ⅱ/LC3Ⅰ、Beclin-1蛋白水平比较
与假手术组比较,模型组 p62、LC3Ⅱ/LC3Ⅰ、Beclin-1蛋白水平升高(P<0.05,P<0.01);与模型组比较,电针组 Beclin-1蛋白水平降低(P<0.05),p62、LC3Ⅱ/LC3Ⅰ蛋白水平无明显变化(P>0.05)(图2)。

图2 各组大鼠腓肠肌组织p62、LC3Ⅱ/LC3Ⅰ、Beclin-1水平
2.4 各组大鼠腓肠肌组织 Beclin-1、Vps34、LC3Ⅱ/LC3Ⅰ mRNA水平比较
与假手术组比较,模型组 Beclin-1、Vps34、LC3Ⅱ/LC3Ⅰ mRNA水平升高(P<0.05,P<0.01);与模型组比较,电针组Beclin-1、Vps34、LC3Ⅱ/LC3Ⅰ mRNA水平降低(P<0.05)。详见表2。
表 2 各组大鼠腓肠肌组织 Beclin-1、Vps34、LC3Ⅱ/LC3Ⅰ mRNA水平比较 (±s)
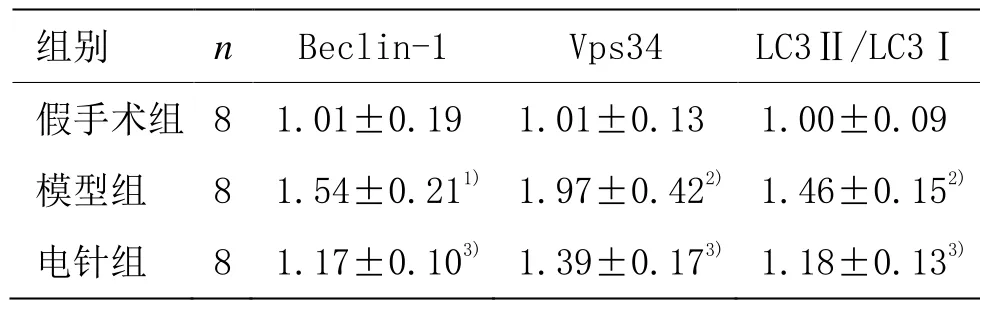
表 2 各组大鼠腓肠肌组织 Beclin-1、Vps34、LC3Ⅱ/LC3Ⅰ mRNA水平比较 (±s)
注:与假手术组比较 1)P<0.05,2)P<0.01;与模型组比较 3)P<0.05
组别 n Beclin-1 Vps34 LC3Ⅱ/LC3Ⅰ假手术组 8 1.01±0.19 1.01±0.13 1.00±0.09模型组 8 1.54±0.211) 1.97±0.422) 1.46±0.152)电针组 8 1.17±0.103) 1.39±0.173) 1.18±0.133)
3 讨论
失神经导致肌肉质量下降,肌肉纤维横截面积减少,肌力产生减少,肌周和肌内结缔组织增多,这一阶段之后是进行性的肌肉纤维坏死和凋亡,肌肉被纤维结缔组织和脂肪取代[9]。通过加速目标肌肉的轴突再生和减缓萎缩的进程,从而提高肌肉的功能,可以改善神经损伤和修复后的运动恢复。研究指出神经修复后在神经再生过程中进行肌肉电刺激可以最大限度地减少失神经期间的肌肉萎缩[10]。在失神经肌肉中使用电刺激治疗,结缔组织含量减少,肌肉纤维面积增加[11]。此外,电刺激可明显改善肌肉机械性能[12]。本研究结果显示,电针组的腓肠肌湿重比明显高于模型组,电针组肌肉组织内少量肌纤维轻微萎缩,肌间少量纤维组织增生,腓肠肌萎缩明显低于模型组。与上述报道一致,表明电针可以有效延缓失神经骨骼肌萎缩进程。
自噬是细胞降解、自我消化及维持内环境稳定的重要机制。通过自噬选择性地处理有缺陷的细胞成分可以在衰老过程中保护许多组织的细胞功能[13]。肌纤维萎缩的典型原因是蛋白质合成减少和蛋白质降解增加,这主要是由泛素-蛋白酶体系统的活性和自噬决定的[14]。骨骼肌中自噬的过度活化会加重肌肉萎缩,但抑制自噬会导致肌肉无力、萎缩、肌纤维变性,在去神经时抑制自噬会加剧肌肉质量损失,受损蛋白质和细胞器的积累从而影响组织的维持。自噬在幼鼠肌肉中的诱导会导致肌纤维萎缩,肌肉质量下降,肌肉力量成比例下降[15]。此外,赵伟等[16]报道提示电针可能通过促进自噬来延缓肌萎缩。自噬相关基因Beclin-1能介导其他自噬蛋白质定位于自噬前体,Vps34可与Beclin1、Vps15形成Ⅲ型磷脂酰肌醇3激酶复合物,在自噬体形成早期发挥重要的作用[17]。LC3Ⅱ/LC3Ⅰ被认为是检测自噬的重要指标之一,LC3参与了自噬体膜的形成,细胞内LC3经过Atg4加工成为胞浆可溶形式LC3Ⅰ,LC3Ⅰ再经Atg3、Atg7的作用,与自噬体膜上的PE结合成为 LC3Ⅱ,促进了自噬体膜的延伸,可追踪自噬的整个过程,LC3Ⅱ/LC3Ⅰ比值可以反映出自噬的活性[18]。研究[17]发现亮氨酸的抗萎缩作用依赖于 Vps34活性,文献[19]报道电针干预可能通过抑制自噬相关基因Beclin1、Atg5等表达,从而维持骨骼肌细胞稳态,延缓失神经骨骼肌萎缩。此外,研究[18]发现CSRP3沉默可抑制自噬相关LC3和Beclin-1蛋白的积累,从而使成肌细胞自噬受损。本研究表明模型组p62、LC3Ⅱ/LC3Ⅰ、Beclin-1 蛋白水平及 Beclin-1、Vps34、LC3Ⅱ/LC3Ⅰ mRNA表达较假手术组升高,电针组Beclin-1蛋白水平及Beclin-1、Vps34、LC3Ⅱ/LC3Ⅰ mRNA表达较模型组降低。研究结果与文献[16]报道不一致,可能是由于自噬的过度激活会造成肌肉萎缩,研究结果与文献[19]报道一致,说明自噬活性在大鼠失神经后升高,肌肉在早期可能进行自我修复,电针干预后促进细胞自噬活性增强的作用下降,抑制自噬过度激活。
综上,电针可改善失神经骨骼肌萎缩程度,下调自噬相关因子 Beclin-1、Vps34、LC3Ⅱ/LC3Ⅰ表达,自噬可能为电针延缓失神经骨骼肌萎缩进程机制之一。
