人血浆中纤维蛋白溶酶原纯化工艺样品蛋白含量改良BCA检测方法的建立及验证
2021-05-19胡勇纪德铭詹骞陈克金彭焱周雁翔岳胜兰李娟周志军
胡勇,纪德铭,詹骞,陈克金,彭焱,周雁翔,岳胜兰,李娟,周志军
国药集团武汉血液制品有限公司,湖北武汉430207
纤维蛋白溶酶原(plasminogen,Pg)为一种主要由肝细胞产生后分泌进入血浆的蛋白质。人体内Pg水平较低或结构异常通常会造成纤维蛋白溶酶原含量不足或功能异常,引起Pg缺乏症[1-4]。Ⅰ型Pg缺乏症严重影响患者生活质量并可能危及生命,患者需长期周期性注射Pg清除木质化病变缓解病症[5]。2000年,Grifols公司以Cohn FⅡ+Ⅲ沉淀为原料纯化Pg结合低温乙醇和沉淀获得98%纯度产品[6]。2006年,Kedrion公司采用亲和层析从血浆中纯化Pg[7]。国药集团武汉血液制品有限公司(简称武汉血制)应用行层析法制备Pg的工艺研究,其中蛋白含量检测是生产过程质量控制的主要指标,通过Pg抗原含量与总蛋白含量之比可计算相对纯度,通过Pg效价与总蛋白含量之比可计算比活性。
《中国药典》三部(2015版)收录了6种蛋白质含量测定方法:凯氏定氮法、Lorry法、双缩脲法、BCA法、考马斯亮蓝法(Brandford法)及紫外-可见光光度法[8]。其中凯氏定氮法使用较多,但其操作时间较长,且多用于成品检定,不能满足生产过程中样品的快速检测需要;BCA法为双缩脲法的改良方法,较Lowry法快4倍,重复性优于考马斯亮蓝法,干扰物质主要有硫酸铵、Tris缓冲液及某些氨基酸等。PierceTMBCA蛋白检测试剂盒是一种基于二喹啉甲酸(BCA)利用比色法测定总蛋白浓度的蛋白定量试剂盒,其操作步骤简单方便,灵敏度高,不受样品中绝大部分去污剂等化学物质的影响,线性关系良好[9]。
Pg在工艺摸索阶段需快速准确检测蛋白含量,为工艺优化提供数据支持,考虑Pg纯化工艺中使用去污剂、有机溶剂及某些氨基酸,又因BCA法在检测凝血因子Ⅷ蛋白含量已有经验[10],因此采用BCA法检测Pg纯化工艺中样品的蛋白含量。本工艺过程的缓冲液中涉及多种特殊成分,需对其干扰性进行分析;在无Pg浓缩物质量标准品的情况下,本实验用牛血清白蛋白(BSA)作为内控标准品,对改良后的BCA方法进行验证,并与凯氏定氮法及双缩脲法进行比较,以期该方法能适用于Pg纯化过程样品(中间品、原液、半成品及成品)的蛋白含量检测。
1 材料与方法
1.1 样品及国家标准品201903003批Pg工艺样品含纯化工艺中间样品[包括Q离子交换层析的上样液及洗脱液;亲和层析的上样液及洗脱液19003-6;离子交换SP层析的上样液及洗脱液19003-14;原液19003-18(不含氨基酸)及半成品19003-19-6(含蔗糖+甘氨酸)]、含特殊组分的纯化缓冲液[包括亲和层析洗脱缓冲液P250[含6-氨基己酸(EACA)、亲和层析洗涤缓冲液P258(含辛酸钠)、超滤缓冲液1-P555(含蔗糖及甘氨酸)及1%有机溶剂/去污剂(S/D,含1%Tween80+0.3%磷酸三丁酯)]及2019-02001批Pg超滤缓冲液2-P638(含盐酸精氨酸)、Pg半成品19001-18(含盐酸精氨酸)、201811003批Pg过程样品18003-14(SP层析洗脱液)、201903002批Pg原液19002-18(不含氨基酸)均由武汉血制提供;BSA国家标准品购自中国食品药品检定研究院(21.8 mg/支),使用前由武汉血制质量控制室稀释至10 000μg/mL。
1.2 主要试剂及仪器PierceTMBCA蛋白检测试剂盒[含试剂A(批号:MF157262)、试剂B(批号:MF16-601)及BSA标准品(浓度:2 000μg/mL,批号:MD157596)]及酶标仪Spectromax Plus384均购自美国Molecular Devices公司。
1.3 BCA方法的改良
结合PierceTMBCA蛋白检测试剂盒的试管法与微孔板法,即样品50μL加950μL工作液(试剂A∶试剂B=50∶1)在1.5 mL EP管中反应,37℃水浴箱内孵育30 min(试管法);取出EP管,将混合物加入微孔板中,200μL/孔,每孔进行3个重复,在波长562 nm处读取吸光度值(微孔板法)。
1.3.1 样品准备 将冷冻保存的血浆蛋白或组分样品解冻,用生理盐水稀释至0.1~2 mg/mL,确保样品的终蛋白浓度在线性范围内。如样品中的基础液对BCA有干扰,需将样品稀释至不产生干扰的最高浓度以下。
1.3.2 标准品的配制 用生理盐水精确稀释试剂盒BSA标准品,进行2倍系列稀释,分别配制为2 000、1 000、500、250、125、62.5及31.25μg/mL 7个稀释度(编号分别为St00~St06),以生理盐水为空白对照。
1.3.3 质控品的配制 用0.9%氯化钠溶液精确稀释试剂盒BSA标准品为1 500、750、150、62.5μg/mL,分别作为高、中、低及检测下限浓度质控品。
1.3.4 BCA工作液的配制 将试剂A与试剂B按50∶1混匀为清澈透明淡绿色液体,即为工作液,按下式计算其总体积。

1.3.5 检测步骤 在每个EP管中依次加入标准品、质控品、空白对照及待测样品,50μL/管,每个EP管再分别加入950μL BCA工作液,充分混匀,密封,置37℃水浴箱内孵育30 min。在酶标仪上的BCA模板中输入样品分布图。取出稀释管,按分布图将混合物加入酶标板中,200μL/管,于波长562 nm处读取吸光度值。
1.3.6 结果计算BCA蛋白检测试剂盒默认用一次方程拟合标准曲线,计算每个待测样品蛋白含量的均值和CV。必要时,根据说明书提供的蛋白变换系数进行校正。
1.3.7 评价标准 试剂盒BCA标准品各稀释度的回算值及质控品的实测值应在理论值的±10%之间。标准曲线的R2应≥0.990,若R2<0.990,检查标准品各稀释度的A562,若3个测试结果中含有异常值,此3个测试值需进行Q检验,若在90%的可信区间范围内,Q检验值>0.94,则该值可视为异常值剔除,余下的2个测试值取均值用于标准曲线的计算。当被测样品蛋白含量<100μg/mL时,需采用微量法模式,修正标准曲线,分析样品蛋白浓度。
1.4 方法的确定
1.4.1 拟合曲线及线性范围的确定 将试剂盒附带BCA标准品按1.3.2项配制7个稀释度,反应完成后将蛋白含量的结果分别进行一次方程及二次方程线性拟合,再将每个稀释度A562的均值代入各自的拟合方程获得对应稀释品的回算值,计算各稀释度的蛋白回收率、各稀释度A562的CV、曲线的相关系数R2,确定线性范围及拟合方式。接受标准:标准曲线各稀释度A562的CV≤10.0%;标准曲线的R2≥0.99,高、中、低浓度质控品的蛋白回收率为理论值的90%~110%,检测下限质控品的蛋白回收率为理论值的85%~115%。按下式计算蛋白回收率。

1.4.2 内控标准品的确定 将BSA国家标准品用0.85%生理盐水稀释为2 000μg/mL,与试剂盒BSA标准品同时按1.3.2项分别制备6个稀释度(编号分别为GB01~GB06和Kit01~Kit06)。反应完成后,以BSA国家标准品的A562与理论值进行标准曲线拟合,将试剂盒BSA标准品所有稀释度的A562代入标准曲线,不同稀释度的实测值乘以稀释倍数的均值即为试剂盒BSA标准品的标定值;以试剂盒BSA标准品的A562与理论值进行标准曲线拟合,将BSA国家标准品的所有稀释度的A562代入标准曲线,不同稀释度的实测值乘以稀释倍数的均值即为BSA国家标准品的标定值;计算各不同稀释度的标定值的CV及回收率,确定内控标准品。接受标准:标定值为理论值的95%~105%。
1.4.3 平行性
1.4.3.1 样品稀释201903003批Pg纯化工艺中亲和层析洗脱液19003-6、离子交换SP层析洗脱液19003-14及半成品19003-19-6均为含Pg的组分。根据前期多次试验检测结果,Pg亲和层析洗脱液蛋白含量约2 000μg/mL,离子交换SP层析洗脱液及半成品蛋白含量约7 000μg/mL,将亲和层析洗脱液进行2、4及8倍稀释,离子交换SP层析洗脱液及半成品进行4、8及16倍稀释,使其蛋白含量(约250~2 000μg/mL)均在线性范围内。
1.4.3.2 标准品的稀释 将内控标准品按1、2、4、8、16及32倍稀释6个浓度,制备标准曲线,将BSA国家标准品按5、10、20、40、80及160倍稀释6个浓度,使其蛋白含量在线性范围内。
1.4.3.3 检测及结果分析 按改良BCA法进行检测,以内控标准品制备标准曲线分别检测BSA国家标准品、亲和层析洗脱液19003-6、离子交换SP层析洗脱液19003-14及半成品19003-19-6,将5组样品的A562与稀释倍数用Softmax 5.2软件进行双对数拟合,获得曲线1(内控标准品)、2(离子交换SP层析洗脱液19003-14)、3(半成品19003-19-6)、4(亲和层析洗脱液19003-6)及6(BSA国家标准品)。通过对标准曲线上不同稀释度的斜率(B值)变化,计算不同曲线B值之间的CV。取5条曲线的CV小于5%时标准曲线的浓度范围,以此作为检测样品稀释的最适范围。接受标准:各样品拟合曲线的R2绝对值>0.98;各曲线B值的CV≤5%。
1.5 方法的验证
1.5.1 准确性及精密性 将BSA国家标准品用0.85%生理盐水稀释为2 000μg/mL,与高、中、低及检测下限质控品由不同人员于不同时间按改良BCA方法分别各检测3批,连续检测3次。计算样品蛋白含量的CV及回收率。准确性接受标准:蛋白回收率在85%~115%之间;精密性接受标准:批内及批间蛋白含量的CV均≤10%。
1.5.2 选择性201903003批含有特殊组分的Pg纯化缓冲液及201902001批Pg超滤缓冲液2-P638中按10∶1分别加入内控标准品(终浓度为200μg/mL),采用改良BCA法进行检测,判断特殊组分对检测是否有影响。若有影响,则继续按10∶1加入内控标准品,确定其不干扰试验的浓度。接受标准:各混合液的蛋白回收率在内控标准品理论值的90%~110%之间。
1.6 改良BCA法与凯氏定氮法及双缩脲法检测的比较 将不同配方的Pg过程样品18003-14(离子交换SP洗脱液)、原液19003-18(不含氨基酸)、半成品19003-19-6(含蔗糖+甘氨酸)、半成品19001-18(含盐酸精氨酸)、原液19002-18(不含氨基酸)分别送武汉血制QC及成都蓉生药业有限责任公司(简称蓉生公司)QC进行双缩脲法(分别采用BSA和人血清白蛋白作为标准品)及凯氏定氮法进行蛋白含量的检测。比较3种方法检测结果的符合性。
1.7 方法的应用 采用改良的BCA法对201903003小试工艺样品(从原料血浆至经纯化获得半成品)进行全流程质量监控,检测Pg所在组分的效价、抗原含量及蛋白含量,计算比活性(效价/蛋白含量)及相对纯度(抗原含量占蛋白含量的百分比),判断该工艺制备的原液及半成品是否符合武汉血制Pg的质量规程要求(比活性大于4.0 U/mg)。
2 结果
2.1 方法的确定
2.1.1 拟合曲线及线性范围BSA标准品曲线按一次函数进行线性拟合,其线性范围在125~2 000μg/mL,线性方程为Y=0.041+0.007 86X,R2为0.997;按二次函数进行线性拟合,其线性范围在62.5~2 000μg/mL,线性方程为Y=0.014 3+0.000933X-7.36×10-8X2,R2为0.999。见表1。选择二次函数为标准曲线的最适拟合。
2.1.2 内控标准品的确定 结果显示,BSA国家标准品标定试剂盒BSA标准品的蛋白含量为2 090μg/mL,回收率为其标示值的104.48%;试剂盒BSA标准品标定BSA国家标准品的蛋白含量为9 666μg/mL,回收率为其标示值的96.66%;二者均符合接受标准。见表2。考虑成本,选择试剂盒BSA标准品为后续试验的内控标准品。
2.1.3 平行性 选取内控标准品标准曲线浓度在250~2 000μg/mL之间的4个浓度进行双对数曲线拟合时,与其他4条曲线(3个稀释度)间B值CV相对最小为3.524%,5条拟合曲线的R2均>0.98,见图1。表明蛋白浓度在此区间内时,BSA标准品的曲线与Pg浓缩物所在的工艺样品的曲线的平行性最好,结果准确性最高。
2.2 方法的验证
2.2.1 准确性及精密性3批各浓度质控品及BSA国家标准品的蛋白回收率在88.61%~103.78%之间,准确性良好;批内及批间的蛋白含量的CV在0.3%~9.35%,精密性良好。见表3和表4。

表1 BSA标准品7个稀释度一次及二次方程拟合处理标准曲线的数据结果Tab.1 Results of linear equation and quadratic equation fitting to process standard curve data on standard BSA

图1 Softmax软件对5组样品检测数据的平行性分析Fig.1 Parallel analysis of detection data of five groups of samples by Softmax software
2.2.2 选择性 结果显示,1~500 mmol/L EACA、2~20 g/L蔗糖、0.5~5 g/L甘氨酸、0.3%~3%盐酸精氨酸及150 mmol/L辛酸钠的检测结果均为负值,添加内控标准品后回收率在95%~105%之间,表明这些浓度的特殊组分对检测无影响;1%S/D稀释40倍的检测值与检测下限62.5μg/mL的检测值相近,该浓度添加标准品的混合物的检测回收率符合接受标准(90%~110%),但此样品浓度稀释40倍后小于检测下限,因此实际操作中仍以20倍稀释,计算结果除以20作为实测值。见表5。
2.3 改良BCA法与凯氏定氮及双缩脲法检测结果的比较 采用改良BCA法检测结果与武汉血制、蓉生公司所用的双缩脲法(不同标准品结果稍有差异)及凯氏定氮法结果符合性良好,配方中的氨基酸对BCA检测无影响,见表6。表明该方法既可用于纯化过程样品的检测,也可用于原液、半成品的检测。
2.4 方法的应用 对201903003批工艺过程样品的比活性和相对纯度的计算结果显示,本Pg纯化工艺可获得比活性>8 U/mg的Pg半成品,符合工艺拟定质量标准要求;Pg原液的相对纯度达81.94%。见表7。
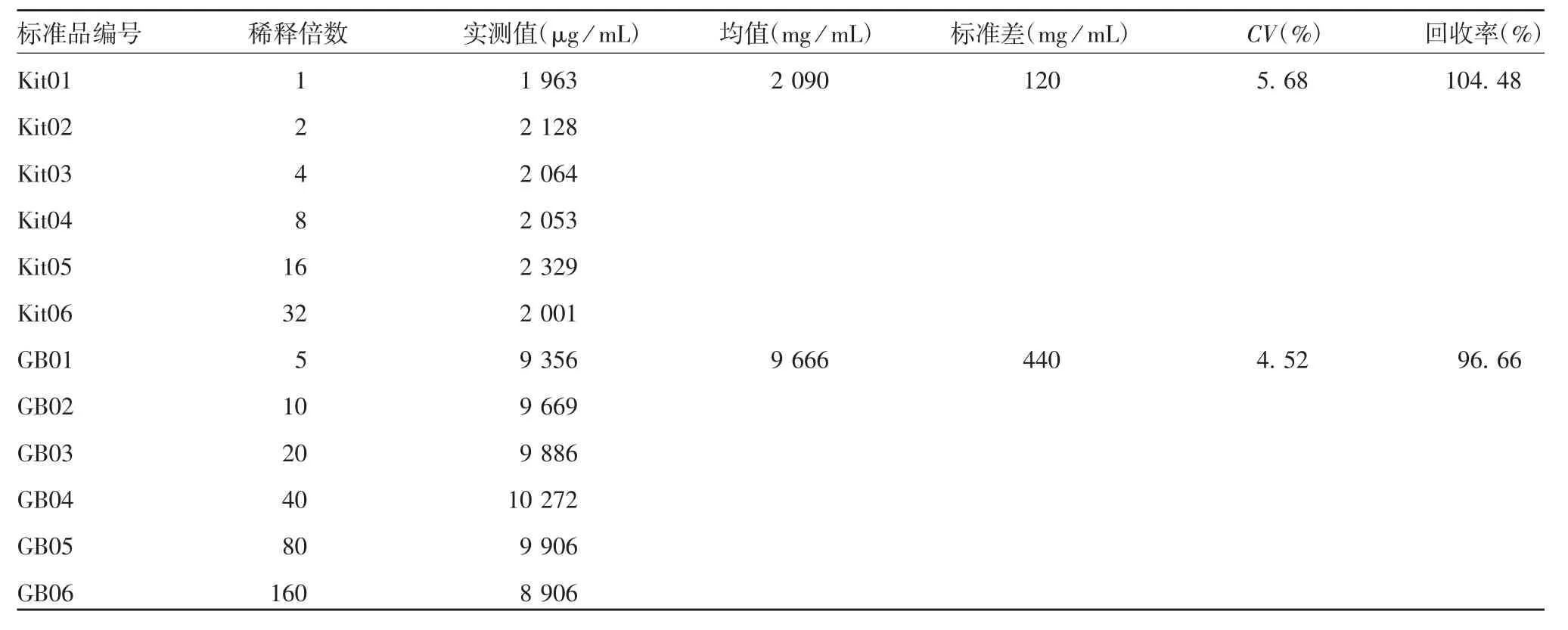
表2 BSA国家标准品与试剂盒标准品的互标结果Tab.2 Results of mutual standardization between national standard and kit standard
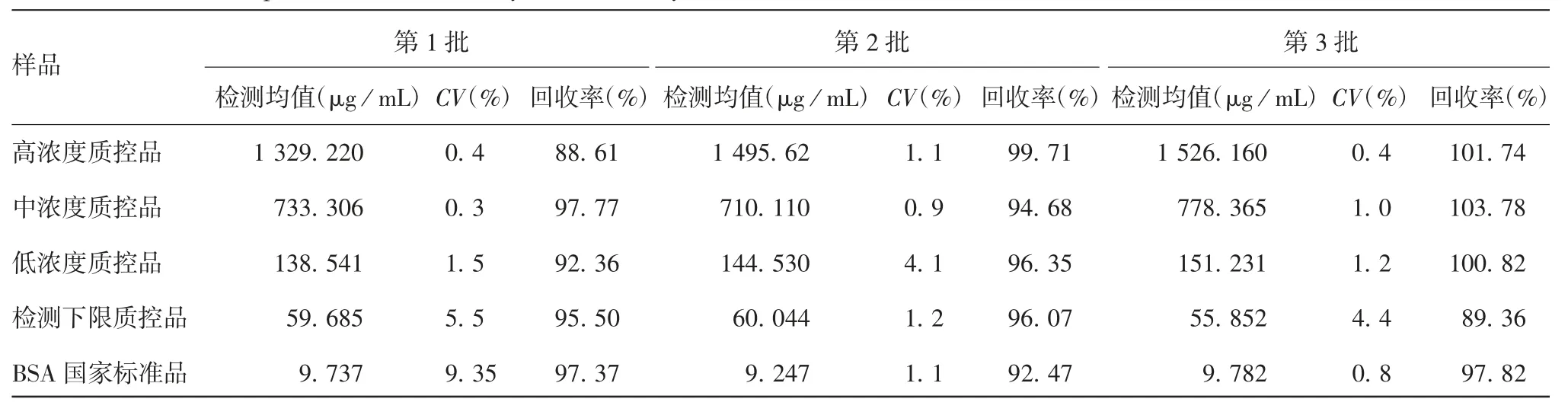
表3 批内精密度及准确度验证的结果(n=3)Tab.3 Validation for precision and accuracy in intra-assay(n=3)

表4 批间精密度验证结果(n=3)Tab.4 Validation for precision in inter-assay(n=3)

表5 特殊组分对内控标准品的干扰试验Tab.5 Results of addition test of different concentrations of special components and corresponding standards
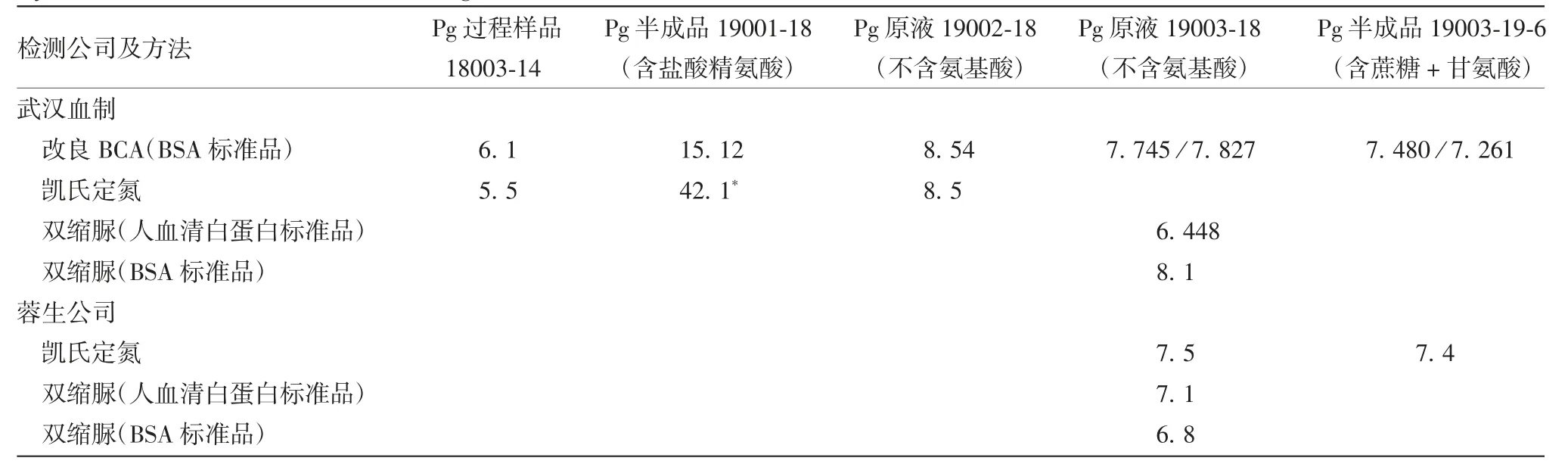
表6 改良BCA法与凯氏定氮法及双缩脲法检测Pg工艺全过程的蛋白含量(mg/mL)Tab.6 Comparison of determination results of protein content in samples taken from whole process by modified BCA method,Kjeldahl method and biuret method(mg/mL)

表7 201903003批工艺全过程样品的比活性及相对纯度Tab.7 Specific activity and relative purity of whole process sample of Lot 201903003
3 讨论
本实验将BCA蛋白检测试剂盒的双缩脲反应与显色反应结合在一起:前者为在碱性介质中,蛋白将Cu2+还原为Cu+;后者为使用含有BCA的独特试剂,利用比色法检测Cu2+,2分子的BCA与1分子的Cu2+形成紫色络合物,该水溶性复合物在波长562 nm处有很强的吸光度值,该吸光度值与蛋白浓度在20~2 000μg/mL的范围内有良好的线性关系,具有高灵敏度及高选择性的特点[4]。
该试剂盒推荐试管法和微孔板法两种检测方案,二者均采用线性拟合标准曲线,试管法检测样品的敏感度高于微孔板法,但测定时需逐个操作,耗时繁琐;微孔板法与酶标仪配合使用,读数快速方便,且应用配套软件进行统计学分析,在样品数量多时更有优势,但在克服干扰物质对测定结果的影响方面灵活度低,且检测浓度较低的样品不如试管法灵敏。为满足研发阶段的样品数量多,且敏感度要高的要求,本实验采用试管法中样品与工作液的混合比例为1∶20,于37℃孵育30 min,再用酶标板法的读数方式与软件处理模式(曲线拟合算法)相结合来进行蛋白含量的测定。在实际操作中,对数据的拟合方式进行了优化,选择二次函数的最适曲线拟合使其线性范围更宽,准确度更高。
多数蛋白定量方法采用BSA或免疫球蛋白作为标准品测定待测样品的蛋白含量,若对蛋白定量的准确性要求特别高时,需使用纯化的目标蛋白绘制标准曲线[9]。由于目前市场上无Pg浓缩制剂的国际标准品,仅能用试剂盒内BSA作为标准品绘制标准曲线检测纯化的Pg浓缩物样品,就需对二者的相关性进行比较,通过平行性分析来判断检测的一致性。本方法的线性范围在62.5~2 000μg/mL之间可对所有工艺样品进行检测,但是平行性结果显示,在250~2 000μg/mL之间时,BSA的曲线与Pg浓缩物所在工艺样品的曲线的平行性最好,因此Pg浓缩物样品最好稀释在此范围内,得到的结果准确性较高。同时,用BSA作为标准品检测Pg纯化工艺样品的BCA法不需换算蛋白质系数。
已知某些物质会干扰BCA定量分析,包括还原性物质、螯合剂及强酸强碱;另外一些物质对BCA定量分析干扰程度较低,当其在原始样品中的含量低于某特定浓度时,仅对结果造成微小影响(可耐受),如由于一定浓度某物质的存在而引入的蛋白质含量(添加标准品实验)估算误差≤10%,则认为当该物质低于此浓度时与BCA定量分析法兼容[9]。本研究结果显示,150 mmol/L辛酸钠、500 mmol/L EACA、20 g/L蔗糖、5 g/L甘氨酸、3%盐酸精氨酸对检测无影响,但S/D(0.3%磷酸三丁酯+1%吐温80)对检测有干扰(增强)。其原因是多种干扰物质可能产生加和作用,当缓冲液中含有多种干扰物质时,即使其中单一干扰物质低于其可兼容浓度(5%吐温80),总体仍可能对蛋白的定量分析产生干扰,推测是有机溶剂磷酸三丁酯对试验的叠加干扰。
BCA法一般多用于研发阶段的过程样品检定,生物制品的成品、原液/半成品多为凯氏定氮法及双缩脲法。本实验在新产品研发过程中考虑最终检定方法与过程检定一致性的需要,将BCA法检测结果与凯氏定氮法及双缩脲法的结果进行比较,改良BCA法具有快速、准确、高通量的优点,既可用于Pg纯化工艺的过程样品检测(过程监控),也可用于原液、半成品和成品的内控检测。
