四价流感病毒裂解疫苗中Triton X-100残留量高效液相色谱检测方法的建立、验证及与比浊法的对比
2021-05-19樊雪吴铮王一平李璇周荔葆
樊雪,吴铮,王一平,李璇,周荔葆
辽宁成大生物股份有限公司研发部,辽宁沈阳110179
四价流感病毒裂解疫苗系用甲型和乙型流感病毒株(每型各两种病毒株型)接种于鸡胚培养适宜时间后,收获病毒液,再经病毒灭活、纯化、裂解等工艺步骤后配制而成。在临床上用于预防由这4种病毒株型导致的流行性感冒。在生物制品生产工艺过程中,常将Triton X-100作为裂解剂或灭活剂,而Triton X-100本身具有一定的刺激性,残留的Triton X-100需在后续纯化工艺步骤中去除[1-2]。在流感病毒裂解疫苗生产工艺过程中,加入了Triton X-100对病毒进行裂解[3],后续工艺中可能会有部分残留,《中国药典》三部(2015版)对其残留量进行了明确的规定[4],因此,需对其工艺过程中的Triton X-100残留量进行检测。《中国药典》三部(2015版)“重组乙型肝炎疫苗(酿酒酵母)”项下的Triton X-100残留量检测采用的是比浊法,将标准品和供试品与苯酚反应,生成具有一定浊度的复合物,其浓度与吸光度值正比[5]。但比浊法的专属性、灵敏度、准确度较差,要求供试品本身没有浊度,否则将会干扰测定。而高效液相色谱法(high performance liquid chromatography,HPLC)具有较高的专属性、灵敏度、精密度和准确度[6-7]。
本研究建立了适用于四价流感病毒裂解疫苗中Triton X-100残留量检测的HPLC法,对方法进行验证,并与比浊法进行对比[8],现将结果报道如下。
1 材料与方法
1.1 疫苗原液 流感病毒裂解疫苗原液(批号:2018-1225、20181226、20181227)由辽宁成大生物股份有限公司制备。
1.2 主要试剂及仪器 甲醇(批号:126273)购自美国Fisher公司;Triton X-100(批号:100M01281V)购自美国Sigma公司;苯酚(批号:20160725)购自天津市灏洋生物制品科技有限责任公司;高效液相色谱仪(LC-2010A)购自日本SHIMADZU公司;色谱柱BDS HYPERSIL C18(250 mm×4.6 mm,5μm)购自美国Thermo公司;紫外可见分光光度计(ultrospec 2100 pro)购自美国Amersham Biosciences公司。
1.3 HPLC法的建立及验证
1.3.1 色谱条件的筛选
1.3.1.1 流动相比例的筛选 选择流动相水∶甲醇比例分别为30∶70、20∶80、10∶90,考察Triton X-100在色谱柱上的保留。
1.3.1.2 流速的筛选 选择流速分别为1.0、1.2、1.4 mL/min,考察待测物保留行为。
1.3.1.3 进样量的筛选 选择进样量分别为5、10、20μL,考察待测物保留行为。
1.3.2 溶液的配制
1.3.2.1 Triton X-100对照品储备液 精密称取Triton X-100对照品100 mg,放置于100 mL容量瓶中,用超纯水溶解并定容,得到浓度为1 000μg/mL的对照品储备液。
1.3.2.2 工作溶液 精密量取1 000μg/mL的Triton X-100储备液1、0.5、0.2、0.1 mL至10 mL容量瓶中,定容,得到浓度为100、50、20、10μg/mL的对照品工作溶液。精密量取10μg/mL的Triton X-100工作溶液5、2、1 mL至10 mL容量瓶中,定容,得到浓度为5、2、1μg/mL的对照品工作溶液。
1.3.3 方法的验证
1.3.3.1 系统适用性和专属性 取10μg/mL的对照品溶液,按照确定的色谱条件进样6次,记录色谱图,测定理论塔板数和分离度。同时记录空白溶液和供试品溶液色谱图。
1.3.3.2 线性及范围 取2、5、10、20、50、100μg/mL的对照品工作溶液,按照确定的色谱条件进样,考察线性和范围。以各样品测得的峰面积(A)为纵坐标,加入对照品溶液浓度(C)为横坐标,进行线性回归。
1.3.3.3 准确性 精密量取供试品(批号:20181225)9份,每份1 mL,分别精密加入Triton X-100对照品,配制成8、10、12μg/mL的加标样品,每个浓度各3份,按照确定的色谱条件进样。计算回收率。
1.3.3.4 精密性 精密量取供试品(批号:20181225)6份,每份1 mL,精密加入Triton X-100对照品,配制成10μg/mL的加标样品,按照确定的色谱条件进样,计算Triton X-100峰面积的RSD,验证方法的重复性。另一名试验员在第2天同法操作,验证方法的中间精密性。
1.3.3.5 定量限及检测限 逐步稀释10μg/mL的Triton X-100对照品溶液,按照确定的色谱条件进样,确定该方法的定量限及检测限。
1.3.3.6 耐用性 考察色谱柱温度(30±2)℃,流动相流速(1.2±0.1)mL/min的耐用性。分别取10μg/mL的对照品工作液进样6次,计算RSD和相对误差(RE)。
1.4 比浊法的验证
1.4.1 溶液的配制 取含量为100μg/mL的对照品工作溶液,配制成浓度为10、20、40、60、80μg/mL的工作溶液。
1.4.2 方法的步骤 参照《中国药典》三部(2015版)“重组乙型肝炎疫苗(酿酒酵母)”项下检测方法,取供试品2 mL,加入5%苯酚溶液1 mL,充分反应后在340 nm波长处测定吸光度值。
1.4.3 方法的验证
1.4.3.1 线性和范围 取10、20、40、60、80、100μg/mL对照品系列工作溶液2 mL于试管中,每个浓度取2份,每管分别加入5%苯酚溶液1 mL,迅速涡旋振荡,室温放置15 min。以生理盐水作为空白对照,在波长340 nm处测定吸光度值。以对照品溶液中Triton X-100的含量对其吸光度值做线性回归,计算相关系数。
1.4.3.2 准确性 精密量取供试品(批号:20181225)9份,分别精密加入低、中、高3个浓度的Triton X-100对照品工作溶液,配制成20、40、80μg/mL的加标样品,每个浓度各3份,按照1.4.2.1项步骤进行分析。并计算回收率。
1.4.3.3 精密性 精密量取供试品(批号:20181225)6份,每份2 mL,按照1.4.2.1项步骤进行分析。将供试品的吸光度值带入标准曲线中进行计算得到样品含量,并计算RSD,验证方法的重复性。另一名试验员在隔天同法操作,精密量取供试品6份,计算RSD,验证方法的中间精密性。
1.4.3.4 定量限 将10μg/mL的定量限工作溶液按照1.4.2.1项步骤进行6次平行试验,计算RSD。
1.5 两种方法的对比
1.5.1 方法学对比 将HPLC法与比浊法的主要方法学验证结果进行对比。
1.5.2 供试品Triton X-100残留量测定结果对比取流感病毒裂解疫苗原液3批供试品,按照确定的色谱条件进样分析,记录峰面积,计算Triton X-100残留量。同时将这3批供试品采用比浊法,按照
1.4.2.1 项步骤进行分析,测定Triton X-100残留量。
2 结果
2.1 HPLC法的建立及验证
2.1.1 色谱条件的确定
2.1.1.1 流动相比例 甲醇占70%时,难以将待测物洗脱下来,且色谱峰宽,柱效低;甲醇占80%和90%时,待测物洗脱峰型良好,对称性和柱效符合分析检测的要求。综合考虑节约有机相的使用等因素,最终选择流动相比例为水∶甲醇=20∶80。
2.1.1.2 流速 流速为1.0 mL/min时,色谱峰展宽,对称性和柱效不理想;流速为1.2 mL/min时,待测物洗脱峰对称性良好,对称性和柱效符合分析检测的要求;流速为1.4 mL/min时,柱压较高,可能影响色谱柱和色谱仪的使用寿命。最终选择流速为1.2mL/min。
2.1.1.3 进样量 进样量为5μL时,灵敏度低,检测限和定量限不能满足要求;进样量为20μL时,由于待测物黏度大,造成色谱峰难以洗脱,峰拖尾。最终选择进样量为10μL,符合定量检测的要求。
2.1.1.4 色谱条件 采用ODS C18反相色谱柱,型号规格为:BDS HYPERSIL C18(250 mm×4.6 mm,5μm);流动相:超纯水∶甲醇=20∶80;流速:1.2 mL/min;检测波长:230 nm;进样量:10μL;柱温:30℃;运行时间:12 min。
2.1.2 方法的验证
2.1.2.1 系统适用性和专属性 空白溶液、对照品溶液和供试品溶液的色谱图见图1。Triton X-100色谱峰的理论塔板数不低于3 000,分离度大于1.5,表明杂质对测定无干扰,方法的系统适用性和专属性良好。
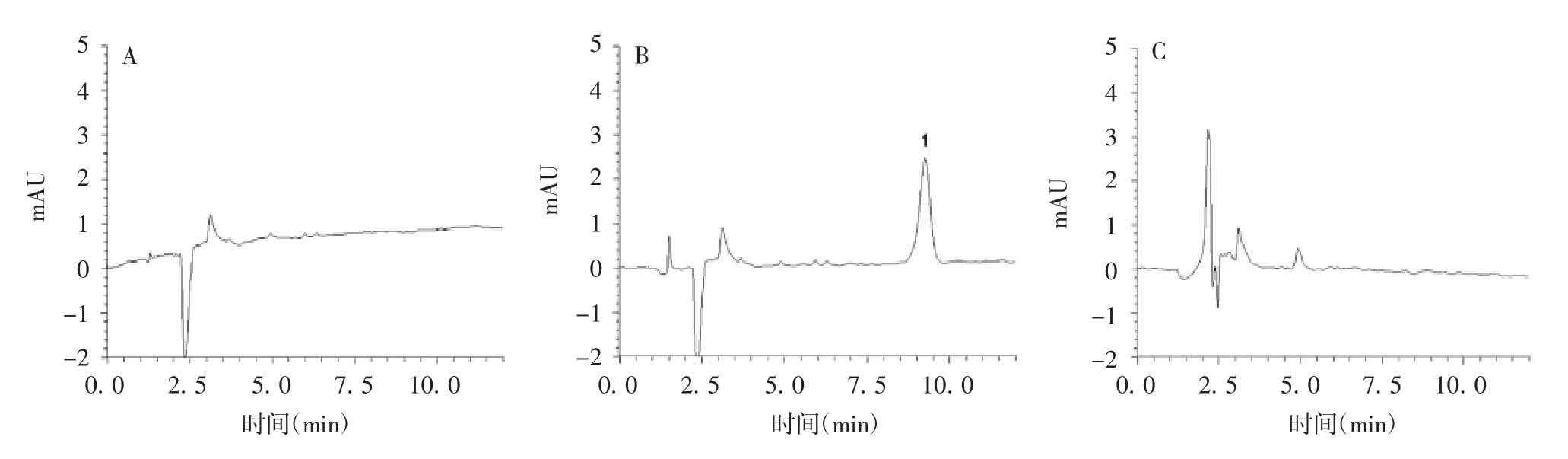
图1 空白溶剂(A)、对照品溶液(B)、供试品溶液(C)的高效液相色谱图Fig.1 HPLC profile of blank solvent(A),control solution(B)and test sample solution(C)
2.1.2.2线性和范围 回归方程为Y=6 478.21X+2 449.11,r=0.999 9。Triton X-100在2~100μg/mL浓度范围内,线性关系良好。
2.1.2.3 准确性 不同加标样品的回收率均在95%~105%之间,见表1。表明该方法准确性良好。
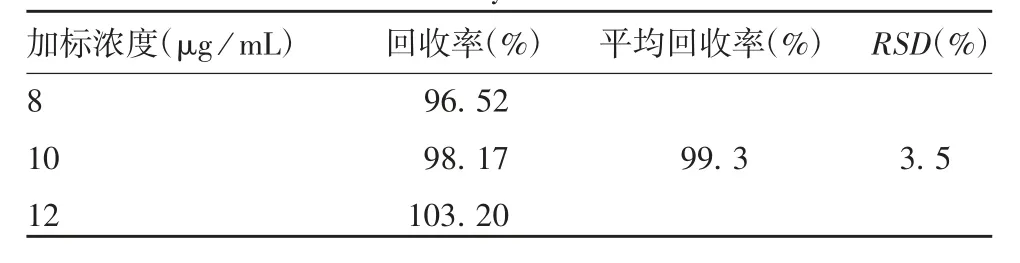
表1 HPLC准确性验证结果Tab.1 Verification for accuracy of HPLC
2.1.2.4 精密性 重复性和中间精密性试验的RSD分别为2.8%和3.9%,均小于5%,表明该方法重复性和中间精密性良好。
2.1.2.5 定量限及检测限 测得Triton X-100的定量限为2μg/mL(S/N>10),检测限为1μg/mL(S/N>3),RSD分别为3.5%和5.2%,均小于10%。
2.1.2.6 耐用性 经计算,色谱柱温度(30±2)℃,流动相流速(1.2±0.1)mL/min的RSD均小于5%,RE在90%~110%之间,见表2。表明该方法耐用性良好。

表2 HPLC耐用性验证结果(%)Tab.2 Verification for durability of HPLC(%)
2.2 比浊法的验证
2.2.1 线性和范围 回归方程为Y=0.011 8X+0.1542,r=0.996 5。Triton X-100在10~100μg/mL浓度范围内,线性关系良好。
2.2.2 准确性 不同加标浓度样品的回收率在85%~115%之间,见表3。表明该方法准确性良好。

表3 比浊法准确性验证结果(%)Tab.3 Verification for accuracy of turbidimetric method(%)
2.2.3 精密性 重复性和中间精密性试验的RSD分别为5.8%和7.2%,均小于10%,表明该方法重复性和中间精密性良好。
2.2.4 定量限6次平行试验的RSD为10.2%,小于15%。
2.3 两种方法的对比
2.3.1 方法学对比结果HPLC法方法学的主要验证结果均优于比浊法,见表4。

表4 HPLC法与比浊法方法学主要验证结果对比Tab.4 Methodological verification of HPLC and turbidimetric method
2.3.2 供试品Triton X-100残留量测定结果对比HPLC法测定3批供试品Triton X-100残留量均<2μg/mL,比浊法测定3批供试品Triton X-100残留量均<10μg/mL。
3 讨论
四价流感病毒裂解疫苗采用鸡胚培养,Triton X-100是适合用于裂解流感病毒的裂解剂,广泛应用于市售流感病毒裂解疫苗的裂解工艺中[9-12]。而Triton X-100是一种非离子表面活性剂,其浓度达到0.1%时能破坏生物膜,使细胞溶解破坏,还可能引起人体过敏反应[13],因此对其残留量应严格控制。四价流感病毒裂解疫苗的抗原为血凝素,其成分中蛋白质含量较高,对Triton X-100残留量的检测可能产生干扰,因此本实验考察了不同方法检测Triton X-100的适用性。
由于Triton X-100的黏度大,对反相色谱柱吸附较大难以洗脱,易造成色谱峰展宽,因此本实验考察了HPLC法的流动相比例(水∶甲醇=30∶70、20∶80、10∶90)、流速(1.0、1.2、1.4 mL/min)、进样量(5、10、20μL)等条件。综合考虑色谱柱的柱压力和使用寿命,最终选择了超纯水∶甲醇=20∶80、流速1.2 mL/min、进样量10μL、检测波长230 nm为最佳条件,在此条件下,色谱的柱效较高,能够满足定量分析的需要。
将相同样品采用HPLC法和比浊法进行对比测定,结果显示,HPLC法的专属性好,线性良好(r=0.999 9)、准确性较高(回收率99.3%)、精密性良好(RSD<5%),各项验证结果均优于比浊法。且当供试品本身蛋白含量较高,有乳浊色时,比浊法不适用。比浊法的定量限为10μg/mL,HPLC法的定量限为2μg/mL。因此,HPLC法具有更大的优势。
综上所述,本实验建立的测定流感病毒裂解疫苗中Triton X-100残留量的HPLC法,具有良好的专属性、线性、准确性、精密性和耐用性,试验结果稳定可靠,适用于流感病毒裂解疫苗中Triton X-100残留量的检测。
